- Propyne
-
Propyne 
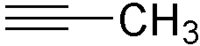
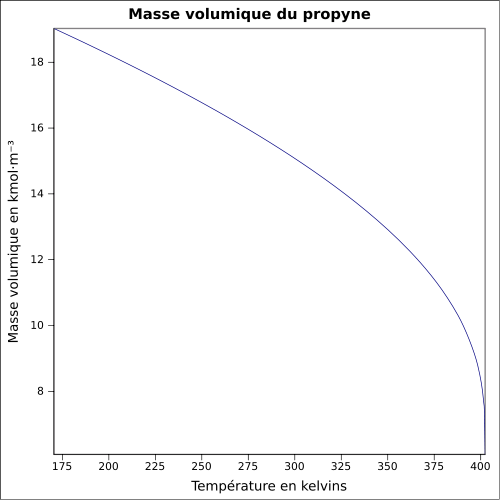
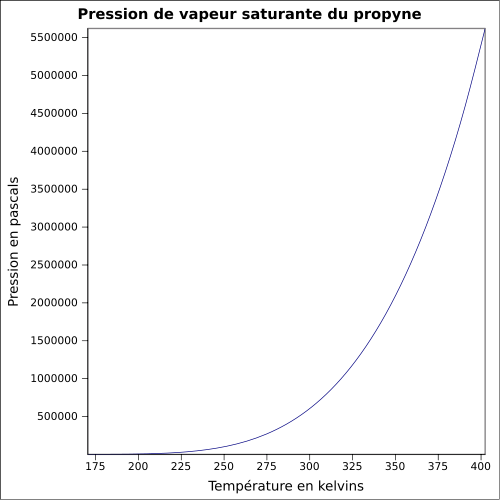
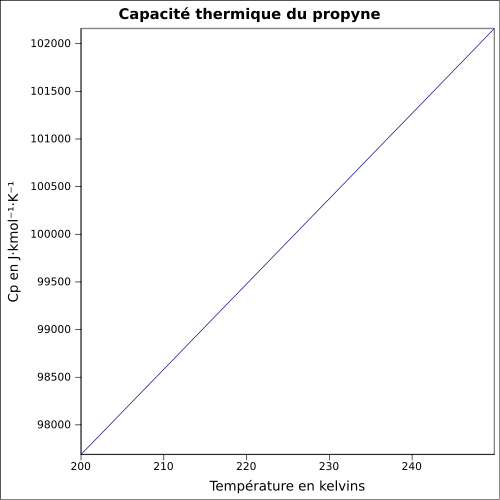
Général Nom IUPAC propyne Synonymes méthylacétylène No CAS No EINECS SMILES InChI Apparence gaz comprimé incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C3H4 [Isomères] Masse molaire[3] 40,0639 ± 0,0027 g·mol-1
C 89,94 %, H 10,06 %,Moment dipolaire 0,784 ± 0,001 D[2] Propriétés physiques T° fusion -102,7 °C[1] T° ébullition -23,23 °C[4] Solubilité dans l'eau : 3,6 g·l-1[1] Masse volumique 0,70 g·cm-3[1] Point d’éclair Gaz Inflammable[1] Limites d’explosivité dans l’air 2,4–11,7 %vol[1] Pression de vapeur saturante à 20 °C : 521 kPa[1] Point critique 5 628 kPa[6], 129,24 °C[4] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 10,37 ± 0,01 eV (gaz)[8] Précautions Transport - 1954 NFPA 704 SIMDUT[9] 

Unités du SI & CNTP, sauf indication contraire. Le propyne est un composé insaturé aliphatique de formule chimique C3H4. C'est un gaz incolore très inflammable qui appartient à la famille des alcynes. C'est un des composés du gaz MAPP, avec l'un de ses isomères, le propadiène, gaz utilisé pour le soudage et l'oxycoupage. Contrairement à l'acétylène le méthylacétylène peut être compressé sans danger[10].
Sommaire
Propriétés
Le propyne est un gaz relativement stable, quoique très inflammable. En grande concentration, il devient asphyxiant.
C'est un gaz incolore d'odeur caractéristique, plus lourd que l'air, presque insoluble dans l'eau
Production et équilibre avec le propanediène
Le méthylacetylène existe en équilibre avec le propadiène. Le mélange des deux gaz est appelé MAPD:
- H3CC≡CH = H2C=C=CH2, Keq = 0.22 (270 °C), 0.1 K (5 °C)
Le MAPD est un produit secondaire, souvent indésirable, du cracking du propane pour produire du propène, élément important dans l'industrie chimique[10]. Présent, il interfère en effet dans la polymérisation catalytique du propène (synthèse de polypropylène).
Utilisations
En chimie organique
Le propyne est une molécule avec un squelette de trois atomes de carbone utile en synthèse organique. Sa triple liaison le rend très réactif, en particulier pour des réactions d'addition nucléophile.
Sa déprotonation avec len-butyllithium donne le propynyl lithium. Ce dernier un réactif nucléophile qui peut réagir avec des groupes carbonyles pour produire des alcools est des esters[11]. Comme la purification du propyne coûte cher, on utilise généralement le gaz MAPP, meilleur marché[12].
Carburant pour fusée
L'agence spatiale européenne, qui travaille sur des systèmes hydrocarbure léger/oxygène liquide comme mélange à haut rendement propulsif et qui seraient moins toxiques que le « classique » monométhylhydrazine/peroxyde d'azote, a montré que le propyne présentait de nombreux avantages comme carburant pour fusée pour des engins destinés à une orbite basse.
Notes et références
- PROPYNE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », dans J. Phys. Chem. Ref. Data, vol. 32, no 4, 4 août 2003, p. 1411 [lien DOI]
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », dans J. Phys. Chem. Ref. Data, vol. 35, no 4, 18 septembre 2006, p. 1461 [lien DOI]
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., 1996 (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 9781420066791), p. 10-205
- « Méthylacétylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Peter Pässler, Werner Hefner, Klaus Buckl, Helmut Meinass, Andreas Meiswinkel, Hans-Jũrgen Wernicke, Günter Ebersberg, Richard Müller, Jürgen Bässler, Hartmut Behringer, Dieter Mayer, "Acetylene" in Ullmann's Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2007. 10.1002/14356007.a01 097.pub2
- Michael J. Taschner, Terry Rosen, and Clayton H. Heathcock, Ethyl Isocrotonate, vol. 7, page 226, 1990, CV7P0226
- US patent number 5744071, 1996, Philip Franklin Sims, Anne Pautard-Cooper, Processes for preparing alkynyl ketones and precursors thereof
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « methylacetylene » (voir la liste des auteurs)
Wikimedia Foundation. 2010.