- ⌬
-
Benzène
Benzène 
Structure et représentations du benzène Général Nom IUPAC Benzène No CAS No EINECS SMILES InChI Apparence liquide incolore, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C6H6 [Isomères] Masse molaire 78,1118 g∙mol-1
C 92,26 %, H 7,74 %,Propriétés physiques T° fusion 6 °C[1] T° ébullition 80 °C[1] Solubilité dans l'eau à 25 °C : 0.18 g/100 ml[1] Masse volumique (eau = 1) : 0.88[1] T° d’auto-inflammation 498 °C[1] Point d’éclair -11 °C (c.f.)[1] Limites d’explosivité dans l’air en volume % dans l'air : 1.2-8.0[1] Pression de vapeur saturante à 20 °C : 10 kPa[1],
12,6 kPa à 25 °CViscosité dynamique 0,065 Pa.s à 20 °C Tension superficielle 28,9.10-3 N/m à 20 °C Thermochimie S0gaz, 1 bar 269 J/mol·K S0liquide, 1 bar 173,4 J/mol·K ΔfH0gaz 83,0 Joule/mol ΔfH0liquide 49,1 Joule/mol Cp 136,0 J/mol·K Précautions Directive 67/548/EEC 
T
FPhrases R : 11, 36/38, 45, 46, 48/23/24/25, 65, Phrases S : 45, 53, [2] Transport 33 1114 NFPA 704 SIMDUT[4] 

SGH[5] 

DangerClassification du CIRC Groupe 1 : Cancérogène pour l'homme[3] Inhalation confusion, tachycardie Yeux dangereux Écotoxicologie LogP 2.13[1] Unités du SI & CNTP, sauf indication contraire. Le benzène est un hydrocarbure aromatique monocyclique, de formule C6H6, également noté Ph-H, φ-H ou encore Ar-H. Ce composé organique incolore (il a d'ailleurs le même indice de réfraction que le verre) est un liquide cancérogène. C'est un solvant très utilisé dans l'industrie chimique, et un précurseur important pour la synthèse chimique de médicaments, de plastiques, de caoutchouc synthétique ou encore de colorants. Le benzène est un constituant naturel du pétrole brut, mais il est généralement synthétisé à partir d'autres composés organiques présents dans le pétrole.
Sommaire
Historique
Le benzène a été découvert en 1825 par le scientifique britannique Michael Faraday qui l'isola du pétrole et le baptisa bicarburet of hydrogen[6],[7]. En 1833, le chimiste allemand Eilhard Mitscherlich le produisit par distillation de l'acide benzoïque (composant de la gomme benjoin) et de la chaux. Mitscherlich baptisa ce composé benzin[8]. En 1845, le chimiste britannique Charles Mansfield, travaillant sous la direction d'August Wilhelm von Hofmann, l'isola du goudron de houille. Quatre ans plus tard, il lançait la première production de benzène à l'échelle industrielle à partir de goudron de houille. En 1868, Marcellin Berthelot le synthétise par trimérisation de l'acétylène.
 Structure du benzène Dewar
Structure du benzène Dewar
Pendant quelques années, la formule chimique du benzène, C6H6, causa un grand nombre d'interrogations concernant la structure du composé[9]. Plusieurs structures furent proposées successivement sans parvenir à expliquer les propriétés chimiques du composé, parmi lesquelles, par exemple, celle proposée par James Dewar, présentée ci-contre (à gauche), le [3]prismane proposé par Ladenburg, le benzvalène, le benzène Claus, etc.
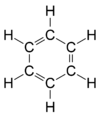 Représentation de von Stradonitz
Représentation de von Stradonitz
La première forme structurale correcte fut proposée en 1861 par Johann Josef Loschmidt, qui fournit une base à la première interprétation correcte de la structure du benzène proposée par le chimiste allemand Friedrich August Kekulé von Stradonitz en 1865 (à droite).[10],[11] La planéité de ce composé est un des faits particulièrement intéressants de la chimie. Kekulé mit en évidence le fait que plusieurs représentations (dites de nos jours de Lewis) de cette molécule sont équivalentes. Plus précisément, les doubles liaisons peuvent être placées n'importe où sur le cycle, de manière alternée.
Cependant, des chercheurs découvrirent en utilisant la diffraction des rayons X que toutes les liaisons carbone-carbone de la molécule de benzène possèdent la même longueur, ce qui n'est pas compatible avec la représentation ci-contre. En effet, une liaison simple est plus longue qu'une liaison double. De plus, la longueur de liaison dans la molécule de benzène est à la fois plus grande que la longueur d'une liaison double carbone-carbone, et plus faible que celle d'une liaison simple. Tout se passe comme s'il existait une liaison et demie entre chacun des atomes de carbone.
Il faudra attendre la théorie des orbitales hybrides (élaborée par Linus Pauling, prix Nobel de chimie et prix Nobel de la paix, dans sa publication La nature de la liaison chimique) pour expliquer ce fait avec une grande élégance, et ce définitivement. En effet les liaisons chimiques peuvent être décrites avec une approximation raisonnable comme étant formées par des recouvrements d'orbitales atomiques (en méthode CLOA, Combinaison Linéaire d'Orbitales Atomiques, n orbitales atomiques se mélangent pour former n orbitales moléculaires). Les orbitales moléculaires obtenues par cette combinaison linéaire peuvent induire des effets de délocalisation des électrons.
Délocalisation-mésomérie
 Représentation des formes mésomères du benzène
Représentation des formes mésomères du benzène
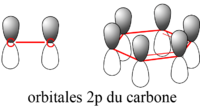
On explique la planéité du benzène par le fait que dans cette conformation, les orbitales 2p (x ou y) pures (c’est-à-dire non hybridées) des atomes de carbone optimisent leur recouvrement latéral. Il n'y a donc pas réellement de double liaison entre deux carbones donnés, mais ce qui est appelé un système pi résonnant (ou délocalisé) que l'on peut décrire comme un vaste nuage électronique réparti équitablement entre tous les atomes de carbone.
Les électrons pi sont donc répartis sur tous les atomes de carbone, et la molécule peut être représentée comme la superposition des deux formes suivantes, appelées formes mésomères :
En réalité, aucune des deux formes représentées ci-dessus n'existe. La délocalisation doit être représentée d'une manière différente que par la simple utilisation de liaisons simples et de liaisons doubles. Dans une molécule organique, les liaisons simples sont des liaisons σ, formées d'électrons dont la probabilité de présence est très importante entre les atomes (recouvrement axial). Les liaisons doubles sont formées à la fois d'une liaison σ et d'une liaison π, celles-ci étant construites à partir des électrons 2p (x ou y) du carbone, comme illustré sur le schéma suivant (dans la partie de gauche, les liaisons σ sont représentées en rouge, les orbitales 2p en blanc et gris) :
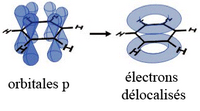
Les orbitales 2p (x ou y) étant en dehors du plan constitué par les atomes, elles peuvent interagir librement, ce qui conduit à la délocalisation des électrons : chaque électron n'est pas rattaché spécifiquement à un atome ou une liaison, mais est délocalisé sur tout l'anneau, renforçant chacune des liaisons de manière équivalente :
Pour représenter ce caractère délocalisé des liaisons, le benzène est généralement représenté par un cercle contenu dans un hexagone :
Une méthode plus puissante permet de mieux décrire la structure électronique du benzène : la méthode des orbitales moléculaires. Cette méthode a été mise en œuvre par Erich Hückel en 1931 et nécessite le calcul d’un déterminant à six lignes et six colonnes et permet d'obtenir le diagramme énergétique du benzène.
Aromaticité
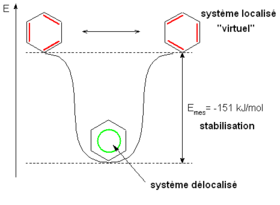
Cette délocalisation des électrons est appelée aromaticité. Elle est responsable de nombreuses propriétés du benzène, et notamment de sa grande stabilité.
Par rapport à un système « virtuel », pour lesquels les liaisons π seraient localisées (chaque liaison localisée entre deux atomes de carbone), le système réel dans lequel les liaisons π sont délocalisées sur la totalité du cycle est stabilisé de plus de 150 kJ⋅mol-1. Les réactions chimiques auxquelles participe le benzène sont donc préférentiellement celles pour lesquelles cette stabilisation est conservée.
Caractérisation et propriétés physico-chimiques
Le benzène est un liquide incolore, dont l'indice de réfraction est 1,50 (proche de celui du verre). Sa viscosité est plus faible que celle de l'eau. Il est très soluble dans les solvants organiques polaires, mais sa solubilité dans l'eau est assez faible. Il possède une odeur caractéristique, avec un seuil de détection de 1,5 à 900 mg⋅m-3 d'air.
En spectroscopie d'absorption infrarouge, le benzène présente une bande d'absorption au voisinage de 1 500-1 600 cm-1 due aux vibrations des liaisons carbone-carbone, et plusieurs pics d'absorption entre 650 et 1 000 cm-1 dus aux vibrations des liaisons carbone-hydrogène. La position et l'amplitude de ces derniers pics donnent des informations sur les substitutions éventuelles d'atomes d'hydrogène.
En Résonance magnétique nucléaire (RMN) du proton, il présente un pic de déplacement chimique δ à 7-8 ppm.
Production
Le benzène est produit lorsque des composés riches en carbone subissent une combustion incomplète. Par exemple, il est produit naturellement dans les volcans ou les incendies de forêts. Il est également présent dans la fumée de cigarette.
Jusqu'à la Seconde Guerre mondiale, le benzène était en majeure partie un produit secondaire de la production de coke dans l'industrie de l'acier. Cependant au cours des années 1950, la demande croissante de benzène, notamment dans l'industrie du plastique, a entraîné la nécessité de produire du benzène à partir de pétrole. À l'heure actuelle, la majeure partie du benzène est produite par l'industrie pétrochimique, avec une part mineure issue du charbon.
La production industrielle de benzène est issue de manière à peu près égale de trois procédés chimiques : le reformage catalytique, l'hydrodésalkylation du toluène et le vapocraquage. En 1996, la production mondiale de benzène était de 33 millions de tonnes dont 7 millions aux États-Unis, 6,5 millions dans l'Union européenne, 4,2 millions au Japon, 1,4 million en Corée du Sud et 1 million en Chine[12].
Reformage catalytique
Au cours du reformage catalytique, un mélange d'hydrocarbures de températures d'ébullition comprises entre 60 °C et 200 °C est mélangé à du dihydrogène, puis passé sur des catalyseurs (chlorure de platine ou chlorure de rhénium) à une température comprise entre 500 °C et 525 °C et une pression comprise entre 8 et 50 atm. Dans ces conditions, les hydrocarbures aliphatiques forment des cycles et perdent des atomes d'hydrogène pour devenir aromatiques. Les composés aromatiques produits au cours de la réaction sont alors séparés du mélange réactionnel par extraction en utilisant des solvants comme le sulfolane ou le diéthylène glycol. Le benzène est ensuite séparé des autres composés aromatiques par distillation.
Hydrodésalkylation du toluène
L'hydrodésalkylation du toluène permet de convertir le toluène en benzène. Dans ce procédé chimique, le toluène est mélangé à du dihydrogène, puis passé sur un catalyseur (oxyde de chrome, de molybdène ou de platine) à une température comprise entre 500 °C et 600 °C et une pression comprise entre 40 et 60 atm. Il est également possible de se passer de catalyseur en utilisant des températures plus élevées. Dans ces conditions, le toluène subit une désalkylation (perte du groupement alkyle, ici un groupement méthyle) :
Le rendement de cette réaction est supérieur à 95 %. Parfois, des composés aromatiques plus lourds comme le xylène sont utilisés à la place du toluène avec des rendements similaires.
Vapocraquage
Le vapocraquage est un procédé utilisé pour produire de l'éthylène et d'autres alcènes à partir d'hydrocarbures aliphatiques. Suivant le composé de départ utilisé dans le procédé, le vapocraquage peut également produire un produit secondaire liquide riche en benzène. Ce liquide peut être mélangé à d'autres hydrocarbures en tant qu'additif pour l'essence, ou distillé pour le séparer en différents composés dont le benzène.
Utilisations
Avant les années 1920, le benzène était fréquemment utilisé comme solvant industriel, particulièrement pour dégraisser les métaux. Lorsque sa toxicité devint évidente, il fut remplacé par d'autres solvants pour les applications nécessitant une exposition directe de l'utilisateur.
Le benzène est utilisé en majeure partie comme intermédiaire dans la synthèse d'autres composés chimiques. Les dérivés du benzène produits dans les plus grandes quantités sont le styrène, utilisé pour fabriquer des polymères et des plastiques, le phénol, utilisé pour fabriquer des résines et des adhésifs, et le cyclohexane, utilisé pour fabriquer le nylon. Des quantités moins importantes de benzène sont utilisées dans la fabrication de pneus, de lubrifiants, de colorants, de détergents, de médicaments, d'explosifs ou de pesticides. Dans les années 1980, les principaux composés produits à partir de benzène étaient l'éthylbenzène (intermédiaire pour la fabrication du styrène) avec 48 % de la consommation du benzène utilisé pour la synthèse, le cumène 18 %, le cyclohexane 15 % et le nitrobenzène 7 %.
En tant qu'additif à l'essence, le benzène permet d'augmenter l'indice d'octane, agissant donc comme antidétonant. De ce fait, jusque dans les années 1950 l'essence contenait fréquemment quelques pour cent de benzène, quand il fut remplacé par le tétraéthylplomb dans les additifs antidétonants les plus utilisés. Cependant, le benzène a fait son retour dans de nombreux pays suite aux réglementations concernant la teneur en plomb de l'essence. Aux États-Unis, les préoccupations concernant ses effets nocifs sur la santé et la possibilité de contamination des nappes phréatiques ont conduit à la mise en place d'une réglementation stricte concernant la teneur en benzène des carburants avec une limite voisine de 1 %[13]. En Europe, cette même limite de 1 % a été fixée.
Réactions chimiques utilisant le benzène
La réactivité chimique du benzène est fortement dépendante de son caractère aromatique. Par exemple, la plupart des alcènes peuvent être hydrogénés (la liaison double est transformée en liaison simple par addition d'hydrogène) sous une pression de 1 atm à température ambiante dans une réaction catalysée par le nickel. Dans le cas du benzène, cette même réaction doit être réalisée à 180 °C sous une pression de 2 000 atm. En effet, l'addition d'hydrogène fait perdre le caractère aromatique, et donc la délocalisation des électrons qui contribue à stabiliser fortement le composé. Le benzène aura donc plutôt tendance à réagir par substitution de l'hydrogène, conservant ainsi son caractère aromatique.
Substitution électrophile aromatique
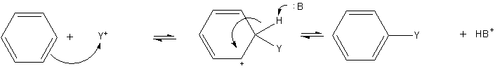
Article détaillé : Substitution électrophile aromatique.La substitution électrophile aromatique est une réaction générique au cours de laquelle l'un des atomes d'hydrogène est substitué par un autre groupe fonctionnel. Au cours de cette réaction, le benzène joue le rôle de nucléophile, et réagit avec un réactif électrophile comme par exemple un carbocation. Le mécanisme simplifié de la réaction est le suivant :
La charge positive portée par l'intermédiaire réactionnel, nommé intermédiaire de Wheland, est en réalité délocalisée sur le cycle par mésomérie, ce qui tend à stabiliser le carbocation benzénique. Cette réaction nécessite généralement un catalyseur de type acide de Lewis.
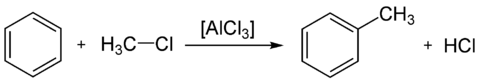
Alkylation de Friedel-Crafts
Article détaillé : Alkylation de Friedel-Crafts.L'alkylation de Friedel et Crafts est similaire à l'acylation, à ceci près qu'elle constitue l'alkylation d'un composé aromatique, comme le benzène, par un halogénure d'alkyle. Elle est également catalysée par un acide de Lewis puissant :
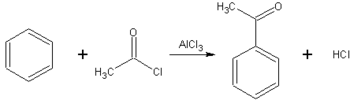
Acylation de Friedel-Crafts
Article détaillé : Acylation de Friedel-Crafts.L'acylation de Friedel et Crafts est un cas particulier de substitution électrophile aromatique. Cette réaction est l'acylation d'un composé aromatique, comme le benzène, par un chlorure d'acyle. Cette réaction est catalysée par un acide de Lewis puissant (comme AlCl3 ici) :
Benzène substitué
Un grand nombre de composés chimiques très importants dans l'industrie sont obtenus en remplaçant un ou plusieurs atomes d'hydrogène du benzène par d'autres groupes fonctionnels.
Substitution par des groupements alkyles
- le toluène C6H5-CH3
- l'éthylbenzène C6H5-CH2CH3
- le xylène C6H4(-CH3)2
- le mésitylène C6H3(-CH3)3
Substitutions par d'autres groupements
- le phénol C6H5-OH
- l'aniline C6H5-NH2
- le chlorobenzène C6H5-Cl
- le nitrobenzène C6H5-NO2
- l'acide picrique C6H2(-OH)(-NO2)3
- le trinitrotoluène C6H2(-CH3)(-NO2)3
- l'acide benzoïque C6H5-COOH
- l'acide salicylique C6H4(-OH)(-COOH)
- l'acide acétylsalicylique C6H4(-O-C(=O)-CH3)(-COOH) (plus connu sous le nom d'aspirine)
- le paracétamol C6H4(-NH-C(=O)-CH3)-1-(-OH)-4
- la phénacétine C6H4(-NH-C(=O)-CH3)(-O-CH2-CH3)
Anneaux aromatiques soudés
- le naphtalène
- l'anthracène
- le phénanthrène
- l'indole
- le benzofurane
- la quinoléine
- l'isoquinoléine
Effets sur la santé
L'intoxication par le benzène seul porte le nom de benzénisme ; celle par le benzène et/ou par ses dérivés (toluène, xylène, etc.) porte le nom de benzolisme.
L'inhalation d'un taux très élevé de benzène peut causer la mort ; une exposition de cinq à dix minutes à un taux de benzène dans l'air de 2 % environ suffit pour entraîner la mort..
Des taux moins élevés peuvent occasionner des somnolences, des vertiges, une accélération du rythme cardiaque, des maux de tête, des tremblements, la confusion ou la perte de connaissance. La dose létale par ingestion est de 50 mg⋅kg-1. L'ingestion de nourriture ou de boissons contenant des taux élevés de benzène peut occasionner des vomissements, une irritation de l'estomac, des vertiges, des somnolences, des convulsions, une accélération du rythme cardiaque, voire la mort.
Le principal effet d'une exposition chronique au benzène serait l'endommagement de la moelle osseuse et la diminution des cellules souches hématopoïétiques, ce qui peut occasionner une décroissance du taux de globules rouges dans le sang et une anémie aplasique ou une leucémie. L'exposition chroniques à de faibles doses, telles que celles qu'on peut respirer à proximité d'une station-service ou d'un garage automobile, selon une étude française récente [14], pour un enfant, habitant près d'une telle source augmenterait (de + 60 %) le risque de leucémie aigüe.
Il peut également occasionner des saignements et un affaiblissement du système immunitaire.
L'effet du benzène sur la fertilité de l'homme ou le bon développement du fœtus n'est pas connu mais une étude récente faite sur un échantillon de 271 femmes enceintes et non fumeuses a montré un risque accru de réduction du poids du bébé à la naissance et de son périmètre crânien si la maman a été exposée à du benzène et aux polluants souvent associés au benzène[15]. Ces mamans avaient lors de leur 27e semaine de grossesse porté un appareil dosant plusieurs polluants de l’air ambiant. Ils ont montré qu'elles avaient été exposés en moyenne à 1,8 µg⋅m-3), avec des taux variant de 0,5 à 7,5 μg⋅m-3. Cette étude a accessoirement montré que la limite de 5 μg⋅m-3 proposée comme objectif par l'UE pour 2010 a donc été dépassé dans 10 % des cas.
Enfin, le benzène est reconnu comme cancérogène, en raison du fait qu'il se comporte comme un agent intercalant (c’est-à-dire qu'il se glisse entre les bases nucléotidiques des acides nucléiques, dont l'ADN, provoquant des erreurs de lecture et/ou de réplication). On connaît d'autres agents intercalants (comme le bromure d'éthidium, ou BET, utilisé en biologie expérimentale pour marquer l'ADN notamment au cours des électrophorèses). Tous les composés plans ne sont toutefois pas cancérigènes. L'acide benzoïque, par exemple, très proche du benzène, et dont la base conjuguée est absolument plane, n'est pas cancérigène[16] (il est utilisé comme conservateur dans divers types de soda). De même la phénylalanine, un acide aminé qui comporte un groupement phényle (un cycle benzénique), n'est pas cancérigène.
En France métropolitaine, le principal secteur émetteur de benzène dans l'atmosphère est le résidentiel/tertiaire (75,8 % des émissions totales en 2007), en particulier du fait de la combustion du bois, suivi du transport routier (14,1 % en 2007), d'après le CITEPA, organisme chargé des inventaires de la pollution atmosphérique[17]. Selon le Plan Particules, intégré dans le deuxième Plan National Santé Environnement (PNSE 2), le chauffage au bois, du fait des émissions de benzène notamment, a également un impact sur la qualité de l'air intérieur[18].Il est possible d'utiliser des plantes, dont le lierre pour épurer l'air intérieur[19].
Exposition
La valeur moyenne d'exposition professionnelle (VME) dans l'Union européenne est fixée par la réglementation à 1 ppm soit 3,5 mg⋅m-3 sur 8 heures. La teneur en benzène des eaux destinées à la consommation humaine ne doit pas dépasser 1 µg⋅l-1 (à l'exception des eaux minérales).
Certaines sources d'expositions sont liés aux lieux et pratiques industrielles, de recherche (laboratoires) ou à l'industrie du parfum.
Une des expositions – du grand public mais aussi des professionnels – au benzène se fait dans les stations-service où lors du remplissage du réservoir, le pistolet laisser toujours échapper une petite partie de benzène (volatile), qui est alors inhalée par le client (ou le professionnel). Les pistolets peuvent être munis d'une protection. Celle-ci est obligatoire dans certains États comme la Californie et une directive européenne est en préparation pour imposer la récupération des vapeurs.
Une exposition chronique est néanmoins possible avec l'essence. En 2008, la Commission européenne a mis en consultation[20] un projet visant à rendre obligatoire la récupération des vapeurs d’essence lors du remplissage des réservoirs des véhicules dans les stations-service. La récupération est déjà obligatoire dans l'UE lors du stockage et de la livraison d’essence des terminaux aux stations-service[21].
Phrases de risque et phrases de sécurité
Le benzène est un composé chimique dangereux, qui doit être manipulé et utilisé avec beaucoup de précautions. Il doit être stocké entre 15 °C et 25 °C.
D'après la fiche de l'INRS (France)
Article détaillé : Signalisation des substances dangereuses.Exposé des risques et mesures de sécurité R: 11 Facilement inflammable. R: 48/23/24/25 Toxique : risque d'effets graves pour la santé en cas d'exposition prolongée par inhalation,
par contact avec la peau et par ingestion.R: 45 Peut causer le cancer. S: 45 En cas d'accident ou de malaise consulter immédiatement un médecin
(si possible lui montrer l'étiquette).S: 53 Eviter l’exposition et se procurer des instructions spéciales avant l’utilisation. 200-753-7 Etiquetage CE. D'après la fiche internationale de sécurité
Exposé des risques et mesures de sécurité R: 45 Peut causer le cancer. R: 46 Peut provoquer des altérations génétiques héréditaires. R: 11 Facilement inflammable. 36/38 Irritant pour les yeux et la peau. R: 48/23/24/25 Toxique : risque d'effets graves pour la santé en cas d'exposition prolongée par inhalation,
par contact avec la peau et par ingestion.R: 65 Nocif : peut provoquer une atteinte des poumons en cas d’ingestion. S: 53 Eviter l’exposition et se procurer des instructions spéciales avant l’utilisation. S: 45 En cas d’accident ou de malaise consulter immédiatement un médecin
et lui montrer l’emballage ou l’étiquette.Contaminations
Catastrophe de l'usine pétrochimique à Jilin
Article détaillé : Catastrophe de l'usine pétrochimique de Jilin.Suite à l'explosion d'une usine pétrochimique dans la ville de Jilin en République populaire de Chine le 13 novembre 2005, une quantité de benzène estimée à une centaine de tonnes s'est déversée dans la rivière Songhua, un important affluent du fleuve Amour. Cet accident a entraîné de nombreuses coupures d'eau dans les villes situées en aval, notamment Harbin (5 millions d'habitants).
Voir aussi
Articles connexes
Références
- ↑ a , b , c , d , e , f , g , h , i et j BENZENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « benzène » sur ESIS, consulté le 15 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Benzène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ M. Faraday, « On New Compounds of Carbon and Hydrogen, and on Certain Other Products Obtained during the Decomposition of Oil by Heat », dans Philosophical Transactions of the Royal Society of London, vol. 115, 1825, p. 440–466 [texte intégral]
- ↑ R. Kaiser, « Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968 », dans Angewandte Chemie International Edition in English, vol. 7, no 5, 1968, p. 345–350 [lien DOI]
- ↑ E. Mitscherlich, « Ueber das Benzol und die Säuren der Oel- und Talgarten », dans Annalen der Pharmacie, vol. 9, no 1, 1834, p. 39–48 [lien DOI]
- ↑ Le Benzène, de Faraday à Thiele
- ↑ F. A. Kekulé, « Sur la constitution des substances aromatiques », dans Bulletin de la Societe Chimique de Paris, vol. 3, 1865, p. 98–110
- ↑ F. A. Kekulé, « Untersuchungen uber aromatische Verbindungen », dans Liebigs Annalen der Chemie, vol. 137, 1866, p. 129–36
- ↑ Société française de chimie, Données industrielles, économiques, géographiques sur les principaux produits chimiques, métaux et matériaux
- ↑ Kolmetz, Gentry, Guidelines for BTX Revamps, AIChE 2007 Spring Conference
- ↑ Brosselin P. et al. «Acute childhood leukaemia and residence next to petrol stations and automotive repair garages: the ESCALE study (SFCE)» Occupational and Environmental Medicine (septembre 2009), vol.66, n°9 p.598-606 ; (Résumé de l'étude conduite par Jacqueline Clavel et ses collègues de l’INSERM de Villejuif, de 2003 à 2004 sur 765 enfants victimes de leucémie aigüe et 1.681 cas contrôles.
- ↑ étude conduite de 2005 à 2006, par l'Inserm et université de Grenoble, financée par l’Agence française de sécurité sanitaire de l’environnement (Afsset). La croissance des foetus a été estimée par mesure par ultrasons aux 2ème et 3e trimestre de grossesse
- ↑ fiche internationale de sécurité de l'acide benzoïque.
- ↑ CITEPA
- ↑ Dossier de presse Air (format PDF) page 18.
- ↑ Brève intitulée « Des plantes pour purifier l'air intérieur»
- ↑ Consultation on the mandatory introduction of Stage 2 Petrol Vapour Recovery Controls at Service Stations in the EU, A consultation launched by DG Environment of the European Commission (jusque'au 25 avril)
- ↑ Directive du Parlement européen et du Conseil n° 94/63/CEE du 20 décembre 1994 relative à la lutte contre les émissions de composés organiques volatils (Cov) résultant du stockage de l'essence et de sa distribution des terminaux aux stations-service
Bibliographie
- (en) Archibald Scott Couper, « On a New Chemical Theory », in Philosophical Magazine, no 16, 1858, p. 104–116 ;
- Josef Loschmidt :
- (de) Chemische Studien I, Carl Gerold's Sohn, Vienne, 1861,
- (de) Chemische Studien I, Aldrich Chemical Co, Milwaukee, (catalogue no Z-18576-0, 1989, et catalogue no Z-18577-9, 1913) ;
- Kathleen Lonsdale :
- (en) « The Structure of the Benzene Ring in Hexamethylbenzene », in Proceedings of the Royal Society, 123A : 494, 1929,
- (en) « An X-Ray Analysis of the Structure of Hexachlorobenzene, Using the Fourier Method », in Proceedings of the Royal Society, 133A : 536, 1931.
Liens externes
- (fr)Fiche internationale de sécurité ;
- (fr)Fiche de sécurité de l'INRS ;
- (fr)Ineris : Fiche de données toxicologiques et environnementales ;
- Données sur le benzène et ses dérivés sur le site de la Société française de chimie.
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique facilement inflammable | Cancérogène chimique | Produit chimique mutagène | Article de qualité | Hydrocarbure aromatique | Noyau aromatique simple | Solvant
Wikimedia Foundation. 2010.