- Titanium
-
Titane
Le titane est un élément chimique métallique de symbole Ti et de numéro atomique 22.
C'est un métal de transition léger, résistant, d'un aspect blanc métallique, qui résiste à la corrosion. Le titane est principalement utilisé dans les alliages légers et résistants, et son oxyde est utilisé comme pigment blanc. On trouve cet élément dans de nombreux minerais mais ses principales sources sont le rutile et l'ilménite. Il appartient au groupe des titanes avec le zirconium (Zr), le hafnium (Hf) et le rutherfordium (Rf).
Les propriétés du titane sont extrêmement variées : la résistance à la corrosion, souvent associée à la résistance à l’érosion et au feu, la biocompatibilité mais aussi les excellentes propriétés mécaniques (résistance, ductilité, fatigue, etc.) qui permettent de concevoir des pièces plus fines et légères. Cet éventail attrayant de propriétés explique le développement des applications dans les domaines aéronautique, aérospatial, chimique et médical. En outre, grâce à un meilleur rendement à la production, le titane est de plus en plus utilisé dans des applications courantes telle que l’industrie du sport, de l’automobile et même de la joaillerie.
Sommaire
- 1 Histoire
- 2 Propriétés physiques
- 3 Propriétés mécaniques
- 4 Résistance au feu
- 5 Propriétés chimiques
- 6 le procédé Van-Arkel-de-Boer
- 7 Le procédé Kroll et l'obtention du titane haute pureté
- 8 Composés
- 9 Précautions, toxicologie
- 10 Occurrence et production
- 11 Enjeux économiques
- 12 Utilisations
- 13 Symbolique
- 14 Références bibliographiques utiles
- 15 Notes et références
- 16 Voir aussi
- 17 Liens externes
Histoire
Le titane a été découvert par le révérend William Gregor en 1794, minéralogiste et chimiste britannique. En analysant des sables de la rivière Helford dans la vallée de Menachan en Cornouailles, il isola ce qu'il nomma du sable noir, connu aujourd’hui sous le nom d'Ilménite. Suite à plusieurs manipulations physico-chimiques (extraction du fer par des procédés magnétiques et traitement du résidu par de l’acide chlorhydrique), il produisit un oxyde impur d'un métal inconnu. Il nomma cet oxyde menachanite. Indépendamment de cette découverte, quatre ans plus tard, Martin Heinrich Klaproth, professeur de chimie analytique à l'université de Berlin, identifia le même métal. Alors qu'il analysait les propriétés du schörlite rouge, aujourd’hui connu sous le nom de rutile, il conclut que le minerai contenait un métal inconnu identique à celui de Gregor. Il lui donna son nom actuel de « Titane », tiré de la mythologie grecque, en ignorant totalement ses propriétés physico-chimiques. Il a fallu attendre plus d'un siècle après la découverte de Gregor pour que l'américain Matthew Albert Hunter, chercheur au Rensselaer Polytechnic Institute à Troy (New-York), soit capable, en 1910, de produire du titane pur à 99 %. Les premières obtentions de titane par Hunter ne furent pas suivies du moindre développement industriel.
En 1939, le procédé industriel de production fut finalement mis au point par Wilhelm Justin Kroll, métallurgiste et chimiste luxembourgeois, consultant au Union Carbide Research Laboratory de Niagara Falls (New-York) par réduction du TiCl4 avec du magnésium.
Propriétés physiques
Propriétés physique de base
Caractéristiques physiques remarquables du titane :
- Sa masse volumique est environ 60 % de celle de l’acier.
- Sa tenue à la corrosion est exceptionnelle dans de nombreux milieux tels que l’eau de mer ou l’organisme humain.
- Ses caractéristiques mécaniques restent élevées jusqu’à une température d’environ 600 °C et restent excellentes jusqu’aux températures cryogéniques.
- Il est disponible sous des formes et des types de produits très variés : lingots, billettes, barres, fils, tubes, brames, tôles, feuillard.
- Sa valeur de susceptibilité magnétique (2,2 à 2,3×10-4) est inférieure à celle du fer (3×10-4). C'est donc un matériaux avantageux en cas de diagnostic par IRM : diminution des artefacts.
- Son coefficient de dilatation, légèrement inférieur à celui de l’acier, est moitié moins que celui de l’aluminium. On prendra pour valeur moyenne un coefficient de dilatation de 10,5×10-6 K-1.
- Son module de Young ou module d'élasticité longitudinal se situe entre 100 000 MPa et 110 000 MPa. Cette valeur assez faible comparée à l'acier inox (220 000 MPa) en fait un matériau particulièrement intéressant pour sa biocompatibilité.
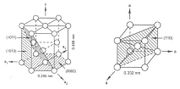
Propriétés cristallographiques
Le titane pur est le siège d’une transformation allotropique de type martensitique au voisinage de 882 °C. En-dessous de cette température, la structure est hexagonale pseudo-compacte (a=0,295nm ; c = 0,468 nm : c/a = 1,633) et est appelée Ti α (groupe d'espace 194 / P63/mmc). Au-dessus de cette température la structure est cubique centrée (a=0,332 nm) et est appelée Ti β. La température de transition α→β est appelée transus β. La température exacte de transformation est largement influencée par les éléments substitutifs et interstitiels. Elle dépend donc fortement de la pureté du métal.
Isotopes
On trouve le titane sous la forme de 5 isotopes dans la nature : 46Ti, 47Ti, 48Ti, 49Ti, 50Ti. Le 48Ti représente l'isotope majoritaire avec une abondance naturelle de 73,8%. Onze radioisotopes ont été observés, le plus stable le 44Ti possède une demi-vie de 63 ans.
L'activité photocatalytique de TiO2 est fortement affectée par sa cristallinité et dimension particulaire (Pecchi et al, 2001). La modification d'anatase est seulement suffisamment active dans la photocatalyse ayant une énergie Ebg d’espace de bande de 3,2 eV. Hombikat UV-100 TiO2 se compose de la modification pure d'anatase et ses particules ont une superficie de PARI d'environ 186 m2 g-1 (en appliquant la théorie de Brunauer-Emmett-Teller d'adsorption de gaz pour la détermination de l'isotherme d'adsorption). Cependant, la majorité d'investigations ont été effectuées en utilisant Degussa P-25 TiO2. Ce matériel se compose au sujet de l'anatase 80% et du rutile 20% et à une surface spécifique de BET à peu près 55 m2/g. Le diamètre de ses particules se trouve habituellement entre 25 nm et 35 nm.
Oxydes
- Monoxyde de titane TiO
- Dioxyde de titane TiO2
- Trioxyde de titane TiO3
- Trioxyde de dititane Ti2O3
Propriétés mécaniques
Érosion
La couche d’oxyde très adhérente et dure explique la longévité de pièces en titane soumises aux chocs de particules en suspension dans les fluides. Cet effet est amplifié par la capacité qu'a cette couche de se régénérer. L'érosion dans l’eau de mer est augmentée par un débit plus élevé ou une granulométrie plus faible.
Résistance et ductilité
Le titane est considéré comme un métal ayant une résistance mécanique importante et une bonne ductilité dans les conditions standard de température. Sa résistance spécifique (rapport résistance à la traction / densité) surclasse l’aluminium et l’acier. Sa résistance est inversement proportionnelle à la température avec un replat entre -25 °C et 400 °C. En dessous de -50 °C, dans les domaines de températures cryogéniques, l’augmentation de résistance est spectaculaire ; néanmoins, elle s’accompagne d’une ductilité très basse. Au-dessus de 400 °C, la résistance mécanique commence à diminuer. Sans qu’il n’y ait aucun fondement théorique, l’endurance en fatigue vaut environ 70% de la résistance à la traction.
Usure et grippage
Jusqu’à ce jour aucune solution satisfaisante n’a encore été mise au point. On a essayé principalement l’oxydation, la nitruration, la boruration et la carburation. On se heurte à de nombreuses difficultés technologiques de réalisation et d’adhérence. Ajoutons que les traitements de surface du titane, modifiant la nature ou la structure de la surface, ne sont à employer qu’avec la plus grande prudence et après une étude approfondie de leur influence ; ils ont généralement un effet néfaste plus ou moins prononcé sur la résistance et la fatigue.
Biocompatibilité
Le titane est l’un des métaux les plus biocompatibles, avec l’or et le platine, c’est-à-dire qu’il résiste totalement aux fluides corporels.
De plus, il possède une haute résistance mécanique et un module d’élasticité très bas (100 000 MPa à 110 000 MPa), plus proche de celui des structures osseuses (20 000 MPa[1]) que l'acier inox (220 000 MPa). Cette élasticité qui favorise remodelage osseux en l'obligeant l'os à travailler (prévention du stress shielding ou ostéoporose peri-implantaire) fait du titane un biomatériau particulièrement intéressant. Il faut cependant noter qu'une élasticité excessive peut aussi compromettre la fonction du biomateriau qui aurait subit une déformation inacceptable.
Le Centre international de recherche sur le cancer (CIRC) a classé le dioxyde de titane dans le groupe 2B « susceptible d’être cancérigène pour l’humain » : les études menées ne permettent pas de conclure[2].
Résistance au feu
Sa résistance au feu, notamment d’hydrocarbures, est très bonne. Il a été démontré qu’un tube de 2 mm d’épaisseur pouvait sans dommage ni risque de déformation ou d’explosion supporter une pression de dix atmosphères tout en étant soumis à un feu d’hydrocarbures à une température de 600 °C. Cela est dû en premier lieu à la résistance de la couche d’oxyde qui évite la pénétration de l’hydrogène dans le matériau. En outre, la faible conductivité thermique du titane protège plus longtemps les éléments internes d’une élévation de température.
Propriétés chimiques
Corrosion classique du titane
Le titane est un métal extrêmement oxydable. Dans la série des potentiels électrochimiques standards, il se place au voisinage de l’aluminium, entre le magnésium et le zinc. Il n’est donc pas un métal noble, son domaine de stabilité thermodynamique ne présente, en effet, aucune partie commune avec le domaine de stabilité thermodynamique de l’eau et est situé fortement au-dessous de ce dernier. L’une des causes de la résistance à la corrosion du titane est le développement d’une couche protectrice passivante de quelques fractions de micromètre, constituée majoritairement d’oxyde TiO2, mais il est reconnu qu’elle peut contenir d’autres variétés. Cette couche est intègre et très adhérente. En cas de rayure de la surface, l’oxyde se reforme spontanément en présence d’air ou d’eau. Il y a donc inaltérabilité du titane dans l’air, l’eau et l’eau de mer. De plus, cette couche est stable sur une large gamme de pH, de potentiel et de température.
Des conditions très réductrices, ou des environnements très oxydants, ou encore la présence d’ions fluor (agent complexant), diminuent le caractère protecteur de cette couche d’oxyde ; les réactifs d’attaque pour relever les micrographies sont le plus souvent à base d’acide fluorhydrique. Lors d’une réaction par cet acide, il y a formation de cation titane (II) et (III). La réactivité des solutions acides peut néanmoins être réduite par l’adjonction d’agents oxydants et/ou d’ions lourds métalliques. L’acide chromique ou nitrique et les sels de fer, nickel, cuivre ou chrome sont alors d’excellents agents inhibiteurs. Cela explique pourquoi le titane peut être utilisé dans des procédés industriels et des environnements où les matériaux conventionnels se corroderaient.
On peut bien entendu modifier les équilibres électrochimiques par adjonction d’éléments d’addition qui réduisent l’activité anodique du titane ; cela conduit à améliorer la tenue à la corrosion. Selon les desiderata de modifications, on ajoute des éléments spécifiques. Une liste non exhaustive de quelques adjuvants classiques est reprise ci-dessous :
- déplacement du potentiel de corrosion et renforcement du caractère de cathode : adjonction de platine, palladium ou rhodium ;
- accroissement de la stabilité thermodynamique et réduction de la propension à la dissolution anodique : adjonction de nickel, molybdène ou tungstène ;
- augmentation de la tendance à la passivation : adjonction de zirconium, tantale, chrome ou molybdène.
Ces trois méthodes peuvent être combinées.
Corrosion spécifique du titane
Le titane est très peu sensible aux modes particuliers de corrosion tels que la corrosion caverneuse ou la corrosion par piqûre. Ces phénomènes ne sont observés qu’en cas d’utilisation dans un domaine proche d’une limite pratique de tenue à la corrosion générale. Les risques de corrosion sous contrainte apparaissent dans les conditions suivantes :
- à froid dans l’eau de mer (en présence d’entailles aiguës seulement) ;
- dans certains milieux particuliers tels que le méthanol anhydre ;
- à chaud, en présence de NaCl fondu.
Les deux structures allotropiques se distinguent au niveau de la résistance à ce dernier type de corrosion ; le titane α y est fort sensible alors que le β quasiment pas.
le procédé Van-Arkel-de-Boer
Le procédé Kroll et l'obtention du titane haute pureté
Le procédé Kroll
La première étape consiste à opérer une carbochloration sur le dioxyde de titane. Le produit est obtenu par action du chlore gazeux sur l’oxyde vers 800 °C, le tout sur lit fluidisé selon la réaction :
- TiO2(s) + 2 C(s) + 2 Cl2(g) → TiCl4(g) + 2 CO(g)
Le tétrachlorure de titane, dont la température d’ébullition est de 136 °C, est récupéré par condensation, décanté, filtré et purifié par distillation fractionnée. Le procédé de réduction qui s’ensuit consiste alors à faire réagir ce tétrachlorure en phase gazeuse sur du magnésium liquide selon la réaction :
TiCl4 (g) + 2 Mg (l) → 2MgCl 2 (l) + Ti (s)
La réaction est réalisée sous vide ou sous gaz inerte (argon). Le chlorure de magnésium est séparé par décantation, puis, dans une seconde étape, par distillation sous vide vers 900 à 950 °C, ou par lavage à l’acide. Le titane obtenu est un solide poreux faisant penser à une éponge, d’où son nom d’éponge de titane.
Depuis le début de sa mise en exploitation industrielle en 1945, le procédé Kroll n’a pas subi d’évolution notable dans son principe physico-chimique, si ce n’est dans le rendement de la réaction.
Élaboration du titane haute pureté
Une fois l’éponge obtenue, on la broie afin d’obtenir des copeaux de titane. Ce lot est ensuite homogénéisé dans un mélangeur soit sous gaz neutre soit sous aspiration violente, de manière à prévenir toute inflammation des fines de titane (particules d’une centaine de micromètre) pouvant conduire à la formation d’oxynitrure de titane fragilisant et insoluble dans le bain liquide. Le lot homogène est ensuite introduit dans la matrice d’une presse où il est comprimé à froid, sous forme de cylindre dense appelé compact. La densité relative du compact autorise alors toute manutention en vue de constituer une électrode par empilement de ces compacts, étage par étage, et soudage entre eux par plasma ou faisceau d’électrons. On fabrique ainsi une électrode primaire.
Le lingot de titane pur à 99,9% peut finalement être obtenu par différentes techniques de fusion :
- la fusion sous vide par électrode consommable ou VAR (Vacuum Arc Reduction) : les électrodes de titane sont fusionnées par refusion à l’arc sous vide. Cela revient à créer un arc électrique de faible voltage et haute intensité (30 à 40 V ; 20000 à 40000 A) entre le bas de l’électrode de titane et un creuset en cuivre refroidi par eau. Le bas de l’électrode s’échauffe et sa température passe au-delà du liquidus ; les gouttelettes de métal tombent alors dans un puits liquide contenu dans une gaine de métal que l’on nomme la peau du lingot. On refond ainsi le lingot plusieurs fois selon la pureté désirée. À chaque refusion, on augmente le diamètre des lingots ; ces derniers pèsent couramment entre 1 et 10 tonnes et ont un diamètre de 0,5 à 1 mètre.
- la fusion à foyer froid par faisceau d’électron ou EB (Electron Beam)
- la fusion à foyer froid par faisceau plasma ou PAM (Plasma Arc Melting)
- la fusion par induction ou ISM (Induction Skull Melting).
Pour fabriquer un lingot de titane pur, la matière fondue peut être soit exclusivement de l’éponge, soit un mélange d’éponge et de déchet de titane (scrap), soit exclusivement du déchet de titane. Les lingots d’alliage de titane sont obtenus en mélangeant à la matière titane les éléments d’addition, comme le vanadium et l’aluminium, pour obtenir après fusion l’alliage souhaité. L’alliage le plus couramment utilisé est le TiAl6V4. En fonction des techniques de fusion utilisées et selon les besoins en termes d’homogénéité des produits obtenus, le cycle de production peu comprendre deux, voire trois fusions successives du même lingot.
Les lingots sont en général transformés par forgeage à chaud et usinage pour obtenir des demi-produits sous forme de brames, bloom ou billette. Puis on obtient des produits finis (feuilles, bobines, barres, plaques, câbles etc.) par différentes étapes de transformation de laminage, forgeage, extrusion, usinage etc. Les pièces de fonderie sont en générale réalisées directement à partir du lingot de fusion auquel est rajoutée une proportion variable de scrap.
Composés
Bien que le titane métallique soit assez rare de par son prix, le dioxyde de titane est bon marché et largement répandu comme pigment blanc pour les peintures et les plastiques. La poudre de TiO2 est chimiquement inerte, résiste à la lumière du soleil et est très opaque. Le dioxyde de titane pur possède un indice de réfraction très haut[3] (2,70 à λ = 590 nm) et une dispersion optique plus élevée que celle du diamant.
Précautions, toxicologie
Lorsqu'il est sous forme métallique divisée le titane est très inflammable, mais on considère généralement que les sels de titane sont sans danger. Les composés chlorés comme le TiCl4 et le TiCl3 sont corrosifs. Le titane peut s'accumuler dans les tissus vivants qui contiennent du silicium, mais il ne possède aucun rôle biologique connu.
Occurrence et production
On trouve du titane dans les météorites, dans le Soleil et dans les étoiles, ses raies sont bien marquées pour les étoiles de type M. Les roches ramenées depuis la Lune par la mission apollo 17 sont composées à 12,1 % de TiO2. On en trouve également dans le charbon, les plantes et même dans le corps humain.
Sur Terre, le titane n’est pas une substance rare. Il est le 10e élément le plus abondant de la croûte terrestre[réf. souhaitée], sa teneur moyenne y est de 0,63 %, Seuls les éléments suivants le précèdent par ordre décroissant : l’oxygène, le silicium, l’aluminium, le fer, le calcium, le sodium, le potassium, le magnésium, et le (9e).
La plupart des minéraux, roches et sols contiennent de petites quantités de titane. On dénombre 87 minéraux ou roches contenant au moins 1 % de titane pur. Les minerais riches en titane sont par contre très peu nombreux, à savoir, l’anatase (TiO2), la brookite(TiO2), l’ilménite (Fe(TiO3)2) et ses altérations par carence de fer : le leucoxène, la perovskite (CaTiO3), le rutile (TiO2), la sphène ou titanite (CaTiO(SiO4)) et la titanomagnétite (Fe(Ti)Fe2O4).La majorité du titane sur Terre se trouve sous forme d’anatase ou de titanomagnétite, mais ces derniers ne peuvent être exploités avec les technologies actuelles de manière rentable. Seuls l’ilménite, le leucoxène et le rutile sont intéressants économiquement, étant donné la facilité avec laquelle ils peuvent être traités.
On trouve des gisements de titane en Australie, Scandinavie, Amérique du Nord, Malaisie, la Russie, Chine, Afrique du Sud et Inde.
La réserve mondiale totale, à savoir celle qui n’est pas encore technologiquement et économiquement exploitable, est estimée à 2 milliards de tonnes. Les réserves prouvées de rutile et d’ilménite, calculées en pourcentage de TiO2 utilisable et technologiquement extractible en 2005, sont estimées à 600 millions de tonnes.
Source : U.S. Geological Survey, January 2005
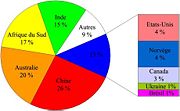
Principaux producteurs d'oxyde de titane en 2003, Chiffres de 2003, en milliers de tonnes de dioxyde de titane[4] :
Pays Milliers de tonnes % du total Australie 1291,0 30,6 Afrique du Sud 850,0 20,1 Canada 767 18,2 Norvège 382,9 9,1 Ukraine 357 8,5 Total 5 pays 3647,9 86,4 Total monde 4221,0 100,0 Enjeux économiques
Le nombre de producteurs de titane à haute pureté est très limité et est concentré dans les régions à forte demande intérieure. En effet, le titane étant un matériau stratégique pour les secteurs aéronautique, énergétique et militaire, les gouvernements des pays industrialisés ont organisé leur propre industrie de production. L’émergence récente de production en Chine et en Inde dans le cadre des plans pluriannuels de développement de l’industrie de défense, confirme cette analyse. Le fait que cette industrie soit destinée en premier lieu à satisfaire des besoins intérieurs stratégiques explique en partie le flou de l’information sur les capacités réelles de production.
Le développement de l’industrie dans le monde libéral a permis aux producteurs occidentaux d’accroître leur offre jusqu’à l’arrivée des producteurs des pays de l’ex-URSS. On peut considérer que le niveau des prix du marché, avant 1990, était principalement basé sur les coûts de production des pays occidentaux (États-Unis, Europe de l’ouest, Japon) et sur le positionnement par spécialisation de produit de ces fournisseurs aboutissant à un certain lobbying. L’arrivée sur le marché des producteurs russe, ukrainien et, à plus long terme, chinois marque de nouvelles étapes dans l’évolution du marché du titane. Ainsi, une pression sur les prix s’exerce pour gagner des parts sur le marché actuellement dominé par les États-Unis et le Japon. Cette pression se caractérise par une baisse des prix que les coûts de production rendent possible. Et, par le jeu de la concurrence, la diversification de l’offre peut contribuer à briser le positionnement par spécialisation de produit.
Utilisations
Aspects généraux
La plus grande utilisation du titane (95%) est faite sous sa forme de dioxyde de titane TiO2 (anatase), qui est un pigment important utilisé à la fois dans les peintures domestiques et les pigments des artistes, les matières plastiques, le papier, les médicaments… Il a un bon pouvoir couvrant et est assez résistant au temps. Les peintures à base de titane sont de très bons réflecteurs des infrarouges, et sont donc très utilisées par les astronomes.
Autrefois réputé cher à cause de sa valeur d’achat, le titane est de plus en plus considéré comme économique dans les coûts d’exploitation. La clé du succès pour sa rentabilité est d’utiliser au maximum ses propriétés et caractéristiques uniques dès la conception, plutôt que de les substituer ex abrupto à un autre métal. Les coûts d’installation et d’exploitation des tubes de forage en titane dans des exploitations pétrolières offshore sont entre 50 et 200 % plus bas qu’avec la référence acier. En effet, d’une part, la résistance à la corrosion évite les opérations de revêtement des tubes et permet des durées de vie trois à cinq fois supérieures à l’acier et d’autre part, la valeur élevée de sa résistance spécifique permet de réaliser des tubes fins et ultralégers. Cet exemple montre bien que le titane, initialement employé dans le domaine aéronautique touche de plus en plus de secteurs.
Industries aéronautiques et aérospatiales
Les domaines de l’aéronautique et de l’aérospatiale constituent la première des applications historiques du titane. Dans ce secteur on utilise totalement ses caractéristiques spécifiques.
De nos jours, le titane constitue 6 à 9% de la masse des avions. On en trouve tout d’abord sous forme de pièces forgées, dont la plus impressionnante est le train d’atterrissage du Boeing 777, mais aussi sous forme de boulons. Il ne faut pas oublier les éléments de moteurs, à savoir les étages basses et hautes pression à moyennes températures : disques de compresseurs, aubes de compresseurs, carters structuraux, carter Fan, aubes Fan etc. ; la température maximale d’utilisation étant limitée à 600 °C.
Dans le domaine de l’espace, il est utilisé pour les éléments du moteur Vulcain d’Ariane 5 en contact avec le mélange H2 / O2 et sa combustion ; les rouets centrifuges sont ainsi soumis à des températures cryogéniques d’un côté (température H2 liquide) et à celles de la combustion de l’autre. Il sert aussi de réservoir aux gaz de propulsion pour les satellites grâce à ses bonnes propriétés cryogéniques et à sa résistance à la corrosion des gaz propulseurs. Enfin, comme c’est un métal faiblement magnétique, il est embarqué sur les stations spatiales sous forme d'outil du fait qu’il peut évoluer en apesanteur près des appareillages électriques sans risque de créer un arc.
Industrie chimique
Le secteur de la chimie au sens large correspond à la seconde utilisation historique du titane.
On trouve des tubes en titane dans de nombreux condenseurs, où sa résistance à la corrosion et à l’abrasion permet des durées de vie élevées.
Il sert aussi sous forme de réacteurs dans les raffineries (résistance à H2S et CO2) et pour le blanchiment de la pâte à papier (résistance au Cl).
Au Japon, il est également utilisé dans les traitements des eaux en raison de sa résistance à la corrosion et aux agents biologiques.
Industrie militaire
On l’emploie comme blindage (porte-avions américains) où ses propriétés mécaniques et sa résistance à la corrosion et au feu sont mises en avant. Aux États-Unis, on a même été jusqu’à concevoir des véhicules légers, dont la carrosserie en titane possède une résistance spécifique inégalable et facilite le transport par hélicoptère.
Mais la plus spectaculaire des utilisations est bien sûr la réalisation de plusieurs sous-marins nucléaires par les russes comme la classe Alfa dont la coque entière est en titane. L'avantage du titane dans ce cas est double :
- sa grande résistance permet au sous-marin d'atteindre de plus grandes profondeurs ;
- le titane étant amagnétique, le sous-marin échappe aux détections satellitales qui utilisent les changements ponctuels du champ magnétique terrestre créés par les coques en aciers. (Cette méthode est devenue obsolète à cause de l'adjonction de circuits électroniques spécialisés qui rendent imperceptible la signature magnétique d'un sous-marin)[5].
Ainsi, le titane est considéré comme l'une des huit matières premières stratégiques indispensables en temps de guerre comme en temps de paix[6].
Le défaut majeur de ces coques est leur prix, dû au titane ainsi qu'à la difficulté de le souder.
Secteur biomédical
On dispose actuellement d’un retour d’expérience d’une petite trentaine d’années d’utilisation dans le domaine médical. Son emploi s’est développé en raison de son caractère biocompatible. En effet, l'os adhère spontanément au titane ce qui en fait un matériau privilégié pour la réalisation de prothèses. En plus de cet aspect biocompatible, le titane est mécanocompatible. Le titane a aussi fait une percée importante dans le domaine de l’odontologie où il sert d’implant dans l'os pour les supports de prothèses ainsi que pour la confection d'infrastructures prothétiques appelées chapes ou "armatures" dans le jargon du chirurgien dentiste. Le NiTi est aussi utilisé en orthodontie où ses propriétés super-élastiques en font un matériaux de choix pour la fabrication des arcs qui permettent de corriger la position des dents.
Toutefois, des études récentes mettent un bémol à la biocompatibilité du titane que l'on pensait jusque-là totale[réf. nécessaire]. Des études récentes font état d'une toxicité cellulaire du titane responsable dans certains cas d'une ostéolyse aseptique conduisant à la perte de la prothèse orthopédique. En bouche, le titane réagit au contact de la salive, en particulier quand d'autres métaux (alliages, amalgames) coexistent. En outre une part faible de la population (4%) y serait allergique.
Il faut enfin signaler l’apparition d’outillage en titane pour la chirurgie, comme les forets creux refroidis à l’eau. À l’inverse de l’acier, tout débris d’outil en titane pouvant rester dans le corps n’occasionnera pas d’infection postopératoire, du fait de sa biocompatibilité.
Enfin, le titane rentre dans la composition des bobines supraconductrices des appareils IRM en association avec un autre métal de transition : le niobium.
Industrie énergétique
Le titane est également utilisé, notamment aux États-Unis, dans les circuits secondaires de réacteurs nucléaires afin de minimiser le nombre d’arrêts de tranches qui sont extrêmement coûteux. Il faut aussi noter son utilisation dans la géothermie sous forme de canalisations et de carters et dans les échangeurs de chaleurs (tubes droits ou en U), toujours pour sa tenue à la corrosion et sa résistance à l’érosion. Enfin grâce à sa résistance spécifique élevée, on en utilise dans les turbines génératrices de vapeur sous forme d’aubes ; dans ce cas, on réduit fortement les arrêts de centrale dus aux ruptures d’aubes.
Industrie automobile
Un nouveau secteur d’application semble bien être la construction automobile. C’est surtout les marques allemandes, japonaises et américaines qui introduisent des pièces de titane dans les voitures de tourisme. Ce qui est recherchée est l’allègement des structures visant à réduire à la fois les émanations du moteur et le bruit ; on trouve ainsi des soupapes, des ressorts et des bielles en titane. Le cas des ressorts est typique d’une bonne utilisation des propriétés du titane : comme son module de Young est deux fois plus faible que celui de l’acier, il faut deux fois moins de spires ; comme il est deux fois moins dense que l’acier, le ressort est quatre fois plus léger, et il faut deux fois moins de place pour le loger dans la suspension. Si on ajoute à cela qu’il a une durée de vie quasi illimitée, même sur les routes à haut degré de salinité, on comprend l’intérêt de l’industrie automobile.
Autres utilisations
- Le tétrachlorure de titane est utilisé pour iriser le verre, et comme il fume beaucoup au contact de l'air comme écran de fumée.
- Son côté inerte et sa couleur agréable en font un métal courant pour les bijoux de piercing ; la coloration du titane par anodisation est actuellement largement utilisée en bijouterie artisanale[7] ;
- Il est parfois utilisé comme catalyseur.
- Il est utilisé en architecture comme matériau de recouvrement. Ses propriétés à la corrosion mais surtout sa faculté, par anodisation thermique, à se couvrir d’une couche d’oxyde extrêmement résistante, pouvant prendre toutes les couleurs de l’arc-en-ciel, en font un matériau de choix (exemple du musée Guggenheim à Bilbao).
- Il a servi pour la coque des PowerBook G4 Titanium d' Apple Inc..
- Il est utilisé pour fabriquer des cadres de bicyclettes haut de gamme.
Symbolique
Le titane est le 11e niveau dans la progression de la Sarbacane sportive.
Références bibliographiques utiles
Encyclopédies généralistes
(*) SERAPHIN (L.), Titane, in Encyclopaedia Universalis, Corpus 22, 4e édition, Paris (France) : Encylopaedia Universalis, 1995, p. 695-697.
(*) An, Titane, in AUGER (P.) (dir.), GRMEK (M.D.) (dir.), Encyclopédie Internationale des Sciences et des Techniques, tome 10, Paris (France) : Presses de la cité, 1973, p. 511-515.
Ouvrages spécialisés
(*) Belov (A.F.) (dir.), Williams (J.C.) (dir.), Titanium and Titanium Alloys –Scientific and Technological Aspect, 3 volumes, New-York (United States) : Plenum Press Publishing Corporation, 1982, 2457 p.
(*) Brunette, Tengvall, Textor, Thomsen, "Titanium in Medicine", Berlin (Deutschland), Springer, 2001, 1019p.
(*) Leyens (C.) & Peters (M.), Titanium and Titanium Alloys, Chichester (England) : John Wiley & Son Inc., 2002, 599 p.
(*) Lütjering (G.) & Williams (J.C.), Titanium, Berlin (Deutschland) : Springer, 2003, 687 p.
Articles et études
(*) Cariola (M.), A high potential sector : titanium metal. Oligopolistic policies and technological contraints as main limits to its development, in Resources Policy, [en ligne], volume 25, 2000, p.151-159, disponible sur http://www.sciencedirect.com.
(*) Gerdemann (S.J.), Titanium Process Technologies, in Advanced Materials & Processes ; volume. 159 ; isue 7, Material Park, Ohio (United States) : American Society for Metals, july 2001, p 41-43.
Notes et références
- ↑ Cours sur les propriétés mécaniques de l'os
- ↑ http://monographs.iarc.fr/ENG/Meetings/93-titaniumdioxide.pdf International Agency for Research on Cancer : Titanium dioxide (IARC Group 2B), Summary of reported data, Feb. 2006]
- ↑ Description de l'oxyde de titane sur SFC.fr
- ↑ L'état du monde 2005, annuaire économique géopolique mondial
- ↑ Enjeux de la composante sous-marine par l'amiral Thierry d'Arbonneau, ancien commandant des Forces océaniques stratégiques
- ↑ Avec le germanium (électronique avancée) ; magnésium (explosifs) ; platine (contacts aussi conducteurs que l'or pour l'aviation, circuits avec contacts rapides) ; mercure (chimie nucléaire, instruments de mesure) ; molybdène (acier) ; cobalt (chimie nucléaire) ; colombium (alliages spéciaux extrêmement rares). (Christine Ockrent, comte de Marenches, Dans le secret des princes, éd. Stock, 1986, p; 193.)
- ↑ Exemple de coloration du titane par anodisation
Voir aussi
Liens externes
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Métal de transition
Wikimedia Foundation. 2010.