- Potentiel d'oxydo-reduction
-
Potentiel d'oxydo-réduction
Le potentiel d'oxydo-réduction, ou potentiel redox, est une grandeur empirique exprimée en volt (de symbole V) et notée E. En général, ce potentiel est exprimé par rapport à une référence, très souvent celui mesuré par des électrodes d'hydrogènes (ENH) ,d'où on voit dans certains ouvrages l'unité V/ENH. Cette mesure est appliquée aux couples d'oxydo-réduction pour prévoir la réactivité des espèces chimiques entre elles. Par convention, le potentiel standard E° est mesuré par rapport au couple eau/hydrogène (H+/ H2), de potentiel nul.
Sommaire
Mesure
La mesure d'un potentiel d'électro-réduction se fait expérimentalement à l'aide de deux demi-piles. Pour obtenir le potentiel standard d'un couple redox, l'une de ces piles doit mettre en œuvre le couple de référence H+/ H2, et l'autre celui dont on veut mesurer le potentiel.
Concrètement, les deux demi-piles sont constituées chacune d'un soluté et d'une électrode, les solutés sont reliés entre eux par un pont salin qui leur permet d'échanger des ions (donc des charges électriques négatives), et les électrodes sont reliées entre elles par un circuit électrique sur lequel est placé un voltmètre. Les deux demi-piles, une fois reliées, forment une pile électrique fournissant un courant continu, alimenté par les réactions chimiques qui ont lieu spontanément aux électrodes dés lors qu'est formée la pile. Le sens du courant indique le couple de plus fort potentiel et la mesure de la force électromotrice (exprimée en volt) correspond au potentiel d'oxydo-réduction.
Ce potentiel peut dépendre du contexte chimique et notamment du pH, et même du contexte physique : les effets de la lumière sont mis à profit aussi bien par la nature dans la photosynthèse, que par l'homme dans la photographie.
Les chimistes utilisent des tables déjà définies, elles fournissent les potentiels mesurés dans les conditions standards de pression et de température (25 °C, 1 bar) par rapport au couple H+/ H2.
Oxydant et réducteur
La référence du potentiel d'oxydo-réduction est celui de l'eau pure, conventionnellement fixé à zéro. Les corps dits « oxydants » sont les oxydants des couples ayant un potentiel négatif (ils absorbent des électrons, ce qui se traduit par une charge électrique négative) ; les corps dits « réducteurs » sont les réducteurs des couples ayant un potentiel positif (ils cèdent des électrons, d'où potentiel positif). Les valeurs caractéristiques des potentiels sont de l'ordre de quelques volts.
On voit là que l'on a deux significations différentes pour les termes « oxydant » et « réducteur » :
- la signification liée à une réaction d'oxydo-réduction donnée (accepteur ou donneur d'électron dans la réaction) ;
- la signification liée au potentiel d'oxydo-réduction : un « réducteur » est un corps qui joue le rôle de réducteur dans de nombreuses réactions, un « oxydant » est un corps qui joue le rôle d'oxydant dans de nombreuses réactions, mais un « oxydant » peut parfois être un réducteur s'il est face à un « oxydant » plus fort et qu'il peut encore s'oxyder.
C'est cette deuxième signification qui est utilisée ici. Les « oxydants » les plus forts ne peuvent eux-mêmes pas s'oxyder et sont donc toujours des oxydants, les « réducteurs » les plus forts ne peuvent eux-mêmes pas se réduire et sont donc toujours des réducteurs. Mais certains corps peuvent être alternativement oxydants et réducteurs, comme par exemple l'eau ou le monoxyde de carbone.
Les oxydants les plus forts dans cette échelle sont les halogènes (F2, Cl2...), l'ion permanganate (MnO4-) en milieu acide, l'ion hypochlorite (ClO-), le dioxygène (O2), le soufre (S).
Des réducteurs classiques sont les métaux, le carbone et l'hydrogène solide[1].
Potentiels standards d'oxydo-réduction à 25 °C
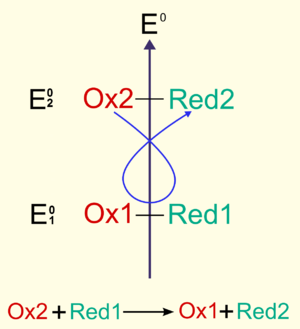
Considérons deux couples Ox1/Red1 et Ox2/Red2, de potentiel respectif E10 et E20, tels que
- E10 < E20.
En utilisant la règle dite du gamma, il est possible de prévoir le sens d'une réaction. En plaçant les couples sur une échelle par potentiel décroissant, l'oxydant le plus fort (ici Ox2) réagira avec le réducteur le plus fort (placé en dessous sur la figure, ici Red1) pour donner Red2 et Ox1 :
- Ox2 + Red1 → Red2 + Ox1.
Par exemple, l'oxydation du fer (Fe) par le dioxygène de l'air pour former de l'hématite (Fe2O3)
- 4Fe + 3O2 → 2Fe2O3 (oxydo-réduction)
peut s'écrire
- 4Fe <=> 4Fe3+ + 12e- (oxydation)
- 3O2 + 12e- <=> 6O2- (réduction)
Les deux couples sont Fe3+/Fe et O2/O2- ; le potentiel de O2/O2- est supérieur à celui de Fe3+/Fe.
Une réaction possible peut ne pas avoir lieu, ou seulement très lentement, pour des raisons cinétiques. Par exemple, l'oxydation du fer par le dioxygène de l'air (formation de la rouille) est une réaction lente.
Exemples de potentiels standard Oxydant E0 (V) Réducteur F2 +2,87 F- S2 +2,10 SO42- Cu2+ +0,337 Cu CH3CHO +0,19 CH3CH2OH SO42- +0,17 SO2 S4O62- +0,09 S2O32- H3O+ 0,00 H2 (g) CH3CO2H -0,12 CH3CHO Pb2+ -0,13 Pb Sn2+ -0,14 Sn Ni2+ -0,257 Ni Cd2+ -0,40 Cd Fe2+ -0,440 Fe Cr3+ -0,740 Cr « Noblesse » d'un métal
Un métal qui ne s'oxyde pas spontanément à l'air est dit « noble ». Cette notion est directement liée au potentiel d'oxydoréduction du couple oxyde/métal : plus le potentiel est élevé, plus le métal est « noble ». Ceci intervient également dans la corrosion galvanique : le métal le moins noble se corrode alors que le métal le plus noble est protégé. Certains métaux considérés comme inoxydables sont en fait protégés par une couche d'oxyde compacte et adhérente, comme par exemple l'aluminium et le titane : ils ne sont pas nobles, mais leur corrosion est très lente.
On peut donc classer les métaux du plus noble au moins noble :
- Au > Ag > Pb > Sn > Ni > Cd > Fe > Cr > Zn > Al > Ti > Mg > Na > Li
Notes et références
- ↑ L'hydrogène n'existe qu'à l'état gazeux sur Terre (sous forme de dihydrogène, H2). Cependant, dans des conditions de forte pression et de faible température, il peut cristalliser (solidification) et a alors des propriétés métalliques.
Articles connexes
- Portail de la chimie
Catégories : Chimie générale | Électrochimie | Propriété chimique
Wikimedia Foundation. 2010.