- E949
-
Hydrogène
L'hydrogène est un élément chimique de symbole H et de numéro atomique 1.
Dans le langage courant, on appelle « hydrogène » le gaz de formule chimique H2 qui se nomme en toute rigueur dihydrogène. Pour les propriétés relatives à ce gaz (propriétés chimiques, production industrielle, stockage…) voir l'article dihydrogène.
L'hydrogène est le principal constituant du Soleil et de la plupart des étoiles, dont l'énergie provient de réactions de fusion thermonucléaire de l'hydrogène.
Le nom hydrogène vient du grec ὕδωρ (hudôr), « eau » et γεννᾰν (gennen), « engendrer ». Ce nom lui a été donné par Lavoisier qui rebaptise ainsi l'« air inflammable » mis en évidence par Cavendish en 1766.
Sommaire
L'atome d'hydrogène
L'hydrogène est l'élément chimique le plus simple ; son isotope le plus commun est constitué seulement d'un proton et d'un électron. L'hydrogène est ainsi le plus léger atome existant. Comme il ne possède qu'un électron, il ne peut former qu'une liaison covalente : c'est un atome univalent.
Cependant, l'hydrogène solide peut être métallique lorsqu'il est sous très haute pression. Il cristallise alors avec une liaison métallique (voir hydrogène métallique). Dans le tableau périodique des éléments, il est d'ailleurs dans la colonne des métaux alcalins. N'étant pas présent dans cet état sur Terre, il n'est toutefois pas considéré comme un métal en chimie.
Abondance
L'hydrogène est l'élément le plus abondant de l'Univers : 75 % en masse et 92 % en nombre d'atomes. Il est présent en grande quantité dans les étoiles et les planètes gazeuses.
Dans la croûte terrestre, l'hydrogène ne représente que 0,22 % des atomes, loin derrière l'oxygène (47 %) et le silicium (27 %)[2]. Il est rare également dans l'atmosphère terrestre, puisque le dihydrogène ne représente en volume que 0,55 ppm des gaz atmosphériques. Sur Terre, la source la plus commune d'hydrogène est l'eau dont la molécule est constituée de deux atomes d'hydrogène et d'un atome d'oxygène ; l'hydrogène est surtout le principal constituant (en nombre d'atomes) de toute matière vivante, puisqu'il est présent, associé au carbone dans tous les composés organiques. par exemple, l'hydrogène représente 63 % des atomes du corps humain[2].
Sous des très faibles pressions, comme celles qui existent dans l'espace, l'hydrogène a tendance à exister sous forme d'atomes individuels, simplement parce qu'il est alors improbable qu'ils entrent en collision pour se combiner. Les nuages de dihydrogène sont à la base du processus de la formation des étoiles.
Fusion nucléaire de l'hydrogène
L'hydrogène présent en grandes quantités dans le cœur des étoiles est une source d'énergie via les réactions de fusion nucléaire qui combinent quatre atomes d'hydrogène pour former un atome d'hélium. Les deux voies de cette fusion nucléaire naturelle sont le cycle carbone-azote-oxygène catalytique de Bethe et von Weizsäcker et la chaîne proton-proton.
La fusion nucléaire de l'hydrogène est aussi la source d'énergie principale dans les bombes à hydrogène ou bombes H.
L'hydrogène solide
L'hydrogène solide est l'état solide de l'hydrogène, obtenu en diminuant la température en dessous du point de fusion de l'hydrogène, situé à 14,01 K (-259,14 °C). L'état solide fut obtenu pour la première fois en 1899 par James Dewar. Ce dernier publia ses travaux sous le titre "Sur la solidification de l'hydrogène" dans les Annales de chimie et de physique, 7e série, volume 18, Octobre 1899.[3] [4]
Recherche
- 1972 - The experimental determination of the melting characteristics of solid hydrogen [5]
L'hydrogène métallique
L'hydrogène métallique est une phase de l'hydrogène qui survient lorsqu'il est soumis à une très forte pression et à de très basses températures. C'est un exemple de matière dégénérée. D'aucuns estiment qu'il y a un intervalle de pressions (autour de 400 GPa) tel que l'hydrogène métallique est liquide, même à de très basses températures[6]' [7].
Composés chimiques de l'hydrogène
Les composés covalents
L'atome d'hydrogène peut engager son unique électron pour former une liaison covalente avec de nombreux atomes non-métalliques.
Les composés les plus connus sont :
- la molécule de dihydrogène H2 ;
- la molécule d'eau H2O ;
- les molécyles d'hydrocarbures CxHy.
L'hydrogène est également présent dans toutes les molécules organiques, où il est lié principalement à des atomes de carbone, d'oxygène et d'azote.
L'ion hydrogène H+ ou proton
L'atome d'hydrogène peut perdre son unique électron pour donner l'ion hydrogène H+.
On le désigne alors couramment par le nom de proton, étant donné qu'en perdant son électron l'atome est réduit à son noyau, et que dans le cas de l'isotope le plus abondant 1H ce noyau n'est constitué que d'un proton. Cette appellation n'est pas rigoureusement correcte si l'on tient compte de la présence, certes discrète (inférieure à 0,02 %), des autres isotopes…
Son rayon est très petit : environ 1,5×10−15 m contre 5×10−11 m pour l'atome.
Il n'existe pas à l'état libre mais est toujours lié au nuage électronique d'une molécule. En solution aqueuse (telle H2O) il est solvaté par des molécules d'eau ; on peut en simplifiant considérer qu'il est capté par une molécule d'eau, formant un ion oxonium H3O+.
Les hydrures
L'hydrogène se combine avec la plupart des autres éléments car il possède une électronégativité moyenne (2,2) et peut ainsi former des composés avec des éléments métalliques ou non-métalliques. Les composés qu'il forme avec les métaux sont appelés hydrures dans lesquels il se trouve sous forme d'ions H− qui parfois n'existent qu'en solution. Dans les composés avec les non-métalliques, l'hydrogène forme des liaisons covalentes, car l'ion H+, qui n'est rien d'autre qu'un simple proton, a une trop forte tendance à s'associer avec les électrons. Dans les acides en solution aqueuse, il se forme des ions H3O+, association du proton et d'une molécule d'eau.
Les réactions acido-basiques
L'hydrogène joue un rôle primordial dans une réaction acido-basique (au sens de la théorie de Bronsted-Lowry) puisque cette dernière correspond formellement à l'échange d'un ion hydrogène H+ entre deux espèces, la première (l'acide) libérant H+ par rupture d'une liaison covalente, et la deuxième (la base) captant cet H+ par formation d'une nouvelle liaison covalente :
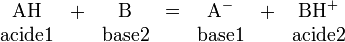
La liaison hydrogène
La liaison hydrogène est une interaction électrostatique entre l'hydrogène lié chimiquement à un atome électronégatif A et un autre atome électronégatif B (A et B étant typiquement O, N ou F en chimie organique).
Cette liaison joue un rôle important en chimie organique, puisque les atomes d'oxygène O, d'azote N ou de fluor F sont susceptibles de créer des liaisons hydrogène, mais aussi en chimie inorganique, entre les alcools et les alkoxydes métalliques.
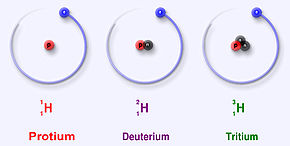
Isotopes
L’hydrogène est le seul élément dont chaque isotope porte un nom spécifique, car leur différence de masse relativement à l'hydrogène est significative : du simple au double ou au triple, ce qui explique que, contrairement à ce qui vaut pour les isotopes en général, ces différences peuvent influencer les propriétés chimiques du deutérium ou du tritium par rapport au protium (effet isotopique). L'eau lourde (D2O) est par exemple toxique (à forte dose) pour de nombreuses espèces : en raison de la grande différence de masse entre les isotopes la cinétique des réactions en solution aqueuse « lourde » est considérablement ralentie…
Les isotopes connus de l'hydrogène sont :
- l’hydrogène léger ou protium (1H)) ; c'est le plus abondant (~99,98 %). Simplement constitué d'un proton et ne possèdant donc pas de neutron, c'est un isotope stable.
- le deutérium (2H ou D) ; beaucoup moins abondant (~0,015 % en moyenne ; de 0,0184 à 0,0082 % de l'hydrogène naturel), il possède un proton et un neutron et c'est un isotope stable. Présent principalement sous forme de deutérure d'hydrogène.
- le tritium (3H ou T) ; Constitué d’un proton et de deux neutrons, il n'est présent qu'en infime quantité (un atome de tritium pour 1018 atomes d’hydrogène). Instable, c'est le seul isotope radioactif de l’hydrogène, dont il possède semble-t-il les mêmes propriétés chimiques et physiques si ce n'est qu'il se transforme en 3He par émission d'un électron (radioactivité β−). 2H et 3H peuvent participer à des réactions de fusion nucléaire…
Sa radiotoxicité est réputée très faible lorsqu'il est présent sous forme HTO (eau tritiée), elle est moins connue et à ce jour moins bien comprise lorsqu'elle est émise par une forme organique (les études présentent des résultats contradictoires ou très variables selon leurs protocoles expérimentaux)[8]. Dans l’environnement, le tritium peut prendre la place de l’hydrogène dans toutes les molécules où il est présent, y compris dans les molécules « biologiques » et jusque dans l'ADN où il peut être cause de cassure de l'ADN, de mutations ou d'apoptoses cellulaires. Le tritium est un élément rare ce qui explique une concentration de l'eau ou des tissus généralement très faible (hors contaminations accidentelles liées à une source anthropique de tritium). - le quaternium ou le tétradium (4H ou Q) est l'isotope le plus instable de l'hydrogène à émission de neutron.[9] Sa demi-vie est très courte : 1,39 × 10−22 secondes[10]
- l'hydrogène 7, l'isotope le plus riche en neutrons jamais observé. Sa demi-vie est de l'ordre de 10−21 secondes.[11].
Mécanique quantique
L'atome d'hydrogène est l'atome le plus simple qui existe. C'est donc celui pour lequel la résolution de l'équation de Schrödinger, en mécanique quantique, est la plus simple. L'étude de ce cas est fondamental, puisqu'il a permis d'expliquer les différentes liaisons chimiques, avec la théorie des orbitales moléculaires et la théorie VSEPR.
Voir aussi
Articles connexes
Notes et références
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Solid hydrogen ».
- ↑ a et b (fr) Paul Arnaud, Brigitte Jamart, Jacques Bodiguel, Nicolas Brosse, Chimie Organique 1er cycle/Licence, PCEM, Pharmacie , Cours, QCM et applications, Dunod, 8 juillet 2004, Broché, 710 p. (ISBN 2100070355)
- ↑ a et b p.6 Reginald H. Garrett, Charles M. Grisham, B. Lubochinsky, Biochimie, De Boeck Université, 2000, 1292 p. (ISBN 2744500208)
- ↑ Correspondence and General A-I DEWAR/Box D I
- ↑ James Dewar, « Sur la solidification de l'hydrogène », dans Annales de Chimie et de Physique, vol. 18, 1899, p. 145–150 [texte intégral]
- ↑ 1972 - Melting Characteristics and Bulk Thermophysical Properties of Solid Hydrogen
- ↑ Ashcroft N.W., (en)The hydrogen liquids. J.Phys. A 12, A129-137 (2000).
- ↑ Bonev, S.A., Schwegler, E., Ogitsu, T., and Galli, G., (en)A quantum fluid of metallic hydrogen suggested by first principles calculations. Nature 431, 669 (2004).
- ↑ Fiche radiotoxicologique « tritium » du CEA, version 12-2005, rédigée par Annabelle Comte
- ↑ Hydrogen-4 and Hydrogen-5 from t+t and t+d transfer reactions studied with a 57.5-MeV triton beam, G. M. Ter-Akopian et al., Nuclear Physics in the 21st Century: International Nuclear Physics Conference INPC 2001, American Institute of Physics Conference Proceedings 610, pp. 920-924, DOI:10.1063/1.1470062.
- ↑ p. 27, The NUBASE evaluation of nuclear and decay properties, G. Audi, O. Bersillon, J. Blachot, and A. H. Wapstra, Nuclear Physics A 729 (2003), pp. 3 ;128.
- ↑ [pdf] Communiqué de presse Découverte de l'hydrogène 7, le système nucléaire le plus exotique jamais observé. – 19 novembre 2007
Liens externes
- (fr) www.periodictableonline.org H
- (en) Images de l'hydrogène et des ses isotopes sous différentes formes
- (en) 2001 - Properties of solid hydrogen at very low temperatures.
- (en) Solid hydrogen experiments for atomic propellants
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégorie : Hydrogène
Wikimedia Foundation. 2010.