- Sedergine
-
Acide acétylsalicylique
Acide acétylsalicylique 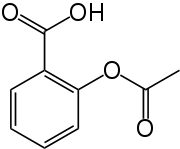
Molécule d'aspirine Général Nom IUPAC acide 2-acétyloxybenzoïque Synonymes Aspirine No CAS No EINECS Code ATC A01, , N02 DrugBank PubChem SMILES InChI Apparence cristaux incolores à blancs ou poudre cristalline blanche, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C9H8O4 [Isomères] Masse molaire 180,1574 g∙mol-1
C 60 %, H 4,48 %, O 35,52 %,pKa 3,5 Propriétés physiques T° fusion 135 °C[1] T° ébullition Se décompose au-dessous du point d'ébullition à 140 °C[1] Solubilité dans l'eau : faible (0.25 g/100 ml à 15 °C)[1] Masse volumique 1.4 g/cm³[1] Point d’éclair 131,2 °C Pression de vapeur saturante 0,0165 Pa à 25 °C Propriétés optiques Indice de réfraction 1,55 Précautions Directive 67/548/EEC 
XnPhrases R : 22, 36/37/38, Phrases S : 26, SIMDUT[2] 
Écotoxicologie LogP 1.19[1] Classe thérapeutique Antalgique • Antipyrétique • Anti-inflammatoire • Antiagrégant plaquettaire Données pharmacocinétiques Biodisponibilité 60 - 90 % selon la dose[3] Liaison protéique 99,6 % Métabolisme Hépatique Demi-vie d’élim. 3,1 h (dose < 650 mg)
5 h (dose = 1 g)
9 h (dose = 2 g)Excrétion Urinaire Considérations thérapeutiques Voie d’administration Orale, IV Grossesse Contre-indiquée
au 3e trimestrePrécautions Toxicité gastrique Composés apparentés Isomère(s) Acide caféique Autres composés Salicylate de méthyle Unités du SI & CNTP, sauf indication contraire. L'acide acétylsalicylique, plus connu sous le nom d'aspirine, est la substance active de nombreux médicaments aux propriétés analgésiques, antipyrétiques et anti-inflammatoires. Il est aussi utilisé comme antiagrégant plaquettaire.
C'est le médicament le plus consommé au monde : 35 000 tonnes sont produites chaque année, soit 100 milliards de comprimés. Elle est aussi intégrée à de nombreuses autres préparations. En France par exemple, plus de 230 médicaments commercialisés contiennent de l'aspirine.
Sommaire
Étymologie
L'acide acétylsalicylique est obtenu par acétylation de l'acide salicylique. Le nom de cet acide vient du latin salix qui signifie saule, cet acide ayant été isolé pour la première fois dans l'écorce de cet arbre.
L'appellation aspirine vient du nom de marque Aspirin®, déposé en 1899 par la société Bayer. Ce nom a été formé de a- (qui renvoie à l'acétylation), et "-spirine" (qui renvoie à l'acide spirique). L'acide spirique était extrait de la Spiraea ulmaria, dénomination latine donnée à cette époque à la reine-des-prés, et on a rapidement constaté que l'acide spirique et l'acide salicylique étaient une seule et même substance.
Histoire
 Saule blanc (Salix alba)
Saule blanc (Salix alba)
L'écorce de saule est connue depuis l'Antiquité pour ses vertus curatives. On a retrouvé la trace de décoction de feuilles de saule dans un papyrus égyptien datant de 1550 av. J.-C. Hippocrate (460–377 av. J.-C.), médecin grec, conseillait déjà une préparation à partir de l'écorce du saule blanc pour soulager les douleurs et les fièvres. Les Romains connaissaient aussi ses propriétés, le nom latin du saule est salix.
En 1763, Edward Stone présente un mémoire devant la Royal Medicine Society sur l'utilisation thérapeutique de l'écorce du saule blanc contre la fièvre. En 1829, Pierre-Joseph Leroux, un pharmacien français, après avoir fait bouillir de la poudre d'écorce de saule blanc dans de l'eau, tente de concentrer sa préparation ; il en résulte des cristaux solubles qu'il baptise saliciline (de salix).
Puis des scientifiques allemands purifient cette substance active, d'abord appelée salicyline, puis acide salicylique.
 Reine-des-prés (Filipendula ulmaria)
Reine-des-prés (Filipendula ulmaria)
En 1835, Karl Löwig montre que l'acide spirique, extrait de la reine-des-prés, est chimiquement identique à l'acide salicylique.
On utilise cette préparation pour faire tomber la fièvre, soulager les douleurs et les rhumatismes articulaires, mais elle provoque des brûlures d'estomac.
En 1853, le chimiste strasbourgeois Charles Frédéric Gerhardt expérimente la synthèse de l'acide acétylsalicylique et dépose un brevet. Il meurt trois ans plus tard et ses travaux tombent dans l'oubli.
En 1859, Kolbe réussit la synthèse chimique de l'acide salicylique, mais c'est Felix Hoffmann, chimiste allemand entré au service des laboratoires Bayer en 1894, qui, en octobre 1897, reprenant les travaux antérieurs de Charles Frédéric Gerhardt, trouve le moyen d'obtenir de l'acide acétylsalicylique pur et réalise sa production industrielle. Il s'en sert d'abord pour soigner son père, qui souffrait de rhumatisme chronique. D'après des recherches de Walter Sneader de l'université de Strathclyde à Glasgow, c'était cependant le supérieur de Hoffmann, Arthur Eichengrün, qui eut l'idée de synthétiser l'acide salicylique.
Finalement, le brevet et la marque de l'aspirine sont déposés par la société Bayer en 1899, sous la dénomination « Aspirin ». La préparation arrive en France en 1908 et est commercialisée par la Société chimique des usines du Rhône. Cependant, après la Première Guerre mondiale, le Traité de Versailles stipule que la marque et le procédé de fabrication tombent dans le domaine public dans un certain nombre de pays (France, États-Unis… mais ils perdurent dans d'autres pays comme le Canada).
Propriétés pharmacologiques
L'aspirine possède les propriétés pharmacologiques suivantes
- Analgésique (diminution de la douleur)
- Antipyrétique (diminution de la fièvre)
- Anti-inflammatoire
- Antiagrégant plaquettaire (empêche la coagulation du sang)
Mécanisme d'action
En 1971, John R. Vane, lors de recherches qui lui valurent le prix Nobel de médecine en 1982, découvrit que l'aspirine inhibe la production de prostaglandines et de thromboxanes. L'aspirine par une réaction chimique d'acétylation inhibe de façon irréversible les enzymes cyclo-oxygénase ( COX 1 ET COX 2 ), des enzymes participant à la production de prostaglandines et de thromboxanes. L'aspirine est différente des autres anti-inflammatoires non stéroïdiens (AINS) qui inhibent de façon réversible cette enzyme.
L'aspirine fait baisser la fièvre (antipyrétique), en réduisant la production de prostaglandines dans l'hypothalamus, thermostat de la température corporelle.
Elle réduit la douleur (analgésique) en bloquant la production des hormones responsables des messages transmis aux récepteurs de la douleur dans le cerveau, d'où son efficacité sur les migraines et les douleurs d'origines diverses. Par le même mode d'action, elle réduit les inflammations (AINS) résultant d'une dilatation vasculaire, comme les coups de chaleur, qui ne s'accompagnent pas forcément de coups de soleil.
L'aspirine agit sur les plaquettes sanguines, en inhibant la cyclo-oxygénase, une enzyme ayant un rôle important dans l'agrégation des plaquettes, et ce, de manière permanente, c'est-à-dire durant toute la durée de vie de la plaquette (entre 7 et 15 jours). Il favorise par ce biais la circulation et peut servir pour prévenir les attaques cardiaques, en évitant la formation de caillots (thrombose).
Pharmacocinétique
L'aspirine est absorbée au niveau de l'estomac et du duodénum. Le taux d'absorption dépend de la dose : de 60 % pour moins de 500 mg à 90 % pour 1 g ou plus par saturation de l’hydrolyse hépatique[3]. La prise de certains aliments épicés semble réduire le taux d'absorption[4].
Pour les formes pharmaceutiques immédiates, le pic de concentration est atteint de 25 à 60 minutes après la prise[3]. Il peut être atteint plusieurs heures après pour une forme gastro-résistante ou à libération modifiée.
Sa demi-vie dans le sang n'est que de 15 à 20 minutes et de 2 à 4 h pour l'acide salicylique qui est un métabolite actif obtenu par hydrolyse[3].
Indications thérapeutiques et préventions
Douleur, fièvre et inflammation
L'aspirine est utilisée depuis plus de cent ans pour soulager la douleur, faire baisser la fièvre et le traitement de l'inflammation.
Maladies cardio-vasculaires
À petite dose (entre 75 et 300 mg/jour suivant les études), les propriétés antiagrégantes de l'aspirine préviennent efficacement la formation de caillots de sang dans les vaisseaux sans causer de dommages significatifs à l'organisme. Le bénéfice de cette prise a été prouvé en prévention secondaire[5], c'est-à-dire, après un premier accident vasculaire et elle est largement préconisée dans ce cas. Le bénéfice excède significativement le risque majoré d'hémorragie dans ce cas. Son efficacité dans la prévention des accidents lors d'une artérite des membres inférieurs n'est cependant pas prouvée[6].
Son utilisation en prévention primaire (c'est-à-dire, avant même l'apparition d'une maladie vasculaire) reste plus discutée : l'efficacité semble être partielle (diminution des infarctus du myocarde mais tendance à l'augmentation des accidents vasculaires cérébraux de type hémorragique) et n'a été testée que sur des populations bien ciblées (médecins)[7] ou femmes de plus de 45 ans avec une diminution modérée des accidents vasculaires cérébraux mais un effet sur la mortalité et la morbidité cardio-vasculaire non significatif[8]. Des différences d'efficacité chez l'homme et la femme ont aussi été constatées. Les résultats sont plus mitigés pour d'autres études, bien qu'elles soient faites chez des personnes dites « à hauts risques »[9].
Malgré l'absence de preuves solides, les recommandations médicales préconisent l'emploi de l'aspirine en prévention primaire chez les patients dits « à hauts risques »[10].
Réduction du risque de cancer
Des études sur les effets à long terme de petites doses d'aspirine en chimioprévention montreraient qu'elle aurait un effet contre certains types de cancers, comme ceux du colon, sein, prostate, bouche, gorge, œsophage, estomac, poumon (non à petites cellules).
Une vingtaine d'études de cancérogenèse chez rats et souris étayent cet effet protecteur[11]. Plusieurs essais cliniques montrent que de petites doses d'aspirine diminuent, modestement, la récurrence des polypes intestinaux et la survenue des cancers du côlon[12], essentiellement si ces derniers expriment l'enzyme cyclo-oxygénase de type 2 (soit, environ les 2/3 des dits cancers)[13]. Cependant les doses indiquées sont susceptibles de provoquer des saignements gastriques ou intestinaux et l'utilisation de l'aspirine n'est actuellement pas recommandée pour la prévention des cancers[14].
Fécondation
Selon une étude réalisée en 2004 à l'hôpital de Falun en Suède, la prise d'aspirine à 75 mg/jour augmenterait l'efficacité de la fécondation in vitro en améliorant la vascularisation de l'utérus.
Contre-indications et précautions
Ses effets secondaires sont des troubles gastriques (exemple : gastrite voire hémorragie digestive en cas de dose élevée).
L'aspirine doit être utilisée avec prudence chez le nourrisson et l'enfant, car en cas de surdosage (au-dessus de 50 mg par kg et par jour), elle est neurotoxique. En outre, elle peut entraîner l'apparition du syndrome de Reye en cas de varicelle ou de grippe.
Les cardiaques, sous traitement au long cours à petites doses en raison de son effet antiagrégant, peuvent être exposés à ses effets secondaires. Le bénéfice du traitement reste cependant de loin supérieur au risque, ce qui justifie sa prescription.
Chez les personnes souffrant d'un ulcère gastrique, l'aspirine peut occasionner une hémorragie digestive.
Lors d'une grossesse, elle peut être prise à titre ponctuel pendant les deux premiers trimestres, ensuite l'utilisation d'aspirine est contre-indiquée au troisième trimestre : sur le fœtus à partir du sixième mois, ce type de médicament exerce des effets vasoconstricteurs au niveau des reins et peut conduire à une insuffisance rénale ou encore à des troubles de l'appareil cardio-pulmonaire.
Ce médicament est également contre-indiqué au cours de l'allaitement (la substance passe dans le lait).
En cas de risque de dengue, l'utilisation de médicaments à base d'aspirine, est fortement désapprouvée vu le risque d'apparition de la forme hémorragique de la maladie. Cet avis doit accompagner, au Brésil, toute publicité du produit.
De manière générale, l'aspirine fluidifie le sang car elle inhibe l'agrégation plaquettaire. Par conséquent, le risque d'hémorragie est à prendre en compte, surtout s'il y a déjà prescription d'anticoagulants.
Propriétés chimiques
L'acide acétylsalicylique est la dénomination commune internationale de l'acide 2-(acétyloxy)benzoïque (selon les normes IUPAC).
Au cours des années, il fut aussi appelé acide 2-acétyloxybenzoïque, acide 2-acétoxybenzoïque, acétylsalicylate, acide ortho-acétylsalicylique, acide ortho-acétyloxybenzoïque ou encore acétosal.
Les pharmacopées européenne (Ph. Eur.), américaine (USP) et japonaise décrivent des méthodes d'identification et d'analyses de l'acide acétylsalicylique destiné aux médicaments.
Synthèse
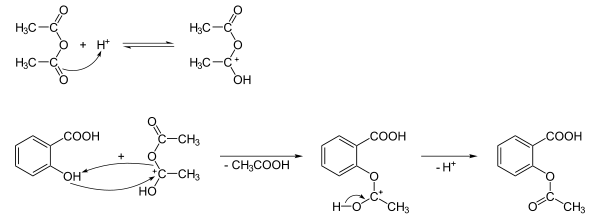
La synthèse initiale de Gerhardt décrite en 1853 [15] fut améliorée en 1975[16]. Elle est assez simple et consiste en l'estérification de la fonction hydroxyle de l'acide salicylique avec l'anhydride acétique, en milieu acide. On obtient l'acide acétylsalicylique et de l'acide acétique comme sous-produit (la synthèse de l'acide salicylique se fait par réaction de Kolbe).
La purification peut se faire deux façons : par re-cristallisation dans l'acétone (selon un brevet de Monsanto de 1959), par re-cristallisation dans un solvant mixte éthanol/eau 1:2,5 ou par un procédé mettant en œuvre une distillation (brevet de Norwich pharm de 1966). Le produit purifié se présente sous la forme de cristaux blancs en forme d'aiguille.
Un test au chlorure de fer (III) FeCl3 pourra être utile pour déterminer l'éventuelle présence d'acide salicylique n'ayant pas réagi. Le chlorure de fer (III) réagit avec le groupe OH de l'acide et donnera lieu à une coloration rouge du produit.
Conclusion
Ce vieux produit conserve les faveurs du public, comme le montre une enquête de la Sofres réalisée en 2003. Il est concurrencé par le paracétamol, autre analgésique et antipyrétique, mais dépourvu d'effets au plan gastrique (l'aspirine favorise l'ulcère comme les autres anti-inflammatoires non stéroïdiens). En revanche, le paracétamol a des effets néfastes irréversibles sur le foie à très fortes doses.
Aujourd'hui, l'automédication par aspirine, par ses effets sur l'estomac et sur le sang (antiagrégant plaquettaire, qui entraîne une diminution des capacités du sang à coaguler) en fait un médicament qui demande un maniement délicat et précis, qu'on remplace avantageusement par le paracétamol s'il s'agit de lutter contre des douleurs légères ou moyennes. Elle reste en revanche très utile pour la prévention des risques cardio-vasculaires dans la limite de 84 mg par jour comme précédemment mentionné.
Ce médicament est aussi le plus ancien et le plus utilisé au monde -environ 40 000 tonnes (80 milliards de comprimés) produits par an-. En France, annuellement 1500 tonnes d'aspirine sont consommés[17]. Sachant qu'un comprimé contient 500 milligrammes, chaque français consomme en moyenne, 60 comprimés d'aspirine par an.
Références
- ↑ a , b , c , d , e et f ACIDE 2 - ACETYLOXYBENZOIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide acétylsalicylique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ a , b , c et d RCP aspirine comprimé, AFSSAPS
- ↑ Ingestion of chilli pepper (Capsicum annuum) reduces salicylate bioavailability after oral aspirin administration in the rat ; CRUZ L., CASTANEDA-HERNANDEZ G., NAVARRETE A.; Can. j. physiol. pharmacol, 1999, vol. 77, no6, pp. 441-446[1]
- ↑ Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients, BMJ, 2002;324:71-86
- ↑ Lechat P, Priollet P, Prévention des évènements ischémiques majeurs au cours de l'artériopathie oblitérante des membres inférieurs : l'aspirine a-t-elle un rôle ?, J Mal Vasc, 2006;31:129-34
- ↑ Final report on the aspirin component of the ongoing physicians’ health study. Steering committee of the Physicians’ Health Study Research Group, N Engl J Med, 1989;321:129-35
- ↑ Ridker PM, Cook NR, Lee IM et als. A randomized trial of low-dose aspirin in the primary prevention of cardiovascular disease in women, N Engl J Med, 2005;352:1293-304
- ↑ Ogawa H, Nakayama M, Morimoto T, Low-Dose aspirin for primary prevention of atherosclerotic events in patients with type 2 diabetes, a randomized controlled trial, JAMA, 2008;300(18):2134-2141
- ↑ Nicolucci A, De BG, Sacco M, Tognoni G, AHA/ADA vs ESC/EASD recommendations on aspirin as a primary prevention strategy in people with diabetes: how the same data generate divergent conclusions, Eur Heart J, 2007;28:1925-7
- ↑ chimioprévention
- ↑ Chan AT. Aspirin, non-steroidal anti-inflammatory drugs, and colorectal neoplasia: future challenges in chemoprevention. Cancer Causes Control 2003;14:413-418
- ↑ Chan AT, Ogino S, Fuchs CS, Aspirin and the Risk of Colorectal Cancer in Relation to the Expression of COX-2, N Eng J Med, 2007;356:2131-2142
- ↑ U.S. Preventive Services Task Force, Routine Aspirin or Nonsteroidal Anti-inflammatory drugs for the primary prevention of colorectal cancer: U.S. Preventive Services Task Force recommendation statement, Ann Intern Med, 2007;146;361-364
- ↑ C. Gerhardt, Ann. 87, 149(1853)
- ↑ Faith, Keyes & Clark's industrial chemicals. F.A. lowenheim, M.K. Moran, eds. (wiley interscience, new york, 4th ed., 1975)
- ↑ dossier de ac-nancy-metz.fr, introduction
Voir aussi
Articles connexes
Liens externes
- Brochures promotionnelles sur l'aspirine (Société anonyme des produits Fréd. Bayer et cie, 1900 ?), illustrant l'enthousiasme pour le nouveau produit
- [pdf] Fiche signalétique
- Site canadien de Aspirin®
- Portail de la chimie
- Portail de la médecine
- Portail de la pharmacie
Catégories : Produit chimique nocif | Principe actif | AINS | Acide benzoïque | Ester carboxylique
Wikimedia Foundation. 2010.