- Acide ascorbique
-
Acide ascorbique 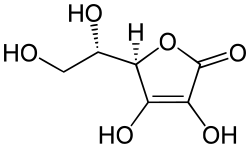
Structure de l’acide ascorbique Général Nom IUPAC 2-(1,2-dihydroxyéthyl)-4,5-dihydroxyfuran-3-one Synonymes acide DL-ascorbique No CAS No EINECS PubChem No E E300 SMILES InChI Propriétés chimiques Formule brute C6H8O6 [Isomères] Masse molaire[1] 176,1241 ± 0,0072 g·mol-1
C 40,92 %, H 4,58 %, O 54,5 %,Thermochimie Cp Précautions Directive 67/548/EEC Phrases S : 24/25, SIMDUT[3] Produit non contrôlé Inhalation Toux. Mal de gorge. Peau Rougeur. Yeux Rougeur. Douleur. Écotoxicologie DL50 3 367 mg·kg-1 (souris, oral)
518 mg·kg-1 (souris, i.v.)
> 10 000 mg·kg-1 (rat, s.c.)
643 mg·kg-1 (souris, i.p.)[4]DJA 1 050 mg pour une personne de 70 kg[5] Données pharmacocinétiques Demi-vie d’élim. 13 - 40 jours (humains),
3 jours (cochons d'inde)[5]Unités du SI & CNTP, sauf indication contraire. L’acide ascorbique est un acide organique ayant des propriétés antioxydantes. Il est présent sous une forme particulière (acide L-ascorbique ou vitamine C) dans les citrons, les jus de fruits et les légumes frais. Le nom ascorbique vient du préfixe grec a (privatif) et scorbut, signifiant littéralement anti-scorbut qui est une maladie due à une déficience en vitamine C.
Sommaire
Propriétés physico-chimiques
Stéréoisomérie
L'acide ascorbique ayant deux atomes de carbone asymétriques et étant sans plan de symétrie, il se présente sous la forme de deux paires d'énantiomères, diastéréoisomères entre elles. Une paire d'énantiomères est connue sous le nom acide ascorbique alors que l'autre est distinguée par le nom d'acide isoascorbique.
- (2R)-2-[(1S)-1,2-dihydroxyéthyl]-4,5-dihydroxyfuran-3-one ou acide L-(+)-ascorbique, numéro CAS , forme naturelle et connue sous le nom de vitamine C
- (2S)-2-[(1R)-1,2-dihydroxyéthyl]-4,5-dihydroxyfuran-3-one ou acide D-(–)-ascorbique, numéro CAS
- (2R)-2-[(1R)-1,2-dihydroxyéthyl]-4,5-dihydroxyfuran-3-one ou acide D-isoascorbique, numéro CAS
- (2S)-2-[(1S)-1,2-dihydroxyéthyl]-4,5-dihydroxyfuran-3-one ou acide L-isoascorbique, numéro CAS
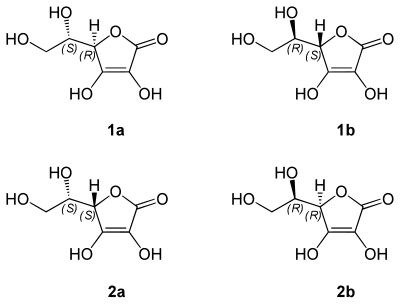 Acide L-ascorbique (vitamine C) (1a) ; acide D-ascorbique (1b) ; acide L-isoascorbique (2a) ; acide D-isoascorbique (2b)
Acide L-ascorbique (vitamine C) (1a) ; acide D-ascorbique (1b) ; acide L-isoascorbique (2a) ; acide D-isoascorbique (2b)
Tautomérie
L’acide ascorbique est majoritairement sous sa forme stable "énolique" car elle fait apparaître une conjugaison des liaisons doubles, ce qui est stabilisant. Néanmoins cette forme est en équilibre avec une hydroxy-cétone par transfert de proton. La réaction associée est une tautomérisation céto-énolique. Il y a deux formes possibles d'hydroxycétone.
 Protonation de l’ascorbate pour donner l'hydroxy-cétone.
Protonation de l’ascorbate pour donner l'hydroxy-cétone.
Les sels, appelés ascorbates, possèdent les mêmes propriétés physiologiques et sont donc inclus dans la dénomination Vitamine C.
Usage
On utilise l’acide ascorbique dans le vin pour son pouvoir réducteur ; en effet, en milieu acide, il fixe l’oxygène dissout, à la température ordinaire, en formant l’acide déhydro-ascorbique. Il permet d’une part d’économiser une petite quantité d’anhydrides sulfureux libre pour éviter l’oxydation des vins et de plus, il a des applications pratiques intéressantes en protégeant le vin de la casse ferrique lors du dernier stade, la mise en bouteille. Il est globalement utilisé dans l'industrie agro-alimentaire en tant qu'anti-oxygène empêchant la prolifération de bactéries qui pourraient dégrader le produit (surtout dans la nourriture à conservation longue et non réfrigérée). Il est aussi utilisé dans les bières notamment la Corona extra.
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-858-6)
- « Acide ascorbique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- (en) « Ascorbic acid » sur ChemIDplus, consulté le 9 août 2009
- (en) Volker Kuellmer, Kirk-Othmer encyclopedia of chemical technology 4th ed. : Ascorbic acid, vol. 25, John Wiley & Sons., 1991
Wikimedia Foundation. 2010.



