- Acide aspartique
-
Acide aspartique 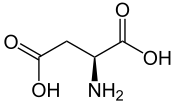
Acide L ou S(+)-aspartique
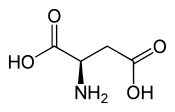
Acide D ou R(-)-aspartiqueGénéral Nom IUPAC acide (2S)-2-aminobutanedioïque Synonymes D, Asp No CAS (racémique)
(L) ou S(+)
(D) ou R(–)No EINECS (L)
(D)FEMA SMILES InChI Apparence cristaux incolores[1]. Propriétés chimiques Formule brute C4H7NO4 [Isomères] Masse molaire[2] 133,1027 ± 0,0051 g·mol-1
C 36,09 %, H 5,3 %, N 10,52 %, O 48,08 %,pKa 2,0
10,0
3,9Propriétés physiques T° fusion 270 °C[1] T° ébullition Se décompose au-dessous du point d'ébullition à 324 °C[1] Solubilité dans l'eau : 4,5 g·l-1[1] Masse volumique 1,7 g·cm-3[1] Propriétés biochimiques Codons GAU, GAC pH isoélectrique 2,85 Acide aminé essentiel Non Occurrence dans les protéines humaines 5,3 % Cristallographie Classe cristalline ou groupe d’espace P21 (L)[3] Paramètres de maille a = 7,617 Å
b = 6,982 Å
Z = 4 (L)[3]
c = 5,142 Å
α = 90,00 °
β = 99,84 °
γ = 90,00 °Volume 269,44 Å3 (L)[3] Densité théorique 3,281 (L)[3] Précautions SIMDUT[4] Produit non contrôlé Écotoxicologie LogP -3,89[1] Unités du SI & CNTP, sauf indication contraire. L’acide aspartique (dont l'anion s'appelle aspartate) est un acide carboxylique. C'est un acide dicarboxylique, polaire. Il est l'un des 20 acides aminés constituant les protéines.
Chez les mammifères, il est non essentiel. C'est un métabolite du cycle de l'urée, il participe à la gluconéogénèse et il joue un rôle de substrat de la voie de biosynthèse des pyrimidines.
L’acide aspartique a un point isoélectrique de 2,85 ce qui en fait le plus acide des acides aminés.
Sommaire
Acide aspartique et aspartame
L'acide aspartique représente 40 % des produits de dégradation de l’aspartame[5].
Notes et références
- ACIDE L - ASPARTIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Aspartic acid sur www.reciprocalnet.org. Consulté le 12 décembre 2009
- « Acide aspartique (l-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- [PDF] julientap.free.fr)
Voir aussi
Lien externe
Wikimedia Foundation. 2010.
