- Élément 118
-
Ununoctium
L'ununoctium est le nom provisoire attribué par l'UICPA à l'élément chimique de numéro atomique 118 (symbole provisoire Uuo), parfois encore appelé eka-radon (« en-dessous du radon » dans le tableau périodique des éléments) en référence à la désignation provisoire des éléments par Dmitri Mendeleïev avant qu'ils ne soient isolés et nommés[6]. Dans la littérature scientifique, l'ununoctium est généralement appelé élément 118.
De tous les éléments chimiques dont la synthèse est largement acceptée, c'est celui qui a la masse atomique et le numéro atomique les plus élevés. Il est particulièrement instable, et seuls trois atomes de 294Uuo ont été synthétisés à ce jour. Toutes les propriétés physiques et chimiques publiées pour cet élément sont par conséquent théoriques et découlent de modèles de calcul.
Formellement classé dans la série des gaz rares, il serait en réalité assez réactif, et les propriétés de quelques composés (tétrafluorure d'ununoctium UuoF4 et difluorure d'ununoctium UuoF2 par exemple) ont été calculées. Si on pouvait l'étudier d'un point de vue chimique, il se comporterait peut-être comme un métalloïde semiconducteur en raison d'une configuration électronique modifiée par couplage spin-orbite et des corrections dues à l'électrodynamique quantique[7]. De surcroît, en vertu de sa polarisabilité supérieure à celle de tous les éléments chimiques de numéro atomique inférieur, les calculs lui prédisent une température d'ébullition comprise entre 50 et 110 °C[4] de sorte qu'il serait sans doute liquide et même vraisemblablement solide, avec une masse volumique de l'ordre de 13 650 kg/m3, aux conditions normales de température et de pression.
Sommaire
Synthèse de l'élément 118
Fausse annonce (1999)
Motivée par la quête de l'îlot de stabilité, la recherche des éléments superlourds a été relancée à la fin des années 1990 par la synthèse de l'élément de numéro atomique 114 (ununquadium) en 1998 à l'Institut unifié de recherches nucléaires (JINR) de Doubna, en Russie. Le physicien polonais Robert Smolanczuk avait en effet publié des calculs sur la fusion de noyaux atomiques pour synthétiser des noyaux superlourds, y compris le noyau de numéro atomique 118[8] ; pour cet élément, il suggérait de fusionner un noyau de plomb avec un noyau de krypton. La synthèse d'un noyau de 293Uuo a été annoncée en 1999[9],[10] selon la réaction de fusion nucléaire :
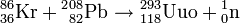
Ces résultats ont néanmoins été invalidés l'année suivante[11] car plus personne n'était en mesure de reproduire l'expérience ; en juin 2002, il fut révélé que l'annonce avait été faite à partir de résultats falsifiés par Viktor Ninov, le principal auteur[12].
Premières observations attestées (publiées en 2006)
La véritable découverte de l'ununoctium a été annoncée en 2006 par une équipe américano-russe du Laboratoire national de Lawrence Livermore (Californie, États-Unis) et de l'Institut unifié de recherches nucléaires (JINR) de Doubna, en Russie : l'observation indirecte au JINR de noyaux 294Uuo produits par collision d'ions calcium 48 sur atomes de californium 249[13],[14],[15],[16],[17], à raison d'un noyau 294Uuo en 2002[18] et de deux autres en 2005 :
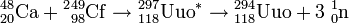
Mode opératoire
 Chaîne de désintégration du noyau 294118[19]. L'énergie de désintégration et la période radioactive sont indiquées en rouge, tandis que la fraction d'atomes subissant une fission spontanée est indiquée en vert.
Chaîne de désintégration du noyau 294118[19]. L'énergie de désintégration et la période radioactive sont indiquées en rouge, tandis que la fraction d'atomes subissant une fission spontanée est indiquée en vert.
Cette réaction de fusion nucléaire étant faiblement probable (avec une section efficace d'à peine 0,5 picobarn, soit 5×10−41 m2), il a fallu attendre quatre mois pour observer la première signature de désintégration d'un noyau d'élément 118 après avoir envoyé quelque 4×1019 ions calcium 48 sur la cible de californium[2]. Cette observation a néanmoins été validée dans la mesure où la probabilité d'une fausse détection avait été estimée à moins d'une pour cent mille[20]. Ce sont en tout trois noyaux de 294118 dont la désintégration a été observée, permettant d'estimer la période radioactive de cet isotope à 0.89+1.07−0.31ms et son énergie de désintégration à 11,65 ± 0,06 MeV[19].
La détection des noyaux 294118 repose sur l'observation de leur désintégration α en 290116, lequel est détecté par l'observation de sa chaîne de désintégrations α successivement en 286114 (avec une période de 10 ms et une énergie de 10,80 MeV) puis en 282112 (avec une période de 0,16 s et une énergie de 10,16 MeV) : si l'on observe la désintégration de noyaux 290116 dans le californium bombardé par des ions calcium, c'est que l'élément 116 s'y est formé par désintégration de noyaux 294118.
Dans la foulée de ces résultats, les travaux ont commencé pour observer l'élément 120 en bombardant du plutonium 244 avec des ions de fer 58[21]. Les isotopes de cet élément devraient avoir des périodes de l'ordre de quelques microsecondes[22].
Dénomination
L'ununoctium était encore appelé eka-émanation dans les années 1960[23] (symbole eka-Em dans la littérature scientifique d'alors ; « émanation » était le nom sous lequel était désigné le radon à cette époque), puis l'UICPA a recommandé en 1979 la dénomination systématique « un-un-oct-ium » fondée sur les trois chiffres du numéro atomique[24]. Il s'agit d'une dénomination temporaire avec un symbole à trois lettres qui s'applique à tous les éléments chimiques dont l'observation n'a pas encore été validée par l'UICPA, le nom définitif avec son symbole à deux lettres étant alors choisi par l'équipe à l'origine de la première caractérisation de l'élément.
Dans le cas de l'ununoctium, le nom provisoire demeure en usage bien que l'observation de cet élément ait été validée depuis plusieurs années pour la simple raison que les deux équipes (russe et américaine) à l'origine de ce résultat se sont pas parvenues à un consensus sur le nom à donner à l'élément n° 118 :
- A l'issue de l'annonce prématurée de 1999, l'équipe de Berkeley a voulu l'appeler Ghiorsium (Gh), d'après Albert Ghiorso, un directeur de l'équipe[25], mais cette dénomination a bien sûr été invalidée depuis.
- Lors de l'annonce par les Russes, en 2006, de la synthèse de cet élément au Flerov Laboratory of Nuclear Reactions (FLNR) du JINR, la première suggestion aurait été de l'appeler Dubnadium (Dn), ce qui était trop proche du Dubnium (Db), déjà nommé par eux[26].
- Cependant, lors d'un entretien avec une revue russe, le directeur du laboratoire a déclaré que son équipe envisageait deux noms : Flyorium en hommage au fondateur du laboratoire, Georgy Flyorov, et Moscovium, puisque Dubna se trouve dans l'oblast de Moscou[27]. Il a expliqué par la même occasion que le droit de choisir le nom de cet élément devait revenir à l'équipe russe, même si c'était l'équipe américaine du Laboratoire national de Lawrence Livermore qui avait notamment fourni la cible de californium, car le FLNR est la seule infrastructure au monde à pouvoir réaliser cette expérience[28],[29].
- L'équipe américaine ne partageant pas le point de vue russe, l'élément n° 118 demeure officiellement désigné par son nom provisoire, ununoctium ; il arrive néanmoins qu'on le rencontre sous le nom de moscovium (du cyrillique московий, transcrit moskovium, voire moskowium), avec le symbole Mk, dans la littérature d'origine russe, souvent bien documentée sur cet élément.
Il est à noter que, d'un point de vue général, la littérature scientifique préfère utiliser les numéros atomiques plutôt que les dénominations systématiques, de sorte que l'ununoctium est la plupart du temps désigné comme « élément 118 », et l'isotope ununoctium 294 est généralement représenté par le symbole « 294118 ».
Isotopes et îlot de stabilité
 Avec 118 protons et 176 neutrons, l'ununoctium 294 se place juste « au-dessus » (en termes de numéro atomique) de certaines localisations de l'îlot de stabilité théorique.
Avec 118 protons et 176 neutrons, l'ununoctium 294 se place juste « au-dessus » (en termes de numéro atomique) de certaines localisations de l'îlot de stabilité théorique.
Aucun élément chimique de numéro atomique supérieur à 82 (plomb) ne possède d'isotope stable[30], et tous les éléments de numéro atomique supérieur à 101 (mendélévium) ont une période radioactive inférieure à la journée.
Certaines théories décrivant la structure nucléaire selon un modèle en couches — les théories dites microscopic-macroscopic (MM) et de champ moyen relativiste (RMF) — prédisent l'existence d'un îlot de stabilité autour de nucléides constitués d'un « nombre magique » de neutrons et d'un nombre magique de protons : 184 neutrons dans tous les cas, mais 114, 120, 122 ou 126 protons selon les théories et les paramètres retenus dans les modèles. L'ununoctium, avec ses 118 protons et 176 neutrons pour son isotope connu, serait donc dans le voisinage de cet « îlot de stabilité » ; il se trouve que sa période radioactive de 0.89+1.07−0.31ms est un peu plus élevée qu'attendu[31],[32], ce qui irait dans le sens de cette théorie[33].
Des calculs laissent penser que d'autres isotopes de l'ununoctium pourraient avoir une période radioactive de l'ordre de la milliseconde[34] et, pour certains, supérieure à celle du noyau 294Uuo synthétisé, notamment les isotopes 293, 295, 296, 297, 298, 300 et 302[31]. Certains isotopes plus lourds, avec davantage de neutrons, pourraient également avoir des périodes radioactives plus longues, par exemple autour de 313Uuo[35].
Propriétés atomiques et physiques
Appartenant à la colonne des gaz rares, l'ununoctium devrait être un élément chimique à valence zéro : en raison de leur structure électronique, ces éléments sont chimiquement relativement inertes car, ayant une couche de valence aux sous-couches s et p complètes, ils n'ont pas d'électron de valence pour former une liaison chimique, en vertu de la règle de l'octet. On pourrait donc s'attendre à ce que l'élément 118 ressemble au radon[36]. Selon toute vraisemblance, la configuration électronique de l'ununoctium devrait être 7s2, 7p6[4]. Il serait cependant sensiblement plus réactif qu'on ne le pensait au premier abord. Étant situé en-dessous du radon dans le tableau périodique des éléments, il serait de toute façon plus réactif que ce dernier. Mais des phénomènes quantiques tels qu'un couplage spin-orbite sensible au sein des couches 7s et 7p conduiraient à diviser ces sous-couches en fonction du spin des électrons et à réorganiser différemment les niveaux d'énergie avec la couche de valence, d'où saturation apparente de cette dernière pour l'élément 114 (ununquadium) plutôt que pour l'élément 118, dont la couche de valence serait ainsi moins stable que celle de l'élément 116 (ununhexium), lui-même ayant une couche de valence moins stable que celle de l'élément 114[4].
Il a par ailleurs été calculé que l'ununoctium aurait une affinité électronique positive, à la différence de tous les autres gaz rares[37],[38], mais des corrections issues de l'électrodynamique quantique sont venues atténuer cette affinité (notamment en réduisant de 9 % l'énergie de liaison de l'anion Uuo–), rappelant l'importance de ces corrections dans les atomes superlourds.
L'ununoctium aurait une polarisabilité plus élevée de celle de tous les éléments de numéro atomique inférieur, et presque double de celle du radon[4], d'où un potentiel d'ionisation anormalement bas, similaire à celui du plomb, qui est 70 % celui du radon[39], et sensiblement plus faible que celle de l'élément 114[40]. Cela conduirait également à une température d'ébullition de 320 à 380 K[4], très supérieure aux valeurs publiées jusqu'à présent, de l'ordre de 263 K[3] et 247 K[41]. Même avec la marge d'incertitude sur cette température d'ébullition, il semble peu problable que l'élément 118, s'il existait en quantité massive, soit à l'état gazeux aux conditions normales de température et de pression. Dans la mesure où la plage de températures dans lesquelles les autres gaz rares existent à l'état liquide est très étroite (entre 2 et 9 K), l'ununoctium serait sans doute même solide[42].
Propriétés chimiques
Aucun composé d'ununoctium n'a encore été synthétisé, mais des modélisations de tels composés ont été calculées dès le milieu des années 1960[43]. Si cet élément présente une structure électronique de gaz rare, il devrait être difficile à oxyder en raison d'une énergie d'ionisation élevée[44], mais cette hypothèse semble justement devoir être revue. Les effets de couplage spin-orbite sur ses électrons périphériques auraient pour effet de stabiliser les états d'oxydation +2 et +4 avec le fluor, conduisant respectivement au difluorure d'ununoctium UuoF2 et au tétrafluorure d'ununoctium UuoF4, avec pour ce dernier une géométrie tétraédrique et non pas tétragonale plane comme, par exemple, le tétrafluorure de xénon XeF4 : cette géométrie différente vient de ce que les liaisons en jeux seraient de nature différente, liaison ionique dans le cas de l'ununoctium, liaison à trois centres et quatre électrons dans le cas du xénon.
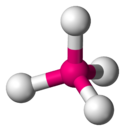
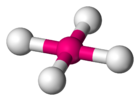
Conformation de la molécule de
tétrafluorure d'ununoctium UuoF4Conformation de la molécule de
tétrafluorure de xénon XeF4Le caractère ionique des liaisons ununoctium-fluor rendrait ces composés peu volatiles[45],[46].
Enfin, l'ununoctium serait suffisamment électropositif pour former des liaisons avec le chlore et donner des composés chlorés[45].
Notes et références
- ↑ a et b Moskowium, Apsidium, consulté le 18/01/2008
- ↑ a , b et c Ununoctium
- ↑ a et b (en) Glenn Theodore Seaborg, Modern Alchemy, World Scientific, 1994 (ISBN 9810214405), p. 172
- ↑ a , b , c , d , e , f et g (en) Clinton S. Nash, « Atomic and Molecular Properties of Elements 112, 114, and 118 », dans J. Phys. Chem. A, vol. 109, no 15, 2005, p. 3493–3500 [texte intégral (page consultée le 2008-01-18)]
- ↑ a et b R. Eichler, B. Eichler, « Thermochemical Properties of the Elements Rn, 112, 114, and 118 », Paul Scherrer Institut, consulté le 18/01/2008
- ↑ Le radon était appelé émanation (symbole Em) jusqu'au milieu des années 1960, de sorte qu'en fait l'élément 118 était alors appelé eka-émanation (symbole eka-Em).
- ↑ Gas Phase Chemistry of Superheavy Elements : Conférence de Heinz W. Gäggeler, Novembre 2007 — Page consultée le 07/07/2009.
- ↑ Robert Smolanczuk, « Production mechanism of superheavy nuclei in cold fusion reactions », dans Physical Review C, vol. 59, no 5, May 1999, p. 2634–2639 [lien DOI]
- ↑ Viktor Ninov, « Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb », dans Physical Review Letters, vol. 83, no 6–9, 1999-05-27, p. 1104–1107 [lien DOI]
- ↑ Robert F. Service, « Berkeley Crew Bags Element 118 », dans Science, vol. 284, 1999-06-11, p. 1751 [lien DOI]
- ↑ Public Affairs Department : Results of element 118 experiment retracted, Berkeley Lab (2001-07-21). Consulté le 2008-01-18.
- ↑ Rex Dalton, « Misconduct: The stars who fell to Earth », dans Nature, vol. 420, 2002, p. 728–729 [lien DOI]
- ↑ Livermore scientists team with Russia to discover element 118, Livermore press release (2006-12-03). Consulté le 2008-01-18.
- ↑ Yu. Ts. Oganessian, « Synthesis and decay properties of superheavy elements », dans Pure Appl. Chem., vol. 78, 2006, p. 889–904 [lien DOI]
- ↑ Heaviest element made - again, Nature News, Nature (journal) (2006-10-17). Consulté le 2008-01-18.
- ↑ Elements 116 and 118 Are Discovered, 2006-10-17
- ↑ Scientists Announce Creation of Atomic Element, the Heaviest Yet, 2006-10-17
- ↑ Element 118: results from the first 249Cf + 48Ca experiment
- ↑ a et b Yu. Ts. Oganessian, « Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cu + 48Ca fusion reactions », dans Physical Review C, vol. 74, no 4, 2006-10-09, p. 044602 [lien DOI]
- ↑ Element 118 Detected, With Confidence, 2006-10-17
- ↑ A New Block on the Periodic Table (PDF), Lawrence Livermore National Laboratory (April 2007). Consulté le 2008-01-18.
- ↑ P. Roy Chowdhury, C. Samanta, and D. N. Basu, « Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130 », dans At. Data & Nucl. Data Tables, vol. 94, 2008, p. 781–806 [texte intégral lien DOI]
- ↑ A. V. Grosse, « Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em) », dans Journal of Inorganic and Nuclear Chemistry, Elsevier Science Ltd., vol. 27, no 3, 1965, p. 509–19 [lien DOI]
- ↑ J. Chatt, « Recommendations for the Naming of Elements of Atomic Numbers Greater than 100 », dans Pure Appl. Chem., vol. 51, 1979, p. 381–384 [lien DOI]
- ↑ Discovery of New Elements Makes Front Page News
- ↑ Origins of the Element Names-Names Constructed from other Words
- ↑ New chemical elements discovered in Russia`s Science City, 2007-02-12
- ↑ Periodic table has expanded, 2006-10-17
- ↑ 118th element will be named in Russian, 2006-12-17
- ↑ Même l'isotope le plus stable du bismuth se désintègre en thallium avec une période radioactive, certes considérable, de 19×1018 ans ; voir (en) Pierre de Marcillac, Noël Coron, Gérard Dambier, Jacques Leblanc et Jean-Pierre Moalic, « Experimental detection of α-particles from the radioactive decay of natural bismuth », dans Nature, vol. 422, avril 2003, p. 876–878(3) [lien DOI].
- ↑ a et b P. Roy Chowdhury, C. Samanta, and D. N. Basu, « α decay half-lives of new superheavy elements », dans Phys. Rev. C, vol. 73, 26 January 2006, p. 014612 [lien DOI]
- ↑ Yuri Oganessian, « Heaviest nuclei from 48Ca-induced reactions », dans J. Phys. G: Nucl. Part. Phys., vol. 34, 2007, p. R165–R242 [lien DOI]
- ↑ New Element Isolated Only Briefly, 2006-10-18
- ↑ P. Roy Chowdhury, C. Samanta, and D. N. Basu, « Search for long lived heaviest nuclei beyond the valley of stability », dans Phys. Rev. C, vol. 77, 2008, p. 044603 [lien DOI]
- ↑ S B Duarte, O A P Tavares, M Gonçalves, O Rodríguez, F Guzmán, T N Barbosa, F García and A Dimarco, « Half-life predictions for decay modes of superheavy nuclei », dans J. Phys. G: Nucl. Part. Phys., vol. 30, 2004, p. 1487–1494 [texte intégral lien DOI (pages consultées le 2008-01-18)]
- ↑ Ununoctium (Uuo) - Chemical properties, Health and Environmental effects
- ↑ Igor Goidenko, Leonti Labzowsky, Ephraim Eliav, Uzi Kaldor, and Pekka Pyykko, « QED corrections to the binding energy of the eka-radon (Z=118) negative ion », dans Physical Review A, vol. 67, 2003, p. 020102(R) [lien DOI]
- ↑ Ephraim Eliav and Uzi Kaldor, « Element 118: The First Rare Gas with an Electron Affinity », dans Physical Review Letters, vol. 77, no 27, 1996-12-30 [texte intégral (page consultée le 2008-01-18)]
- ↑ Young-Kyu Han, Cheolbeom Bae, Sang-Kil Son, and Yoon Sup Lee, « Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118) », dans Journal of Chemical Physics, vol. 112, no 6, 2000-02-08 [texte intégral (page consultée le 2008-01-18)]
- ↑ Clinton S. Nash, « Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118 », dans J. Phys. Chem. A, vol. 1999, no 3, 1999, p. 402–410 [lien DOI]
- ↑ N. Takahashi, « Boiling points of the superheavy elements 117 and 118 », dans Journal of Radioanalytical and Nuclear Chemistry, vol. 251, no 2, 2002, p. 299–301 [lien DOI]
- ↑ Sous réserve, bien entendu, que les propriétés des gaz rares puissent être extrapolées à cet élément qui ne semble pas en être un.
- ↑ A. V. Grosse, « Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em) », dans Journal of Inorganic and Nuclear Chemistry, Elsevier Science Ltd., vol. 27, no 3, 1965, p. 509–19 [lien DOI]
- ↑ Ununoctium: Binary Compounds
- ↑ a et b (en) Uzi Kaldor, Stephen Wilson, Theoretical Chemistry and Physics of Heavy and Superheavy Elements, Springer, 2003 (ISBN 140201371X), p. 105
- ↑ Kenneth S. Pitzer, « Fluorides of radon and element 118 », dans J. Chem. Soc., Chem. Commun., 1975, p. 760b–761 [lien DOI]
Voir aussi
Articles liés
Sites web
- ELEMENT 118: EXPERIMENTS on DISCOVERY, archives sur le site officiel du découvreur de l'élément
- Chemistry-Blog : Une analyse indépendante des annonces autour de la découverte de l'élément n° 118
- WebElements : Ununoctium
- Apsidium : Ununoctium - Moskowium
- It's Elemental : Ununoctium
- Au sujet des annonces sur les découvertes des éléments n° 110, 111, 112, 114, 116, et 118 (rapport technique de l'UICPA)
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Gaz noble | Transactinide
Wikimedia Foundation. 2010.
