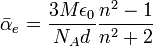- Polarisabilite
-
Polarisabilité
En électromagnétisme et en chimie, la polarisabilité désigne un phénomène causé par le moment des charges électriques de l'atome.
Une molécule placée dans un champ électrique
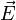 subit une déformation. Ainsi le barycentre des charges négatives (électrons) se décale légèrement par rapport à celui des charges positives (noyaux), d'où un moment électronique induit
subit une déformation. Ainsi le barycentre des charges négatives (électrons) se décale légèrement par rapport à celui des charges positives (noyaux), d'où un moment électronique induit 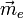 .
.Dans les molécules di ou polyatomiques, les atomes se déplacent également les uns par rapport aux autres d'où une contribution supplémentaire dite atomique. Pour les champs faibles, le moment induit est proportionnel au champ, d'où la relation
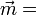

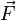 , où
, où  est le tenseur des polarisabilités [1],[2] et
est le tenseur des polarisabilités [1],[2] et 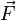 le champ localement ressenti par la molécule (on parle de champ local).
le champ localement ressenti par la molécule (on parle de champ local).La polarisabilité est donc la somme de deux contributions. La première, de loin la plus importante, est la polarisabilité électronique. La polarisabilité atomique joue un rôle mineur, quoique non négligeable [3].
Sommaire
Généralités
- Dans le référentiel principal de la molécule, le tenseur des polarisabilités est diagonal.
- La polarisabilité électronique mesurée (via des mesures d'indice de réfraction et de densité) est la moyenne de ces éléments diagonaux.
- Dans le Système international, les polarisabilités sont exprimées en C2m2J − 1
- Dans le système UES et CGS, les polarisabilités sont exprimées en A3. Elles ont la dimension d'un volume.
- La polarisabilité atomique augmente avec la taille des atomes (par extension, les anions seront donc plus polarisables que les atomes neutres correspondant).
Polarisabilté électronique
Notion tensorielle de la polarisabilité
Dans le cas d'un atome le moment induit
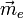 , purement électronique, est colinéaire et proportionnel au champ local
, purement électronique, est colinéaire et proportionnel au champ local 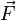 selon la relation
selon la relation 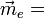 αe
αe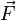
Dans le cas d'une molécule, le moment induit
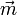 provient encore essentiellement du moment électronique
provient encore essentiellement du moment électronique 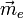 mais
mais 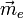 et
et 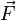 ne sont plus, en général, colinéraires et cette relation devient
ne sont plus, en général, colinéraires et cette relation devient 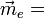
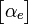
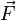 où
où 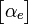 est le tenseur des polarisabilités électroniques de la molécule représenté par la matrice
est le tenseur des polarisabilités électroniques de la molécule représenté par la matriceComme c'est un tenseur symétrique il est déterminé par la donnée de 6 éléments. Dans le repère principal de la molécule ce tableau devient diagonal et les termes diagonaux sont les polarisabilités principales de la molécule
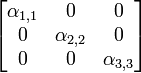
La relation qui relie le moment induit et le champ local
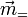

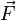 peut donc s'écrire :
peut donc s'écrire :mi = ∑ αi,jFj j où mi est la composante de
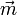 dans la direction i et Fj la composante du champ local dans la direction j.
dans la direction i et Fj la composante du champ local dans la direction j.Dans un repère quelconque le tenseur
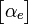 est caractérisé par trois invariants (indépendants du repère). Deux d'entre eux peuvent être déduits des propriétés électro-optiques. Le premier est la trace du tenseur : T = α1,1 + α2,2 + α3,3, d'où la polarisabilité
est caractérisé par trois invariants (indépendants du repère). Deux d'entre eux peuvent être déduits des propriétés électro-optiques. Le premier est la trace du tenseur : T = α1,1 + α2,2 + α3,3, d'où la polarisabilité 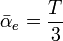
Le second invariant est l'anisotropie de polarisabilité notée γ2. Cette grandeur mesure la différence entre les différentes composantes du tenseur des polarisabilités. Dans le référentiel principal, on écrit :
Mesure de la polarisabilité électronique
On déduit
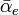 des mesures d'indice de réfraction et de densité à l'aide de l'équation de Lorentz-Lorenz [4],[5] :
des mesures d'indice de réfraction et de densité à l'aide de l'équation de Lorentz-Lorenz [4],[5] :avec NA le nombre d'Avogadro, ε0 la permittivité du vide, M la masse molaire de la molécule étudiée, n et d les indice de réfraction et la densité du liquide correspondant.
Dans le Système international, les polarisabilités sont exprimées en C2m2J − 1. Dans le système d'unité UES CGS, elles sont exprimées comme un volume en 1A3 avec 1A3 = 1,112761.10 − 41C2m2J − 1
Mesure de l'anisotropie des polarisabilités électroniques
On déduit γ2 des mesures de diffusion de la lumière (ou diffusion Rayleigh) ou d'effet Kerr. Cette grandeur s'exprime en A6 dans le système ues cgs.
Polarisabilté atomique
Dans une molécule quelconque il existe une seconde contribution
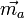 à
à 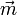 qui provient des déplacements des atomes sous l'effet du champ local
qui provient des déplacements des atomes sous l'effet du champ local 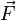 . le moment induit
. le moment induit 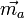 provient d'une part des déplacements des charges portées par les atomes et d'autre part de la modification de la répartition électronique dans la molécule.
provient d'une part des déplacements des charges portées par les atomes et d'autre part de la modification de la répartition électronique dans la molécule.La relation tensorielle entre
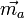 et
et 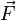 s'écrit
s'écrit 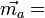
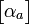
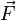 où
où 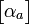 est le tenseur des polarisabilités atomique de la molécule.
est le tenseur des polarisabilités atomique de la molécule.La contribution atomique est relativement faible devant la polarisabilité électronique. Pour les molécules courantes on estime que le rapport
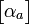 /
/ 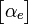 est en général compris entre 5 et 15 %.
est en général compris entre 5 et 15 %.Polarisabilté d'orientation
Polarisabilté totale
Notes et références
Articles connexes
- Portail de la physique
- Portail de la chimie
- Portail de l’électricité et de l’électronique
Catégories : Chimie physique | Électrostatique | Physique du solide
Wikimedia Foundation. 2010.


![\gamma^2 = \frac 12[(\alpha_{1,1} - \alpha_{2,2})^2 + (\alpha_{1,1} - \alpha_{3,3})^2 + (\alpha_{2,2} - \alpha_{3,3})^2 ]](/pictures/frwiki/99/ccd1cef62405d1bcf358b8044cc63a55.png)