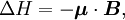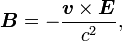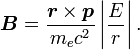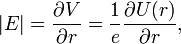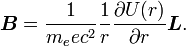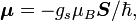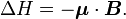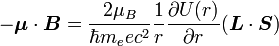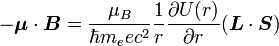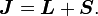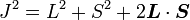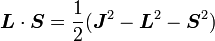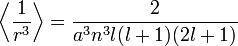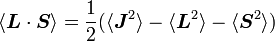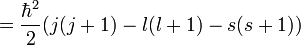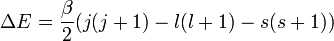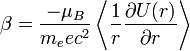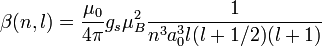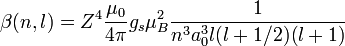- Couplage spin-orbite
-
Interaction spin-orbite
En mécanique quantique, l'interaction spin-orbite (aussi appelée effet spin-orbit ou couplage spin-orbite) qualifie toute interaction entre le spin d'une particule et son mouvement. Le premier et le plus connu des exemples de cette interaction est la production de décalages dans les niveaux d'énergie électroniques (que l'on observe par la séparation des raies spectrales) en raison de l'interaction entre le spin de l'électron et le champ électrique nucléaire dans lequel il se meut. Un effet similaire, dû à la relation entre moment angulaire et la force nucléaire forte, se produit pour les mouvements des protons et neutrons dans le noyau atomique, conduisant à un décalage dans leurs niveaux d'énergie dans le modèle en couches du noyau. En spintronique, les effets spin-orbites pour les électrons dans les semi-conducteurs et autres matériaux sont étudiés et exploités technologiquement.
Sommaire
Interaction spin-orbit dans les niveaux d'énergies atomiques
On présentera dans cette section une description relativement simple et quantitative de l'interaction spin-orbite pour un électron lié à un atome, en utilisant de l'électrodynamique semi-classique et de la mécanique quantique non-relativiste, jusqu'au premier ordre dans la théorie de la perturbation. Cela donne des résultats qui sont en accord, mais pas parfait, avec les observations. Une démonstration plus rigoureuse du même résultat se baserait sur l'équation de Dirac, et atteindre un résultat plus précis nécessiterait le calcul des petites corrections issues de l'électrodynamique quantique, ce qui est au-delà de l'objectif de cet article.
Energie de moment magnétique
L'énergie d'un moment magnétique dans un champ magnétique est donnée par :
où μ est le moment magnétique de la particule et B est la valeur du champ magnétique de l'expérience.
Champ magnétique
Traitons d'abord du champ magnétique. Bien que dans le référentiel au repos du noyau, il n'y ait aucun champ magnétique, il y en a un dans le référentiel au repos de l'électron. En ne tenant pas compte pour le moment que ce référentiel ne soit pas galiléen, on traite l'équation :
où v est la vitesse de l'électron et E le champ électrique traversé. On sait que E est radial, on peut réécrire
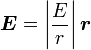 . On sait aussi que la quantité de mouvement de l'électron est
. On sait aussi que la quantité de mouvement de l'électron est 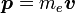 . En y introduisant ces quantités et en changeant l'ordre du produit vectoriel, on a :
. En y introduisant ces quantités et en changeant l'ordre du produit vectoriel, on a :Puis on exprime le champ électrique comme le gradient du potentiel électrique
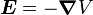 . On effectue ici l'approximation du champ central en considérant que le potentiel électrostatique a une symétrie sphérique, donc qu'il est fonction du seul rayon. Cette approximation est vérifiée pour l'hydrogène, et par conséquent pour les systèmes hydrogénoïdes. On peut alors dire que :
. On effectue ici l'approximation du champ central en considérant que le potentiel électrostatique a une symétrie sphérique, donc qu'il est fonction du seul rayon. Cette approximation est vérifiée pour l'hydrogène, et par conséquent pour les systèmes hydrogénoïdes. On peut alors dire que :où U = V.e est l'énergie potentielle de l'électron dans un champ central, et e est sa charge élémentaire. D'après la mécanique classique, le moment angulaire d'une particule est
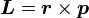 . Par substitution, on a alors :
. Par substitution, on a alors :Il est important de noter qu'à ce moment, B est un nombre positif factorisant L, ce qui signifie que le champ magnétique est parallèle au moment angulaire orbital de la particule.
Moment magnétique de l'électron
Le moment magnétique d'un électron est :
où
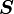 est le vecteur du moment angulaire de spin, μB est le magnéton de Bohr et
est le vecteur du moment angulaire de spin, μB est le magnéton de Bohr et 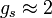 est le facteur g de spin électronique. Ici,
est le facteur g de spin électronique. Ici, 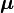 est une constante négative multipliée par le spin, donc le moment magnétique est antiparallèle au moment angulaire de spin.
est une constante négative multipliée par le spin, donc le moment magnétique est antiparallèle au moment angulaire de spin.Énergie d'interaction
L'énergie d'interaction est :
Effectuons quelques substitutions :
On n'a jusqu'à présent pas pris en compte le fait que le référentiel électronique soit non-galiléen. Cet effet est appelé précession de Thomas et introduit un facteur
 . On a alors :
. On a alors :Évaluation du décalage énergétique
Grâce aux approximations ci-dessus, on peut évaluer exactement le décalage en énergie dans ce modèle. En particulier, on souhaite trouver une base qui diagonalise à la fois H0 (hamiltonien non perturbé) et ΔH. Afin d'identifier cette base, on définit en premier lieu l'opérateur de moment angulaire total.
En prenant le produit scalaire de cette expression sur elle-même, on a :
(puisque L et S commutent), puis :
On peut montrer que les cinq opérateurs H0, J², L², S², et Jz commutent tous les uns avec les autres ainsi qu'avec ΔH. Ainsi, la base que l'on recherche est la base propre des cinq opérateurs simultanément (donc la base dans laquelle ces cinq opérateurs sont diagonaux). Les éléments de cette base ont les cinq nombres quantiques : n (nombre quantique principal), j (nombre quantique du moment angulaire total), l (nombre quantique du moment angulaire orbital), s (nombre quantique de spin) et jz (la composante z du moment angulaire total).
Pour le calcul des énergies, on note que :
pour les fonctions d'ondes hydrogénoïdes (ici
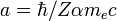 est le rayon de Bohr divisé par la charge nucléaire Z) ; et :
est le rayon de Bohr divisé par la charge nucléaire Z) ; et :Déplacement énergétique final
On a alors :
où
Pour l'hydrogène, on peut écrire le résultat explicite :
Pour tout atome mono-ionisé à Z protons :
Voir aussi
Références
- E. U. Condon, G. H. Shortley, The Theory of Atomic Spectra, Cambridge University Press, 1935
- D. J. Griffiths, Introduction to Quantum Mechanics (2e édition), Prentice Hall, 2004
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Spin-orbit interaction ».
- Portail de la physique
- Portail de la chimie
Catégories : Physique atomique | Spintronique
Wikimedia Foundation. 2010.