- Tétrafluorure de xénon
-
Tétrafluorure de xénon 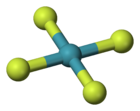
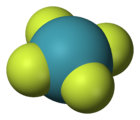
Structure du tétrafluorure de xénonGénéral No CAS No EINECS SMILES InChI Propriétés chimiques Formule brute XeF4 Masse molaire[1] 207,287 ± 0,006 g·mol-1
F 36,66 %, Xe 63,34 %,Propriétés physiques T° fusion 115,7 °C (sublimation) T° ébullition 115,7 °C Solubilité Décomposition avec l'eau Masse volumique 4 040 kg·m-3 à 15 °C Point critique 70,4 bar, 338,85 °C [2] Unités du SI & CNTP, sauf indication contraire. Le tétrafluorure de xénon est le composé chimique de formule XeF4. Il se présente sous forme d'un solide cristallin incolore qui se sublime à 115,7 °C. Il se forme à partir de xénon et de fluor dans les proportions molaires 1:2 en libérant une énergie de 251 kJ·mol-1 [[3],[4]] :
- Xe + 2 F2 → XeF4 + 251 kJ·mol-1
Il se décompose rapidement au contact de l'eau, même en présence de traces d'humidité dans l'air :
- 6 XeF4 + 12 H2O → 2 XeO3 + 4 Xe + 3 O2 + 24 HF
Il doit donc être conservé à sec.
XeF4 réagit avec le fluorure de tétraméthylammonium N(CH3)4F pour former le pentafluoroxénate de tétraméthylammonium, de formule N(CH3)4XeF5 :
- XeF4 + N(CH3)4F → N(CH3)4XeF5
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- Claassen, H. H.; Selig, H.; Malm, J. G., « Xenon Tetrafluoride », dans J. Am. Chem. Soc., vol. 84, no 18, 1962, p. 3593 [lien DOI]
- C. L. Chernick, H. H. Claassen, P. R. Fields 1, H. H. Hyman, J. G. Malm, W. M. Manning, M. S. Matheson, L. A. Quarterman, F. Schreiner, H. H. Selig, I. Sheft, S. Siegel, E. N. Sloth, L. Stein, M. H. Studier, J. L. Weeks, and M. H. Zirin, « Fluorine Compounds of Xenon and Radon », dans Science, vol. 138, no 3537, 1962, p. 136–138 [lien PMID, lien DOI]
Articles connexes
Wikimedia Foundation. 2010.
