- Liaison à trois centres et quatre électrons
-
La liaison à trois centres et quatre électrons (abrégé en liaison 3c-4e) est un modèle employé pour décrire les liaisons dans les molécules hypervalentes telles que le tétrafluorure de soufre SF4, le pentafluorure de phosphore PF5, l'hexafluorure de soufre SF6, les fluorures de xénon XeFn et l'ion bifluorure HF2-[1],[2]. Elle est également connue comme modèle à trois centres de Pimentel-Rundle suite aux travaux publiés par George C. Pimentel en 1951[3] à partir des idées développées plus tôt par Robert E. Rundle sur les liaisons à déficit d'électron[4].
Le modèle considère la liaison de trois atomes colinéaires. Dans le difluorure de xénon XeF2, le groupe F-Xe-F est décrit par un ensemble de trois orbitales moléculaires dérivées des orbitales atomiques p colinéaires des trois atomes. Dans ce modèle, les liaisons Xe-F résultent de la combinaison :
d'où :
-
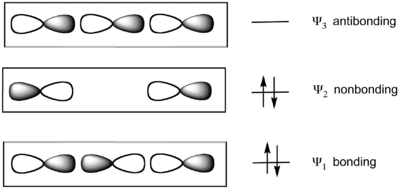
- une orbitale moléculaire liante Ψ1 occupée,
- une orbitale moléculaire non liante Ψ2 occupée,
- une orbitale moléculaire antiliante Ψ3 vacante.
Les deux orbitales moléculaires d'énergie la plus basse sont occupées deux fois. L'orbitale moléculaire occupée la plus élevée se trouve sur les deux atomes latéraux, qui sont fortement électronégatifs dans les molécules hypervalentes. D'après ce modèle, les molécules SF4 et PF5 sont décrites avec une liaison à trois centres et quatre électrons ainsi que, respectivement, deux et trois liaisons conventionnelles ; dans la molécule SF6 ainsi que dans celles des fluorures de xénon, toutes les liaisons sont décrites comme à trois centres et quatre électrons.
Les liaison dans la molécule XeF2 peuvent également être représentées qualitativement avec des formules de Lewis en résonance :
- F-Xe+ -F
 F- +Xe-F
F- +Xe-F
Cette représentation respecte la règle de l'octet, avec des liaisons d'ordre 1/2 et avec accroissement de la densité électronique autour des deux atomes de fluor latéraux : ceci est cohérent avec les diagrammes des orbitales moléculaires présentés plus haut.
Notes et références
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford : Butterworth-Heinemann, ISBN 0-7506-3365-4 p. 897.
- Weinhold, F.; Landis, C. Valency and bonding, Cambridge, 2005; pp. 275-306.
- Pimentel, G. C. « The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method. » J. Chem. Phys. 1951, 19, 446-448. DOI:10.1063/1.1748245
- Rundle, R. E. Electron Deficient Compounds. II. Relative Energies of "Half-Bonds". J. Chem. Phys 1949, 17, 671-675.DOI:10.1063/1.1747367
Article connexe
Wikimedia Foundation. 2010.