- Nitrogène
-
Azote
L'azote est un élément chimique de la famille des pnictogènes, de symbole N et de numéro atomique 7. Dans le langage courant, l'azote désigne le gaz diatomique diazote N2, constituant majoritaire de l'atmosphère terrestre, représentant presque les 4/5e de l'air (78.06 %, en volume).
L'azote est le 34e élément constituant la croûte terrestre par ordre d'importance.
Les « minéraux » contenant de l'azote sont essentiellement les nitrates: nitrate de potassium KNO3 (constituant du salpêtre) ou « nitre » qui servait autrefois à faire des poudres explosives; nitrate de sodium NaNO3 (constituant du salpêtre du Chili).
Sommaire
Histoire
Le nom latin « nitrogenium » provient du grec nitron gennan, ce qui signifie « formateur de salpêtre » (nitrate de potassium). Le symbole chimique N provient de cette origine.
Le terme anglais pour désigner l'azote est nitrogen.
Il existe aussi le nom nitrogène en français, mais l'appellation azote est la plus fréquente.
Antoine Lavoisier a choisi le nom azote, composé de a- (privatif) et du radical grec ζωτ-, « vivant » et signifie donc « privé de vie », du fait que contrairement à l'oxygène, il n'entretient pas la vie des animaux.
L'azote a été isolé par Daniel Rutherford en 1772, cependant les composés azotés sont connus depuis l'antiquité. On le préparait en extrayant de l'air le dioxygène et le dioxyde de carbone.
Il a principalement été utilisé sous forme de nitrates, dans les engrais et explosifs pour les munitions de guerre et de chasse ou explosifs civils.
Exploitation et usages
Composés de l'azote
Paradoxalement, et malgré son nom, l'élément chimique « azote » est (avec le carbone, l'oxygène et l'hydrogène) un des composants principaux du Vivant et des écosystèmes ainsi que des agrosystèmes (Cf. cycle de l'Azote). Il entre dans la composition des protéines (pour environ 15 %). L'azote est présent dans de très nombreux produits chimiques, dont certains pesticides dits à (« urées substituées »).
L'azote a été exploité et l'est encore en tant qu'engrais naturel dans l'urée animale (ou humaine) et le guano (excréments sec d'oiseau ou de chauve-souris), notamment au Chili, au Pérou, en Inde, en Bolivie, en Espagne, en Italie et en Russie. La nitre (nitrate naturel minéral) était autrefois récoltée pour produire la poudre à canon.
Aujourd'hui, ses composés sont essentiellement produits industriellement par synthèse chimique pour de nombreux usages, dont par exemple :
- fertilisants agricoles (engrais) ; les sels d'ammonium sont absorbés par les plantes, qui sont alors forcées d'absorber plus d'eau (équilibre osmotique). Ces sels forcent ainsi la plante à grossir. Si d'autres minéraux sont présents en suffisance (phosphore, potassium en particulier) cet azote dope la croissance des plantes cultivées. De l'azote est pour cette raison utilisé sous forme de nitrate d'ammonium, NH4NO3, de sulfate d'ammonium, (NH4)2SO4, de monophosphate d'ammonium, NH4H2PO4, ou d'urée, CO(NH2)2. C'est aujourd'hui le principal usage de l'azote dans le monde, qui est également responsable d'une pollution généralisée (eutrophisation, dystrophisation) de l'environnement (eaux de nappes, estuaires, certains littoraux, avec l'apparition de vaste zones mortes dans les océans jugées très préoccupantes par l'ONU).
- produits pharmaceutiques :
- certains nitrates « organiques », telle la nitroglycérine, sont utilisés pour soigner certaines affections cardiovasculaires ;
- le protoxyde d'azote (gaz hilarant) est utilisé comme anesthésiant ;
- l'ammoniac NH3, utilisé comme matière première de production de polymères, d'explosifs, d'engrais, ou comme fluide réfrigérant dans certains installations industrielles ;
- combustibles (l'hydrazine et autres dérivés comme combustibles de fusée) ;
- explosifs (composés chimiques organiques qui possèdent plusieurs groupes -ONO2 ou -NO2 : dynamite) ;
- gaz propulseurs pour bombes aérosols (N2O) ou aérographes ;
- conservateur (E250, NaNO2) ;
- azoture de sodium, utilisé pour gonfler instantanément les coussins de protection "airbags" en cas de choc.
Par réaction avec l'oxygène, l'azote forme trois oxydes stables : l'oxyde de diazote N2O, le monoxyde d'azote NO et le pentaoxyde de diazote N2O5.
Diazote
Aujourd'hui, l'azote gazeux ou diazote est généralement obtenu par liquéfaction de l'air, dont il est le principal constituant avec une concentration de 78,06 % en volume et de 75,5 % en masse. La production mondiale est d'environ 150 millions de tonnes par an.
Article détaillé : diazote.Le gaz diazote lui-même a en particulier les applications suivantes :
- Emballage de denrées alimentaires (MAP): L'inertage des aliments emballés augmente leur durée de conservation en remplaçant l'air ambiant (contenant de l'oxygène) par de l'azote (pureté de 95 à 99,5 %)[2]* gaz « neutre » utilisé pour protéger (grâce à la constitution d'une atmosphère inerte confinée) des produits, des objets ou des contenants (citernes par exemple) dans l'industrie, les musées ou autres lieux : protection contre la corrosion, des insectes, champignons... ;
- gaz utilisé comme pesticide doux pour éliminer par asphyxie les vers du bois ou certains organismes (ex : Petite vrillette) ayant colonisé des objets anciens fragiles (cadres, sculptures et objets de bois, incunables, les parchemins, gravures, etc.) ;
- gaz de gonflage de pneumatiques. Bien que l'air contienne déjà 78 % d'azote (de diazote pour être plus précis), certains professionnels de l'aviation ou de la formule 1, (par exemple), augmentent cette proportion et gonflent les pneumatiques avec de l'azote presque pur. Ce gaz ayant la propriété d'être inerte et stable conserve une pression plus constante même en cas d'échauffement intense du pneumatique. De plus ce gaz fuit plus difficilement[évasif]. Une polémique existe d'ailleurs quant à l'introduction de cette méthode pour les véhicules particuliers. En effet, ceux-ci sont soumis à des contraintes bien moindres ce qui rend la différence avec l'air moins notable. Par contre le gonflage devient payant et on lui reproche souvent d'avoir un prix non justifié (le gonflage à l'air est souvent gratuit et jugé satisfaisant). Ceux qui l'utilisent devraient avoir, en principe, à rectifier le gonflage plus rarement, mais ils doivent néanmoins contrôler les pressions régulièrement.
- gaz utile pour gonfler les accumulateurs hydrauliques en raison de sa passivité vis-à-vis des huiles.
- Construction mécanique: Beaucoup de machines de découpe modernes fonctionnent avec un rayon laser, celui-ci nécessite de l'azote comme gaz moteur ou comme gaz d'inertage.[2]
- agent de lutte contre les incendies : allié à 50 % d'argon et parfois avec du dioxyde de carbone, il est présent dans certaines installations d'extinction automatique à gaz protégeant des salles informatiques où des stockages particuliers ne devant pas être endommagés par de la poudre ou de l'eau. Conservé dans des bonbonnes métalliques sous une pression d'environ 200 bars, il est libéré dans un local où un début d'incendie a été détecté. Le volume de diazote injecté remplace une partie de l'atmosphère de la pièce et entraine une chute du taux d'oxygène dans l'air. Le niveau généralement retenu de 15 % de comburant interrompt le phénomène de combustion sans effet létal sur la respiration humaine ;
- azote liquide : agent réfrigérant.
- Métallurgie : l'azote est régulièrement injecté dans des fours de production de métaux hautement oxydables (p.ex. l'aluminium et ses alliages) pour en empêcher la réaction avec l'oxygène de l'air. Il est également utilisé pour éviter la corrosion lors de brasures (p.ex. brasure du Cuivre).[2]
Le diazote, contrairement aux gaz inhibiteurs chimiques halogénés et aux CFC ne présente a priori aucun effet nocif pour l'environnement (pas d'impact sur l'effet de serre, ni sur la couche d'ozone). Mais il requiert des réservoirs volumineux, des canalisations adaptées et des mesures constructives pour faire face à la détente brutale d'un équivalent de 40 à 50 % du volume protégé.
Danger du gaz diazote : l'utilisation de diazote pour créer des atmosphères confinées inertes est à l'origine de plusieurs morts par asphyxie, lorsqu'une personne pénètre sans s'en rendre compte dans une enceinte inertée ; il est nécessaire de vérifier la présence d'une proportion suffisante d'oxygène dans de tels espaces confinés avant d'y pénétrer, ou de s'équiper d'un appareil respiratoire autonome.
En plongée, l'azote contenu dans l'air respiré sous pression est à l'origine du phénomène de la narcose. La pression partielle d'azote devient en effet "toxique" pour l'organisme à partir de PpN2= 3,6 bars et la narcose est réelle à PpN2=4,6 Bars (soit une plongée à environ 50 m de profondeur). C'est aussi l'élément principal dictant la durée des paliers de décompression.
Article connexe : Azote liquide.Notes et références
Voir aussi
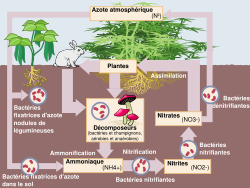
Article connexe : Cycle de l'azote.Liens internes
- Amide
- Amidure
- Amine
- Ammoniac
- Azoture
- Cycle de l'azote
- Eutrophisation, dystrophisation
- Fixation biologique de l'azote
- Macro-élément
- Nitrite
- Nitronium
- Nitrure
- NOx
Liens externes
- (fr) Rôle de l'azote comme élément nutritif pour une plante
- (en) Portail d’un groupe de travail international sur la pollution azotée (ONU), cadré par le Global Programme of Action for the Protection of the Marine Environment from Land-Based Activities (ONU / PNUED)
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Non-métal | Gaz | Réfrigérant | Pnictogène | Métabolisme de l'azote | Théorie de la plongée
Wikimedia Foundation. 2010.