- Protoxyde d'azote
-
Protoxyde d'azote 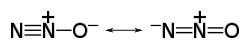
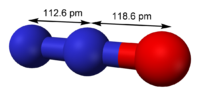
Structure du protoxyde d'azote.Général Nom IUPAC Protoxyde d'azote Synonymes Oxyde nitreux
Oxyde de diazote
Gaz hilarantNo CAS No EINECS Code ATC N01 PubChem No E E942 FEMA SMILES InChI Apparence gaz comprime liquefie incolore, d'odeur caracteristique[1]. Propriétés chimiques Formule brute N2O [Isomères] Masse molaire[3] 44,0128 ± 0,0007 g·mol-1
N 63,65 %, O 36,35 %,Moment dipolaire 0,16083 D [2] Propriétés physiques T° fusion -90,8 °C[1] T° ébullition -88,5 °C[1]
Décomposition à 300 °CSolubilité 14 g·l-1
1,12 g·kg-1 d'eau.
Soluble dans H2SO4,
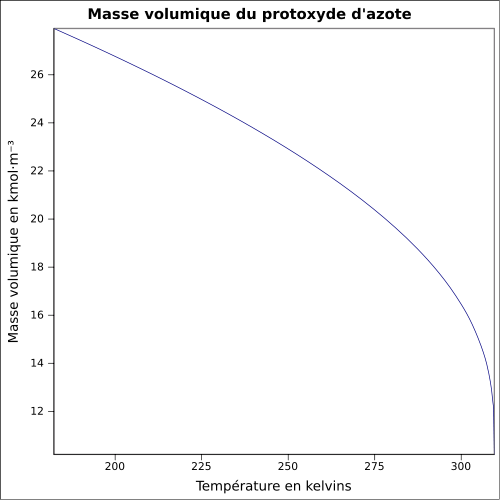
alcool, éther, huiles.Masse volumique 1,23 g·cm-3 (Liquide, -89 °C)[1]
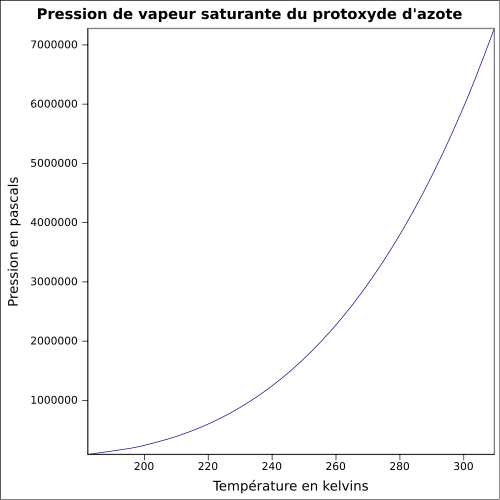
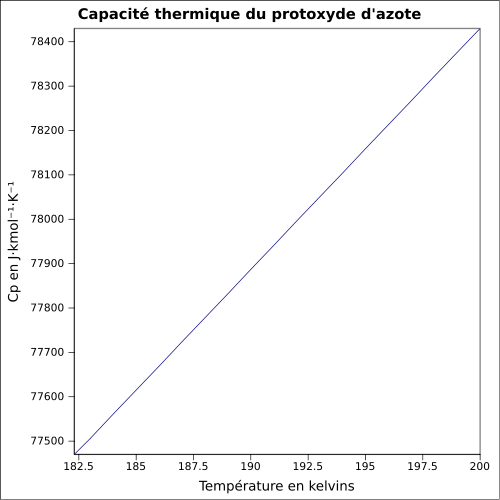
0,0018 (Gaz)Pression de vapeur saturante 51,7 bar à 21 °C Point critique 72,7 bar, 36,55 °C [5] Vitesse du son 263 m·s-1 (0 °C,1 atm)[6] Thermochimie S0gaz, 1 bar 219,96 J⋅mol-1⋅K-1 ΔfH0gaz 82,05 kJ⋅mol-1 ΔvapH° 16,53 kJ·mol-1 (1 atm, -88,48 °C)[7] Cp Propriétés électroniques 1re énergie d'ionisation 12,886 eV (gaz)[8] Précautions Directive 67/548/EEC[9] 
OPhrases R : 8, Phrases S : 9, 17, Transport[9] 25 1070
225 2201 NFPA 704 SIMDUT[10] 


SGH[9] 

DangerInhalation Asphyxiant si inhalé pur Peau Toxique si cryogénique
ou compresséYeux Toxique si cryogénique
ou compresséClasse thérapeutique Anesthésique général, analgésique Données pharmacocinétiques CAM 105 % vol. Métabolisme Nul Considérations thérapeutiques Voie d’administration Inhalatoire Caractère psychotrope Catégorie Hallucinogène Mode de consommation Inhalatoire Autres dénominations Gaz hilarant
Oxyde nitreux
Monoxyde de diazote
Protox, ProtoUnités du SI & CNTP, sauf indication contraire. Le protoxyde d'azote, également appelé oxyde nitreux, hémioxyde d'azote ou encore gaz hilarant, est un composé chimique de formule N2O. C'est un gaz incolore à l'odeur et au goût légèrement sucré. Il est utilisé en chirurgie et en odontologie pour ses propriétés anesthésiques et analgésiques. On l'appelle « gaz hilarant » en raison de son effet euphorisant à l'inhalation, d'où son usage récréatif comme hallucinogène. Il est également utilisé comme comburant pour accroître la puissance des moteurs en compétition automobile, ainsi qu'avec l'acétylène H-C≡C-H pour certains appareils d'analyse (spectrométrie d'absorption atomique[11]).
Il est classifié comme polluant par le protocole de Kyoto. C'est le quatrième plus important gaz à effet de serre à contribuer au réchauffement de la planète après la vapeur d'eau (H2O), le dioxyde de carbone (CO2) et le méthane (CH4). Son potentiel de réchauffement global à 100 ans correspond à 298 fois celui du CO2 [12].
Sommaire
Historique
Il a été découvert en 1776 par Joseph Priestley[13], puis étudié par Humphry Davy qui découvre entre autres ses propriétés euphorisantes. Le protoxyde d'azote est utilisé dès la fin du XVIIIe siècle comme « gaz hilarant » dans les foires. Ses effets anesthésiants ont été découverts en 1844 par le dentiste Horace Wells qui l'expérimenta sur lui-même. Malheureusement, impatient de faire connaitre sa découverte, Wells se lança, sans expérimentation approfondie préalable, dans des démonstrations devant un public médical à Hartford (Connecticut) et à Harvard qui furent des échecs retentissants. Dépité, Wells abandonna définitivement la dentisterie. Il faudra attendre les recherches et démonstrations réussies de William T. Morton avec l'éther (octobre et novembre 1846 à Boston) pour que l'anesthésie soit utilisée par les chirurgiens, ce qui a permis à la chirurgie de faire un bond en avant (la douleur était l'une des deux grandes limites de la chirurgie, avec l'infection). Le Protoxyde d'azote ne fut remis à l'honneur que par un dénommé Colton, montreur de spectacles au gaz hilarant, qui, associé au dentiste J.H. Smith montèrent une clinique à New York puis exportèrent leur procédure en Europe. Le protoxyde d'azote, dont l'utilisation fut grandement améliorée par l'association avec de l’oxygène, remplaça progressivement dans les années 1880 l'utilisation de l’éther et du chloroforme en obstétrique.
Le principal risque, l'asphyxie par manque de dioxygène, a mené à l'élaboration du mélange équimolaire avec du dioxygène (MEOPA). Bien qu'il ait été utilisé régulièrement sous cette forme durant le XXe siècle, il n'a obtenu en France son autorisation de mise sur le marché (AMM) qu'en novembre 2001. Auparavant il a été distribué (en dehors de la classification médicament comme les autres gaz médicaux) dans la majorité des blocs opératoires et a constitué l'un des agents de l'anesthésie générale durant le XXe siècle ; sa faible puissance anesthésique le reléguant au rôle d'adjuvant de médicaments plus puissants, dont il permet de réduire les doses et par là les effets indésirables.
Source
Le sol et les océans sont les principales sources naturelles de ce gaz mais il est également produit par la combustion de matières organiques et de combustibles fossiles, l’industrie... Sa production dans les sols est fortement augmentée par la fertilisation azotée.
En France, l’agriculture contribuerait à hauteur de 76 % aux émissions de N2O provenant essentiellement de la transformation des produits azotés (engrais, fumier, lisier, résidus de récolte) sur les terres agricoles[14].
Utilisation
Usage médical
Le protoxyde d'azote exerce un effet antalgique (apaise la douleur) et potentialise (augmente) l'effet des médicaments anesthésiques administrés en même temps. On l'utilise donc :
- en anesthésie, comme composante courante de l'anesthésie générale combinée, en association avec des anesthésiques injectables (hypnotiques, morphiniques, curares) ou inhalés.
- en médecine d'urgence (réductions de fractures ou luxations), pédiatrie ou en salle d'accouchement, sous forme de mélange équimoléculaire avec du dioxygène (MEOPA).
- pour la pratique de gestes douloureux (MEOPA), en particulier chez l'enfant: veinotomie difficile (prise de sang), myélogramme, ponction lombaire,... Il a ici l'avantage d'induire souvent une amnésie du geste, utile quand celui-ci doit être répété. Pour une efficacité accrue, le protoxyde d'azote est ici associé à la prise préventive d'antalgiques, de type morphinique le plus souvent.
Usage dans les moteurs à combustion interne
Du fait de sa teneur en oxygène plus élevée que l'air, le protoxyde d'azote est parfois utilisé comme appoint ou en substitution à ce dernier dans les moteurs à combustion interne. Il permet d'augmenter la charge comburant/carburant dans le cylindre, de favoriser la combustion, et ainsi d'augmenter fortement la puissance du moteur (de 30% à 100% environ).
L'injection de protoxyde d'azote fut utilisée durant la Seconde Guerre mondiale dans certains avions de combat allemands (dispositif "GM-1"). À cette époque, ce système visait à compenser la diminution du dioxygène de l'air en altitude (gaz prélevé dans l'air, utilisé comme comburant par les moteurs à pistons), ce qui avait comme conséquence de réduire le niveau de comburant dans le moteur par rapport au carburant, et entraînait, ainsi, une baisse de la puissance délivrée par le moteur. L'injection de protoxyde d'azote visait donc à pallier le manque de comburant dans le moteur de manière à permettre à celui-ci de fonctionner à haute altitude avec un rendement identique à un fonctionnement à basse ou moyenne altitude. Le pilote disposait ainsi d'une réserve de puissance qu'il pouvait utiliser jusqu'à l'épuisement de la bonbonne contenant le protoxyde d'azote sous forme liquide, soit une dizaine de minutes.
À l'époque, ces systèmes étaient mal maîtrisés et requéraient une grande précaution d'emploi, surtout sur les très compliqués moteurs allemands. Un pilote souhaitant utiliser le GM-1 devait le faire à une altitude où l'air était déjà raréfié (à partir d'environ 6 000 m d'altitude) et devait réduire les gaz avant de relancer ceux-ci une fois le dispositif mis en route, sous peine de casser le moteur ou, pire, de faire exploser l'avion.Plus tard, et à l'instar des autres procédés de sur-alimentation tels que le compresseur et le turbo, le principe de l'injection de protoxyde d'azote fut repris en compétition automobile, puis par le particulier puisque l'on trouve sur le marché des kits NOS (Nitrous Oxide Systems) que l'on peut adapter sur à peu près n'importe quelle voiture. Bien que ces kits soient très prisés des amateurs de tuning automobile, leur installation sur des véhicules de série reste illégale dans de nombreux pays. L'utilisation en France reste autorisé du moment que la vanne de sécurité(obligatoire) de la bonbonne est verrouillé et qu'il n'en soit pas fait usage lorsque le véhicule équipé circule sur une voie publique; cependant les assurances sont en droit de refuser de prendre en charge de tels véhicules.
Autres usages
Le protoxyde d'azote est utilisé comme gaz propulseur, notamment dans les bonbonnes de crème chantilly ou d'air sec pour les ordinateurs. Son code européen est le E942[15].
Dissous dans l'eau, le protoxyde d'azote a un goût sucré[16].
Il a été utilisé pour la conservation de la viande.
Usage détourné et récréatif
Le protoxyde d'azote peut-être détourné à titre récréatif du fait de ses propriétés psychodysleptiques, il est alors le plus souvent inhalé via des ballons afin d'éviter des gelures, des embolies pulmonaires ou cérébrales lors de la détente du gaz (provenant d'une bombe de gaz dépoussiérant).
Le détournement du protoxyde d'azote est avéré aux États-Unis et au Royaume-Uni depuis le début des années 1980 et en France depuis 1998[13].
Effets et conséquences, toxicité
Les effets de court terme sont rapides et fugaces. Ils commencent de 15 à 30 secondes après l'absorption et se terminent au bout de 2 à 3 minutes.
À forte dose, il devient narcotique et est classé au tableau des stupéfiants, avec comme effets :
- Euphorie, sensation de bien-être et fous rires ;
- Désinhibition ;
- Effet de flottement ;
- Distorsions visuelles et auditives ;
- Sensation d'alourdissement des membres ;
- Modification de la voix, qui devient très grave (exactement l'inverse de l'hélium) ;
- Pertes de mémoire.
Effets de doses importantes à court terme
- Nausées, vomissements ;
- Hypoxie ;
- Vertiges.
- Risques de brûlures irréversibles causées par le froid.
- Hallucination[17]
Effets de doses importantes à long terme
Un usage intense et régulier du protoxyde d'azote peut provoquer :
- une carence en vitamine B12[18], et une réduction du taux de B12 circulante[19] entraînant des troubles neurologiques tels que des tremblements ou des problèmes de coordination des mouvements ;
- une anémie ;
- des atteintes de la moelle osseuse et de la moelle épinière ;
- une dépendance psychologique.
Toxicologie
Les effets d'une exposition chronique à de faibles doses sont mal connus, mais ont été étudiés pour certains métiers exposés (anesthésistes en salles de chirurgie par exemple[20])
À forte dose, il provoque des effets neurologiques (polynévrite avec spasticité) et une anémie macrocytaire, avec réduction du taux de vitamine B12 circulante. Smith, dans une revue des risques sanitaires chez le personnel hospitalier, rappelle qu'il s'agit d'un poison mitotique, qui a été rendu responsable de tumeurs du système lymphoïde et du système réticulo-endothélial chez le personnel intervenant en salle d'opération (avec échanges entre chromatides sœurs selon saras et al. 1992, Eroglu et al.) chez lequel on a décrit diverses atteintes cytogénétiques (problèmes également posés par l'exposition à d'autres anesthésiques)
Le protoxyde d'azote à haute concentration a déjà provoqué des morts par asphyxie dues à un manque d'oxygène. Cependant, il faut rappeler que les mélanges gazeux employés en anesthésie contiennent toujours au moins 21% d'oxygène (jusqu'à 50% dans le cas du MEOPA), ce qui est la proportion d'oxygène dans l'air ambiant. Ces morts sont donc dues à un usage inapproprié et mal contrôlé.
L'usage détourné et prolongé de protoxyde d'azote présente des risques de complications médicales pour le nouveau-né en cas d'usage durant une grossesse[21].
Production et synthèse
Le protoxyde d'azote est préparé par décomposition du nitrate d'ammonium fondu entre 250 °C et 260 °C[22].
Il se forme toujours 1 à 2% de diazote N2 et du monoxyde d'azote NO. Ce dernier est supprimé par passage sur du sulfate de fer(II). Le nitrate d'ammonium utilisé doit être exempt d'ions chlorure Cl- qui catalysent la formation de N2. Cependant, le chauffage de solutions de nitrate d'ammonium dans l'acide nitrique ou dans l'acide sulfurique conduit à du protoxyde d'azote pur même en présence de petites quantités d'ions chlorure.
Réactivité
Le protoxyde d'azote est un gaz peu réactif. A température ambiante, il ne réagit pas avec les dihalogènes (Cl2, Br2 ou I2), ni avec les métaux alcalins (Li, Na, K). Il n'est également pas modifié par l'ozone O3.
Il peut se fixer sur certains cations métalliques en tant que ligand et forme des complexes comme [Ru(NH3)5(N2O)]2+. Il peut aussi oxyder des métaux de transition à basse valence dans les complexes.
A haute température, il se décompose en diazote et dioxygène
il réagit avec les métaux alcalins, avec de nombreux composés organique, et il favorise les combustions.
Notes et références
- OXYDE NITREUX, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Entrée de « Nitrous oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- « Oxyde nitreux » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (fr) La spectrométrie d'absorption atomique.
- IPCC, 2007, AR4, chap. 2, p212
- Denis Richard, Jean-Louis Senon, Marc Valleur, Dictionnaire des drogues et des dépendances, Larousse, 2004 (ISBN 2-03-505431-1)
- Source MIES, 2006
- Parlement européen et Conseil de l'europe, « La directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants. », dans Journal officiel, no L 61, 1995 [résumé, texte intégral (pages consultées le 24/07/2008.)]
- J Cutayar, J-L PEAN Utilisation du protoxyde d'azote (N2O) ou d'un mélange de gaz comportant du protoxyde d'azote comme agent édulcorant de produits agroalimentaires. World Patent WO/2007/090939
- [1]
- Michel Hautefeuille, Dan Véléa, Les drogues de synthèse, Presses Universitaires de France, coll. « Que sais-je ? », 2002 (ISBN 2-13-052059-6)
- Michael A. Miller, Vicky Martinez, Richard McCarthy, Manish M. Patel ; Nitrous oxide “whippit” abuse presenting as clinical B12 deficiency and ataxia ; American Journal of Emergency Medicine - Volume 22, Issue 2 ; Mars 2004 (Voir).
- Toxicologie industrielle et intoxications professionnelles Par Robert R Lauwerys, Vincent Haufroid, Perrine Hoet (Extrait)
- Protoxyde d'azote, brochure éditée et distribuée par l'association spiritek en partenariat avec les villes de Lille et de Tourcoing, la communauté urbaine Lille-Métropole et le conseil général du département Nord.
- Cotton F. A. & Wilkinson G. (1972). Advanced Inorganic Chemistry, a comprehensive text. 3e édition, Interscience Publishers, John Wiley & Sons. p.355.
Voir aussi
Article connexe
- Société Air liquide
Liens externes
- (fr) Fiche renseignement Air liquide
- (fr) [PDF] Fiche internationale de sécurité du protoxyde d'azote sur le site de l'INRS
- (fr) Fiche protoxyde d'azote sur le site de l'ADEME
- (fr) Fiche protoxyde d'azote sur le site de l'INRA
- (en) [PDF] NITROUS OXIDE sur NIOSH Resources
Catégories :- Produit chimique comburant
- Composé de l'azote
- Oxyde
- Gaz inorganique
- Tuning
- Anesthésique
- Hypnotique
- Analgésique
- Métabolisme de l'azote
- Gaz à effet de serre
- Hallucinogène
- Sédatif
- Saveur sucrée
- Rire
- Antagoniste des récepteurs de la NDMA
Wikimedia Foundation. 2010.