- Acide Fort
-
Acide fort
Un acide fort est un acide qui se dissocie totalement dans l'eau.
Sommaire
Définition
Lorsqu'un acide AH est mis en présence d'eau, la réaction suivante a lieu :
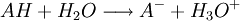
Cette réaction est totale : tous les réactifs sont utilisés lors de la réaction, elle est donc quantitative. Une mole d'acide fort dans l'eau entraîne toujours la libération d'une mole d'ion hydronium. Au cours de cette réaction, l'acide fort se transforme entièrement en sa base conjuguée en cédant un proton. Des molécules d'eau captent ce proton et deviennent des ions hydroniums.
La notion de pKa (potentiel d'acidité dépendant de la capacité d'un acide à libérer son proton) n'est valable que si le solvant utilisé est indiqué, en effet dans un solvant moins polaire par exemple la réaction acide/base n'est pas forcément favorisée et inversement. Dans ce cas, il est possible d'obtenir des pKa négatifs. C'est souvent le cas pour des acides forts dans des solvants organiques. Le pKa permet donc de différencier les acides forts des autres acides. Du fait du nivellement de l'eau, dans le solvant eau tandis que celui d'une base forte est supérieur à 14. le pKa est d'autant plus élevé que l'acide est faible, et vice versa (le pKa est d'autant plus faible que l'acide est fort).
Utilisations des acides forts
Les acides forts sont principalement utilisés pour :
- les dosages acide base
- les hydrolyses
Un des avantages des acides forts est qu'une faible quantité suffit à acidifier une solution. Parfois même quelques gouttes d'acide suffisent. Un acide fort va toujours se dissocier en libérant une grande quantité d'ion hydronium ce qui va avoir pour conséquence de baisser le pH d'une solution. Par définition, plus une solution contient des ions hydroniums, plus elle est acide. Une solution acide va permette de casser certaines liaisons chimiques, ce qui est parfois d'une grande utilité.
Un acide fort réagit rapidement avec une base forte. La réaction est totale et exothermique. Des projections peuvent avoir lieu. Les acides forts sont donc utilisés dans les dosages.
Exemples d'acides forts
Parmi les acides forts, on trouve:
- acide chlorhydrique (HCl),
- l'acide sulfurique (H2SO4)
- l'acide nitrique (HNO3),
- l'acide iodhydrique (HI),
- l'acide bromhydrique (HBr),
- l'acide perchlorique (HClO4).
Ces acides forts ont une réaction totale avec l'eau et vont se transformer totalement en d'autres produits. Les molécules de départ (HCl, HBr, HI, HNO3, HClO4 ,H2SO4) vont totalement disparaitre de la solution de départ en réagissant avec l'eau.
- L'acide chlorhydrique va se transformer entièrement en ions chlorures Cl-
HCl+H2O → Cl-+H3O+
- L'acide bromhydrique va se transformer entierement en ions bromures Br-
HBr+H2O → Br-+H3O+
- L'acide iodhydrique va se transformer entierement en ions iodures I-
HI+H2O → I-+H3O+
- L'acide nitrique va se transformer entierement en ions nitrates NO3-
HNO3 + H2O → NO3- + H3O+
- L'acide perchlorique va se transformer entierement en ions ions perchlorates ClO4-
HClO4 + H2O → ClO4- + H3O+
Les acides de cette liste sont parmi les plus puissants qui existent mais ils sont très rarement utilisés:
- acide fluoroantimonique ((SbF6)−,(H2F)+)
- acide triflique (CF3SO3H)
- acide fluorosulfurique
Sécurité
Les acides forts sont des produits à manipuler avec précautions. Des règles de sécurité sont à respecter lors de leurs utilisations. Les phrases de risque et de prudence sont les suivantes:
R 34 :Provoque des brûlures.
S 26: En cas de contact avec les yeux, laver immédiatement et consulter un ophtalmologiste.
S 45: En cas d’accident ou de malaise consulter immédiatement un médecin et lui montrer l’emballage ou l’étiquette.
S 36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux ou du visage.
La plupart des acides forts sont corrosifs mais ce n'est pas toujours le cas : le carborane est un superacide un million de fois plus acide que l'acide sulfurique mais il est entièrement non corrosif. Par contre l'acide sulfurique est extrêmement corrosif et provoque de graves brûlures.
Voir aussi
- Portail de la chimie
Catégorie : Acide
Wikimedia Foundation. 2010.

