- Nitrate de potassium
-
Nitrate de potassium 

Général Nom IUPAC Nitrate de potassium No CAS No EINECS No E E252 Apparence poudre cristalline incolore à blanche[1].,
ou prismes transparents incoloresPropriétés chimiques Formule brute KNO3 [Isomères] Masse molaire[2] 101,1032 ± 0,0012 g·mol-1
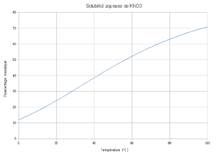
K 38,67 %, N 13,85 %, O 47,47 %,Propriétés physiques T° fusion 333 à 334 °C[1] T° ébullition Se décompose au-dessous du point d'ébullition à 400 °C[1] Solubilité dans l'eau à 25 °C : 357 g·l-1[1],
1,61 g·l-1 dans l'éthanol,
insoluble dans l'alcool absolu,
soluble dans la glycérineMasse volumique 2,1 g·cm-3[1] Thermochimie ΔfH0liquide 9,4 kJ/mol Précautions Directive 67/548/EEC[3] 
OPhrases R : 8, Phrases S : 16, 41, Transport[3] 50 1486 SIMDUT[4] 
Inhalation Peut causer une irritation des voies respiratoires, voire convulsions, tachycardie, dyspnée... Peau Risque moyen Yeux Peut causer une irritation Ingestion Nausées, vomissements et diarrhée autre Très réactif. Écotoxicologie DL50 lapins par ingestion :
1,166g d'anions/kgUnités du SI & CNTP, sauf indication contraire. Le nitrate de potassium, autrefois dit « nitrate de potasse » et avant cela connu depuis le Moyen Âge sous le nom de salpêtre (du latin médiéval salpetrae, littéralement : sel de pierre[5]) ou nitre est un composé inorganique de formule chimique KNO3.
On appelle aussi salpêtre le résultat de la perte de l'eau de cristallisation de ce sel donnant une couche pulvérulente blanchâtre se formant sur les vieux murs humides. On le récolte en grattant des pierres ou des briques situées dans des lieux sombres, comme les caves.
On l'utilisait mélangé à du soufre et à du charbon de bois, pour fabriquer de la poudre à canon.
Sommaire
Construction
Le salpêtre et les sels minéraux cristallisant sur les constructions neuves sont des effets secondaires des remontées d'humidité par capillarité dans les matériaux. Ces dépôts blanchâtres de nitre sont fréquents dans les régions où l'eau est polluée par les nitrates ou naturellement riche en nitrates.
Le salpêtre se présente sous la forme de fibres blanches ayant l'apparence de poils blancs. Dans les caves ou maisons humides anciennes, le salpêtre est l'un des résidus du développement de bactéries qui se nourrissent de l'ammoniac provenant de l'eau du sol et du carbonate de potassium contenu dans les murs. La transformation se termine au contact du dioxygène de l'air pour former le nitrate de potassium ou salpêtre.
On voit souvent ces fibres blanches dans les bâtiments anciens qui ont abrité des animaux ou à proximité d'une ancienne fosse septique, l'ammoniac s'y formant à partir de l'urine. Les sels minéraux se présentent sous forme solide de couleur blanche. Le salpêtre et les sels minéraux sont présents dans toute l'épaisseur des murs anciens humides et concentrés à la surface des matériaux. Ce salpêtre était autrefois récolté dans les caves ou certaines grottes pour la poudre.
Histoire de sa production
Historiquement, le salpêtre était préparé dans un tas de compost (généralement 1,5 mètre de haut par 2 mètres de large par 5 mètres de long) comportant un mélange de fumier, de terre (ou de mortier ou de cendres de bois) et des matières organiques (paille) pour la porosité de l'ensemble. Le tas était généralement protégé de la pluie, maintenu humide avec l'urine, il était retourné souvent pour accélérer la décomposition et les infiltrations d'eau durant un an. Le liquide contenant des nombreux nitrates est ensuite converti en nitrates de potassium avec des cendres de bois, puis cristallisé et raffiné pour une utilisation en poudre. Les personnes chargées de faire le salpêtre sont des salpêtriers.
L'urine a également été utilisée dans la fabrication du salpêtre pour la poudre à canon. Dans ce processus, de l'urine est placée dans un récipient contenant de la paille et laissé à mariner plusieurs mois, après quoi de l'eau est utilisée pour laver les sels chimiques de la paille. Le processus est complété par un filtrage aux cendres de bois, ainsi qu'un séchage au soleil et à l'air libre. Les cristaux de salpêtre peuvent ensuite être collectés et ajoutés à du soufre et du charbon de bois pour créer la poudre noire. Le nitrate de potassium peut aussi être récolté à partir des accumulations de guano de chauve-souris dans les grottes. Il s'agit de la méthode traditionnelle au Laos pour la fabrication de la poudre à canon pour les roquettes Bang Fai.
Le plus ancien procédé de purification de nitrate de potassium est décrit en 1270 par un ingénieur et chimiste Arabe, Hasan al-Rammah de Syrie, dans son ouvrage al-Furusiyya wa al-Manasib al-Harbiyya (« Le Livre de la cavalerie militaire et machines de guerre ingénieuse »), où il a décrit pour la première fois l'utilisation de carbonate de potassium (sous forme de cendres de bois) afin d'éliminer les sels de calcium et de magnésium, du nitrate de potassium impur[5].
Sous le nom de nitre, il pouvait être un ingrédient de remèdes tels que l'opiat antiscorbutique, un des remèdes de la pharmacopée maritime occidentale au XVIIIe siècle [6].
Durant la Révolution française
À la naissance de la République, les frontières sont menacées par les armées coalisées. Une production d'armes est lancée, entre autres, par Gaspard Monge. La production de la Régie des poudres et salpêtres créée par Turgot et Lavoisier le 30 mai 1775 se révèle insuffisante. D'autant plus que les anglais empêchent l'importation de salpêtre. Aussi, le 4 décembre 1793, le Comité de salut public décrète l'extraction révolutionnaire du salpêtre. Chaque district de la République est prié d'envoyer deux jeunes gens plus ou moins instruits à qui l'on donne une formation. Le but étant qu'ils retournent chez eux et forment d'autres personnes à la récolte et à la purification du salpêtre. Parmi les instructeurs, on compte également Berthollet[7],[8].
Production industrielle
Au cours du XIXe siècle et jusqu'à la Première Guerre mondiale, le nitrate de potassium a été produit à une échelle industrielle, d'abord en 1905 par le procédé Birkeland-Eyde. Ce procédé utilise des arcs électriques dans l'air pour produire du monoxyde d'azote. Celui-ci réagit avec l'oxygène puis l'eau pour donner l'acide nitrique. Plus tard il fut remplacé par le procédé Ostwald plus efficace qui produit le monoxyde d'azote par oxydation sur platine de l'ammoniac produit par le procédé Haber. Ce dernier est apparu à l'échelle un peu avant la Première Guerre mondiale et a permis à l'Allemagne d'acquérir ces nitrates vitaux pour la guerre, retardant sans doute sa fin : les dépôts de nitrate naturel se trouvant au Chili alors aux mains des Britanniques. Au XXIe siècle, pratiquement tous les nitrates sont produits avec de l'ammoniac obtenu grâce au procédé Haber.
Dangers
Des explosions accidentelles dues au salpêtre utilisé en poudre explosive (poudre B notamment) ou à d'autres formes de nitrates (engrais, munitions...) sont documentées depuis avant le Moyen Âge, avec quelques exemples marquants, et par ordre chronologique ;
- l'explosion de la poudrière de Delft, qui le 12 octobre 1654 à 10 heures 15 du matin a rasé le centre de la ville de Delft aux Pays-Bas ;
- l'explosion de la poudrière de Grenelle, à Paris en septembre 1794 (durant la Révolution, juste après la Terreur), avec plus de 1000 morts ;
- l'explosion de la poudrière de Lagoubran (magasin à poudre de la Marine nationale, originellement construit entre la Seyne et Toulon dans une zone déserte, réfectionnée en 1884), dans la nuit du 5 mars 1899, produisant un immense nuage de fumée noire et fétide, un bruit perçu selon le Petit Var jusqu’à Barcelonnette ! [9]
- l'explosion du cuirassé Iéna (alors en carénage au bassin de Missiessy) ;
- l'explosion du cuirassé Liberté en novembre 1911.
- l'explosion de la poudrière de Windsor l'après-midi du 16 juillet 1901 (poudrière de la Hamilton Powder Co.) ; elle a fait un mort et un blessé, ainsi que 25 000 $ de dégâts, avec une détonation entendue à 8 et 10 milles à la ronde et un tremblement de terre de plusieurs secondes perçu à de 2 ou 3 milles à la ronde[10].
- l'explosion de Halifax, en décembre 1916, un navire plein de munitions (dont du fulmicoton) explose, détruisant une partie d'Halifax
Utilisations
Comburant
Le nitrate de potassium est très connu comme propergol de fusée en association avec un carbohydrate tel que le sucrose ou le glucose (sucre en poudre) ou bien un polyol tel que le sorbitol (65% de nitrate de potassium et 35% de sorbitol). Mélangés ensemble puis fondus, ils se lient très bien pour former un propergol solide en refroidissant[11].
Fumigène
Caramélisé avec du sucre et du bicarbonate de soude (60 % de salpêtre, 40 % de sucre, une cuillère à soupe de bicarbonate de sodium), le salpêtre constitue un puissant fumigène.
On peut aussi se passer de bicarbonate, le mélange dégage moins de fumée (le bicarbonate agissant comme inhibiteur). En revanche, de grosses flammes peuvent être observées. L'équation bilan de cette transformation est :
8KNO3 + C6H12O6 → 4K2O + 6CO2 + 6H2O + 3O2 ou 6,29 KNO3 + C12H22O11 → 3,67 CO2 + 5,19 CO + 7,91 H2O + 3,09 H2 + 3,14 N2 + 3,14 K2CO3 (ces équations sont fausses car impossibles ou non-équilibrées mais ce sont les seules connues à ce jour)
De manière équilibrée on obtient :8KNO3 + C6H12O6 → 4K2O + 6CO2 + 6H2O + 4O2 + 4N2
Équations équilibrées plus plausibles avec la proportion en poids de 60 40 :avec production de suie :
5.08 KNO3 + C12H22O11 → 2.54 K2CO3 + 2.54 N2 + 11H2O + 7.62 CO + 1.84C avec production d'hydrogène :
5.08 KNO3 + C12H22O11 → 2.54 K2CO3 + 2.54 N2 + 9.16H2O + 9.46 CO + 1.84H2 avec ajout de l'oxygène de l'air :
5.08 KNO3 + C12H22O11 + 5.65O2 → 2.54 K2CO3 + 2.54N 2 + 11H2O + 9.46CO2 La vraie réaction fumigène est probablement un mélange des trois avec en plus production de bicarbonate de potassium avec divers composés de carbone, hydrogène, oxygène.
Autres utilisations
Certains aquariophiles l'utilisent aussi comme source peu onéreuse et précise de nitrate et de potassium pour les plantes d'aquarium.
On retrouve le salpêtre en pharmacie comme diurétique.
Le salpêtre est aussi utilisé dans la conservation de la viande et des charcuteries. C'est l'additif E252. Il réagit et produit du nitrite puis du monoxyde d'azote qui transforment la myoglobine rouge en un colorant rose typique du jambon et des salamis.
Notes et références
- NITRATE DE POTASSIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Entrée de « Potassium nitrate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 3 mars 2010 (JavaScript nécessaire)
- « Nitrate de potassium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Définitions lexicographiques et étymologiques de « salpêtre » du CNRTL.
- Yannick Romieux, De la hune au mortier, Éditions ACL, Nantes, 1986.
- [PDF] Bruno Belhoste, « Gaspard Monge, urgences révolutionnaires et utopies »
- François Pairault, Gaspard Monge, le fondateur de Polytechnique, Tallandier (ISBN 2-235-02271-5)
- explosion de la poudrière de Lagoubran ; et après
- Source : La Presse, 17 juillet 1901, p.1.
- (en) Richard Nakka, Richard Nakka's Experimental Rocketry, 01/05/2007
Voir aussi
Liens internes
- Structure cristalline : Orthorhombique, Aragonite
- Constante diélectrique : 61,1
- Bernard Courtois, qui exploitait une salpêtrière et découvrit l'iode.
- Le salpêtre du Chili n'est pas du nitrate de potassium, mais du nitrate de sodium, qui est mauvais pour la poudre noire car trop hygroscopique. C'était une matière première pour la fabrication de vrai salpêtre.
- Salpêtrière
Lien externe
- La ferme des poudres et salpêtres création et approvisionnement en poudre en France (1664 – 1765) Le chapitre 1 de cet article traite de la récolte et de l'épuration du salpêtre au XVIIe et XVIIIe siècles.