- 7440-66-6
-
Zinc
 Pour les articles homonymes, voir Zinc (homonymie).
Pour les articles homonymes, voir Zinc (homonymie).Le zinc (prononciation /zɛ̃k/ ou /zɛ̃ɡ/) est un élément chimique, de symbole Zn et de numéro atomique 30.
Sommaire
Origine de la découverte
Les Anciens qui connaissaient la calamine (minerai carbonaté de zinc) ne paraissent pas avoir utilisé le zinc en tant que métal isolé, encore que des bracelets de zinc aient été découverts en Grèce, dans les mines de Camaros, ce qui a permis de situer leur fabrication vers le VIIIe siècle av. J.-C.[réf. nécessaire]. La première industrialisation de la production est accomplie par William Champion qui a breveté en 1738 un procédé de réduction de la calamine.
Lexicologie
Le mot persan zangâr : rouille ; vert-de-gris [Azagar, asugar, asingar, zingar, ziniar (vert-gris) ; de ar. al-zanjâ, qui est le persan zangâr, même signification]. C'est l'alchimiste Paracelse qui lui donne ce nom, dérivé du mot Zinke en ancien allemand qui signifie « pointe acérée » ou « dent », lié à l'apparence du zinc refroidi dans un récipient de coulée (effet dû à la formation de dendrites).
La prononciation académique zɛ̃ɡ (« zingu' ») se retrouve dans zincate ( zɛ̃ɡat, « zingat' ») et explique les dérivés zingage, zinguerie, zingueur.
Caractéristiques notables
Le zinc est un métal de couleur bleu-gris, moyennement réactif, qui se combine avec l'oxygène et d'autres non-métaux, et qui réagit avec des acides dilués en dégageant de l'hydrogène.
L'état d'oxydation le plus commun du zinc est +II (appelé ion zincique).
Le zinc peut réagir avec les éléments ambiants : humidité, oxygène, dioxyde de carbone, etc, pour former une patine. Cette patine se traduit par une diminution progressive de l'éclat métallique de la surface. La couche formée, insoluble, adhérente et protectrice, a comme constituant principal du carbonate basique de zinc.
En contact avec de l'eau stagnante, il forme des taches blanchâtres constituées notamment d'hydroxyde et d'oxyde de zinc, produits pulvérulents généralement peu adhérents et non protecteurs, parfois appelés rouille blanche.
Réactions chimiques courantes
Le zinc métal Zn réagit par oxydo-réduction avec l'ion cuivre II, selon l'équation :

Oligo-élément indispensable à l'homme
Article détaillé : Zinc (nutriment).Le zinc est contenu essentiellement dans la viande rouge et il ne semble pas exister de forme de stockage de ce métal dans l'organisme humain. Une carence en zinc est notée dans près d'un tiers de la population mondiale, surtout en rapport avec des problèmes de sous-nutrition[1].
Utilisations
Le dépôt d'une mince couche de zinc en surface de l'acier le protège de la corrosion : la galvanisation consomme 47 % du zinc exploité dans le monde. L'acier galvanisé est utilisé dans l'automobile, la construction, l'électroménager, les équipements industriels, etc. Le laiton – alliage de cuivre et de zinc – et le bronze – alliage de cuivre et d'étain, auquel on ajoute parfois du zinc – consomment 19 % du zinc.
Les alliages de zinc, tel les Zamaks et les Kayems, pour pièces moulées (automobile, équipements ménagers, pièces industrielles...) représentent 14 % de sa consommation, les produits chimiques, 9 %, et les autres applications (dont les plaques et pièces pour toiture), 11 %.
On l'emploie dans les villes pour la couverture des immeubles et, partout, pour les gouttières et les descentes d'eaux pluviales. Il est aussi utilisé en agriculture, comme apport d'oligo-élément, essentiellement en zone de sols fortement calcaires.
La culture la plus sensible à la carence ou insuffisance en zinc est probablement le maïs.
Des symptômes d'insuffisance apparaissent aussi sur la plupart des arbres fruitiers, plus rarement sur la vigne. Les légumes sont moins sensibles, hormis les asperges, les aubergines, les oignons et les pommes de terre.
Les apports, préventifs ou curatifs, se font sur le sol – et il faut alors veiller à la durée de la disponibilité pour les plantes – ou par pulvérisation foliaire.
Pour exemple, les besoins annuels pour le maïs se situent autour de 300 à 500 grammes de zinc par hectare.
Minerais de zinc
 Toiture en zinc à Toruń, Pologne
Toiture en zinc à Toruń, Pologne
Le minerai le plus utilisé est le sulfure de zinc appelé blende ou sphalérite (ZnS). Le mot blende, désormais abandonné dans la littérature minéralogique, provient du mot allemand blenden : « éblouir, tromper ». Ce sulfure — le plus répandu dans la lithosphère — cristallise dans le système cubique. Il peut contenir des impuretés métalliques, telles que celles du fer (blendes foncées) : la marmatite, (Zn,Fe)S, contient jusqu’à 14 % de fer. Dans la nature, la sphalérite est associée à d’autres sulfures, comme la galène (sulfure de plomb : PbS).
La wurtzite a la même composition chimique mais cristallise dans le système hexagonal : c'est le polymorphe de haute température de ZnS.
Sous l’ancien vocable de calamine on trouve la smithsonite (carbonate de zinc : ZnCO3) et l'hémimorphite (silicate de zinc : Zn4Si2O7(OH) 2, H2O). Les deux minéraux peuvent être associés. Si historiquement la calamine fut utilisée au début du développement industriel de ce métal, elle est maintenant peu exploitée.
Autres minéraux plus rares :
- Franklinite : (Zn, Fe,Mn)(Fe, Mn)2O4, spinelle ;
- Willemite : Zn2SiO4, nésosilicate ;
- Zincite : ZnO.
Environ 30 % du zinc mondial provient du recyclage[2].
Production de zinc
La production de zinc à partir de minerai (blende) est effectuée dans deux filières technologiques distinctes :
- la pyrométallurgie ;
- l’hydrométallurgie suivie d’une électrolyse.
Les opérations du procédé pyrométallurgique sont :
- grillage du sulfure de zinc (ZnS) pour obtenir un oxyde de zinc (ZnO) ;
- réduction de l’oxyde pour obtenir du zinc métallique (Zn) ;
- affinage du zinc par liquation et distillation pour supprimer les impuretés comme le plomb ou le fer.
Les opérations du procédé hydrométallurgique sont :
- grillage du sulfure de zinc (ZnS) pour obtenir un oxyde de zinc (ZnO) et supprimer certaines impuretés (fer) ;
- lixiviation pour solubiliser le zinc sous forme de sulfate de zinc (ZnSO4) ;
- cémentation pour éliminer les impuretés : Cobalt, Nickel, Cadmium et Cuivre de la solution de sulfate de zinc ;
- électrolyse pour transformer le sulfate de zinc en zinc métal.
Ces deux procédés sont détaillés dans l’article métallurgie extractive du zinc.
Quelques données économiques
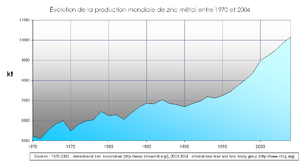
La consommation mondiale de zinc en 2004 a été de l'ordre de 10 millions de tonnes[3] :
- Asie 5 057 kt (kt = milliers de tonnes)
- Europe 2 840 kt
- Amériques 2 113 kt
- Océanie 263 kt
- Afrique 193 kt
- Total 10 466 kt
La production de métal en 2004 s'est répartie de la façon suivante :
- Asie 4 729 kt
- Europe 2 715 kt
- Amériques 1 993 kt
- Océanie 474 kt
- Afrique 256 kt
- Total 10 167 kt
La production minière (en kt de zinc contenu dans le concentré) a été en 2004 de :
- Asie 3 340 kt
- Europe 1 037 kt
- Amériques 3 606 kt
- Océanie 1 298 kt
- Afrique 353 kt
- Total 9 634 kt
Le zinc est un des métaux non ferreux cotés à la bourse des métaux de Londres[4]. Son prix au comptant, exprimé en $, est cyclique : entre 1994 et 2005, il a varié entre 725 $/t et 1 760 $/t. En 2006, il a dépassé les 3 000 $/t.
Expressions
- Dans le langage populaire le zinc désigne le comptoir d'un bar.
- Le zinc est un surnom pour désigner un avion ;
- Le plombier-zingueur désigne un plombier qui est également zingueur ;
- « avoir du zinc dans la tête » : être pénible ;
- Dézinguer : tuer.
Notes et références
- ↑ Lazzerini M, Effect of zinc supplementation on child mortality, Lancet, 2007; 370:1194-1195
- ↑ Le recyclage du zinc
- ↑ International Lead Zinc Study Group
- ↑ London Metal Exchange
Liens externes
- (en) International Zinc Association
- Tableau périodique des éléments : Zn
- Propriétés chimiques
- (en) Images de zinc sous différentes formes
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cp Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Métal de transition | Minéral alimentaire | Écotoxicologie | Couverture (construction)
Wikimedia Foundation. 2010.