- 58-85-5
-
Vitamine B8
Vitamine B8 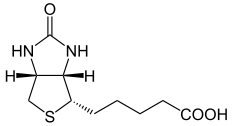
Structure chimique de la biotine ou vitamine B8 Général Nom IUPAC acide 5-[(3aS,4S,6aR)-2-oxohexahydro-1H-thieno[3,4-d]imidazol-4-yl]pentanoïque Synonymes biotine
vitamine H
coenzyme RNo CAS No EINECS Code ATC A11 SMILES InChI Apparence longues aiguilles fines, blanc Propriétés chimiques Formule brute C10H16N2O3S [Isomères] Masse molaire 244,311 g∙mol-1
C 49,16 %, H 6,6 %, N 11,47 %, O 19,65 %, S 13,13 %,Propriétés physiques T° fusion 231 à 233 °C (décomposition) Solubilité 22 mg/100ml (eau, 25 °C),
plus sol. dans l'eau chaude;
80 mg/100ml (alcool 95%, 25 °C);
Insol dans les solvents organiques communs[1]Propriétés optiques Pouvoir rotatoire 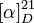 +91° (c = 1 dans NaOH à 0,1N)[1]
+91° (c = 1 dans NaOH à 0,1N)[1]Précautions Directive 67/548/EEC Phrases S : 24/25, Unités du SI & CNTP, sauf indication contraire. La biotine (ou vitamine B8) est une vitamine hydrosoluble aussi connue sous le nom de vitamine H.
La biotine est un coenzyme qui participe au métabolisme des acides gras, des glucides et des acides aminés et à la synthèse des vitamines B9 et B12
On retrouve la biotine, entre autres, dans les céréales complètes, le foie, les œufs et le lait.
Elle est souvent utilisée en biochimie expérimentale du fait de son affinité extrêmement importante pour la streptavidine ainsi que pour l'avidine.
Attention : Parfois la biotine est appelée à tort vitamine B7.
Sommaire
Structure chimique
La biotine est composée entre d'un noyau de 2-imidazolidinone, fusionné à un noyau thiolane, auquel est rattaché un groupe acide propanoïque.
Aperçu général
La biotine est nécessaire à la croissance cellulaire, la production d'acides gras, et le métabolisme des graisses et des acides aminés. Elle joue un rôle dans le cycle de Krebs, qui est le processus biochimique par lequel l'énergie est produite au cours de la respiration aérobie. La biotine participe non seulement à de diverses réactions métaboliques, mais elle aide aussi au transfert du dioxyde de carbone. La biotine est également utile dans le maintien d'un niveau constant de sucre dans le sang. La biotine est souvent recommandée pour renforcer les cheveux et les ongles. En conséquence, c'est un composant de nombreux cosmétiques et produits de santé pour les cheveux et la peau.
La déficience en biotine est extrêmement rare, puisque les bactéries intestinales en produisent généralement plus que les besoins de l'organisme au quotidien. Pour cette raison, les organismes statutaires, dans de nombreux pays (par exemple, le Département australien de la santé et le vieillissement — Australian Department of Health and Aging) ne prescrivent pas d'apport quotidien recommandé.
Sources
Diététique
La biotine est largement présente dans une variété d'aliments, mais le plus souvent à de faibles concentrations. On estime que le régime alimentaire typique des États-Unis fournit environ 40 µg/jour. Il y a seulement deux types d'aliments qui contiennent de grandes quantités de biotine, incluant la gelée royale et de la levure de bière. Les meilleures sources naturelles de biotine dans l'alimentation humaine sont le foie, les légumineuses, le soja, la blette carde, les tomates, la laitue romaine, et les carottes. La liste des aliments comprenant de la biotine comprend les amandes, les œufs, les oignons, le chou, le concombre, le chou-fleur, le lait de chèvre, le lait de vache, les framboises, les fraises, le flétan, l'avoine et les noix. Les plus importantes sources naturelles dans l'alimentation des animaux non-ruminant sont les oléagineux, la luzerne et les levures sèches. La quantité de biotine contenue dans la nourriture varie et peut être influencée par des facteurs tels que les variétés végétales, la saison, et le rendement[2].
aliment part biotine (µg) foie, cuit 85 grammes 27-35 [3] oeuf cuit 1 gros 13-25 [3] levures 1 sachet (7 grammes) 1,4-14 [3] saumon cuit 85 grammes 4-5 [3] avocat 1 entier 2-6 [3] porc cuit 85 grammes 2-4 [3] pain, blé entier 1 tranche 0,02-6 [3] chou-fleur cru 1 tasse 0,2-4 [3] fromage Cheddar 28 grammes 0,4-2 [3] framboises 1 tasse 0,2-2 [3] - Les apports suffisants en éléments nutritifs sont déterminés quand il y a suffisamment de preuves scientifiques pour établir un Apport nutritionnel conseillé. Ces valeurs sont définies comme des objectifs pour les individus pour soutenir un état nutritionnel adéquat.
Apport suffisant recommandé Age Biotine (µg/jour) nourissons 0–6 mois 5 7–12 mois 6 enfants 1–3 ans 8 4–8 ans 12 hommes et femmes 9–13 ans 20 14-18 ans 25 19–70 ans 30 70+ ans 30 Enceinte <18-50 30 Allaitant <18-50 35 Biodisponibilité
Des études sur la biodisponibilité de la biotine ont été menées sur les rats et les poussins. De ces études, il a été conclu que la biodisponibilité de la biotine peut être faible ou variable selon le type d'aliment consommé. En général, la biotine existe dans les aliments sous forme de protéines ou de biocytine[4]. Le protéolyse par protéase est nécessaire avant l'absorption. Ce processus aide la libération de la biotine de la biocytine et protéines. La biotine dans le maïs est facilement disponible, mais la plupart des céréales ont une biodisponibilité en biotine de 20 à 40% [2]. Une possible explication à la grande variabilité de la biodisponibilité de la biotine résiderait dans la facilité qu'un organisme a à briser les liens biotine-protéine des aliments, en clair si celui-ci possède l'enzyme capable de briser ces liens[2].
Facteurs qui influent sur les besoins de biotine
La fréquence du statut marginal de la biotine n'est pas connu, mais l'incidence du faible niveau de biotine chez les alcooliques a été trouvée être beaucoup plus élevée que dans le reste de la population. Aussi, des niveaux relativement faibles de biotine ont été signalés dans l'urine ou le plasma des patients qui ont eu une gastrectomie partielle ou qui ont d'autres causes d'achlorhydrie, brûlés, épileptiques, personnes âgées et les athlètes.[2] La grossesse et l'allaitement peuvent être associés à une demande accrue de biotine. Pendant la grossesse, ce peut-être dû à une possible accélération du catabolisme de la biotine, alors que, dans la lactation, la hausse de la demande n'a pas encore été élucidée. Des études récentes ont montré que la carence marginale de biotine peut être présente lors de la gestation, comme en témoigne l'augmentation de l'excrétion urinaire de l'acide 3-hydroxyisovalerique, la diminution de l'excrétion urinaire de la biotine et bisnorbiotine et une diminution de la concentration plasmatique de la biotine. En outre, le tabagisme peut accélérer encore le catabolisme de la biotine chez les femmes[5].
Utilisations
Problèmes capillaires
Des suppléments en biotine sont souvent recommandés comme moyen naturel pour lutter contre le problème de perte de cheveux à la fois des enfants et des adultes. Les signes et les symptômes de la carence en biotine incluant la perte de cheveux qui progresse dans en gravité par perte des cils et des sourcils des sujets en grave déficience. Certains shampooings disponibles contiennent de la biotine, mais il est douteux qu'ils aient un effet utile, la biotine et n'étant pas absorbée par la peau.
Dermite séborrhéique
Les enfants avec un trouble métabolique héréditaire rare appelée phénylcétonurie (dans lequel l'organisme est incapable de briser l'acide aminé phénylalanine) développent souvent des maladies de la peau comme de l'eczéma et la dermatite séborrhéique dans les endroits de l'organisme autre que le cuir chevelu. Des changements qui se produisent sur la peau des personnes ayant la phénylcétonurie peuvent être associés à un manque d'aptitude à utiliser la biotine. L'augmentation de la biotine alimentaire a été reconnue comme améliorant la dermatite séborrhéique.
Déficience
La carence en biotine est relativement rare et bégnine, et peut être traité avec des suppléments. Cette carence peut être causée par la consommation excessive de blancs d'œufs crus (20 oeufs par jour serait nécessaire pour l'inciter), qui contiennent des niveaux élevés de la protéine avidine, qui se lie fortement avec la biotine. Avidine est dénaturée par la cuisson, alors la biotine reste intacte.
Les symptômes de carence manifeste en biotine incluent la perte de cheveux et une éruption cutanée écailleuse rouge autour des yeux, du nez, de la bouche, et la région génitale. Les symptômes neurologiques chez les adultes comprennent la dépression, la léthargie, des hallucinations, et un engourdissement et des fourmillements des extrémités. L'éruption cutanée caractéristique du visage, avec une répartition inhabituelle de la graisse faciale, a été appelé la "biotin-deficient face" par certains experts. Les personnes ayant des troubles héréditaires de la carence en biotine ont des signes d'altération des fonctions du système immunitaire, y compris une susceptibilité accrue aux infections bactériennes et fongiques[6].
Le déficit en biotinidase n'est pas due à l'insuffisance de biotine, mais plutôt à un déficit en enzymes qui la traitent.
Les signes de carence en Biotine : En général, l'appétit et la croissance sont diminués. Symptômes dermatologiques comprennant la dermatite, alopécie (perte des cheveux) et achromotrichia (absence ou la perte de pigment dans les cheveux.[7]) Perosis (épaississement et raccourcissement des os). Syndrome Fatty Liver and Kidney ( FLKS) et une stéatose hépatique peuvent également se produire[2]. Une anomalie génétique peut également être source de carence en biotine. Holocarboxylase synthétase déficit en est une mutation génétique. Il s'agit d'un grave trouble métabolique. Les manifestations biochimiques et les cliniques sont les suivantes: acidose ketolactique, acidurie organique, hyperammoniémie, une éruption cutanée, des problèmes d'alimentation, hypotonie, des convulsions, un retard du développement, l'alopécie, et le coma. Cette maladie est mortelle, cependant, les manifestation peuventt être annulées par des doses pharmacologiques de biotine (10-100 mg par jour).
Les femmes enceintes ont tendance à avoir un risque élevé de carence en biotine. La recherche montre que près de la moitié des femmes enceintes ont une augmentation anormale de l'acide 3-hydroxyisovaleric qui reflète la réduction du taux de biotine.[6]
Beaucoup d'études ont indiqué que cette éventuelle carence en biotine pendant la grossesse peut entrainer des malformations congénitales telles que la fente labiale. Les souris nourries avec des oeuf séchés pour provoquer une carence en biotine au cours de la gestation a entraîné jusqu'à 100% d'incidence de malnutrition du nourrisson. Les nourrissons et les embryons sont plus sensibles à la carence en biotine. Par conséquent, même légère au niveau de la mère la carence en biotine, qui n'atteint pas l'apparition de signes physiologiques, peut avoir une grave conséquence chez le nourrisson.
Toxicité
Les études chez l'animal ont indiqué quelques effets toxiques, le cas échéant, dus à des doses toxiques de biotine. Cela tend à prouver que les animaux et les humains peuvent tolérer des doses d'au moins un ordre de grandeur supérieur à chacun de leurs besoins nutritionnels. Il n'y a pas de cas d'effets indésirables à recevoir de fortes doses de vitamine, en particulier lorsqu'ils sont utilisés dans le traitement des troubles métaboliques entraînant une dermite séborrhéique chez le nourrisson[8].
Biochimie
La biotine D(+) est un cofacteur responsable pour le transfert du dioxyde de carbone avec plusieurs enzymes carboxylase :
- Acétyl-CoA carboxylase alpha
- Acétyl-CoA carboxylase beta
- Methylcrotonyl-CoA carboxylase
- Propionyl-CoA carboxylase
- Pyruvate carboxylase
L'attachement de la biotine à différents sites chimiques, appelée biotinylation, peut-être utilisé comme une technique de laboratoire pour étudier divers procédés, y compris la localisation des protéines, interactions protéine, la transcription et de réplication de l'ADN. la Biotinidase est connue pour être en mesure de biotinylater des histones[9], mais peu de biotine est naturellement attachée à la chromatine. L'holocarboxylase synthétase est l'enzyme des mammifères qui s'attache de façon covalente à la biotine carboxylases.
La biotine se lie étroitement à la protéine tétramère avidine (ou streptavidine et neutravidine), avec une constante de dissociation Kd de l'ordre de 10-15 moles/L, qui est l'une des plus connue des interactions protéine-ligand, en approchant la liaison de la force covalente[10]. Cela est souvent utilisé dans différentes applications de la biotechnologie. Jusqu'en 2005, des conditions très dures ont été nécessaires pour briser la liaison streptavidine-biotine [11].
Alimentation des ruminants
Les bactéries de la panse synthétisent naturellement de la biotine. La biotine est largement métabolisé dans la panse et l'augmentation de l'apport alimentaire en biotine résulte en des concentrations élevées de biotine dans le sérum et le lait [12]. Des données épidémiologiques suggèrent une relation négative entre les concentrations sériques de la biotine et l'incidence de la boiterie clinique en bovins laitiers. L'alimentation d'environ 20 mg/jour de biotine supplémentaire donne des résultats statistique d'amélioration de la santé du sabot. Actuellement, l'insuffisance de données disponibles à ce stade pour quantifier les besoins en biotine des bovins laitiers.
Références
- ↑ a et b (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman, Susan Budavari, The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals, 13th edition, MERCK & CO INC, 2001 (ISBN 0911910131), 1231
- ↑ a , b , c , d et e (en) Combs, Gerald F. Jr., The Vitamins: Fundamental Aspects in Nutrition and Health, San Diego: Elsevier, Inc, 2008 (ISBN 9780121834937)
- ↑ a , b , c , d , e , f , g , h , i et j Jane Higdon, "Biotin", Micronutrient Information Center, Linus Pauling Institute
- ↑ (en) Gropper S.S., Smith, J.L.,Groff, J.L., Advanced nutrition and human metabolism, Belmont, 2005
- ↑ (en) Present Knowledge in Nutrition, Ninth Edition, Vol 1, Washington, DC: Internation Life Sciences Institute, 2006 (ISBN 9781578811984), « Biotin »
- ↑ a et b (en) Higdon, Jane, An evidence-based approach to vitamins and minerals, Thieme, 2003 (ISBN 9781588901248), « Biotin »
- ↑ biology-online.org
- ↑ (en) Combs, Gerald F. Jr., The Vitamins: Fundamental Aspects in Nutrition and Health, Ithaca: Elsevier Academic Press, 1998 (ISBN 0121834921)pg. 360
- ↑ Hymes, J; Fleischhauer, K; Wolf, B., « Biotinylation of histones by human serum biotinidase: assessment of biotinyl-transferase activity in sera from normal individuals and children with biotinidase deficiency. », dans Biochem Mol Med., vol. 56, no 1, 1995, p. 76–83 [lien PMID lien DOI]
- ↑ Laitinen OH, Hytonen VP, Nordlund HR, Kulomaa MS., « Genetically engineered avidins and streptavidins. », dans Cell Mol Life Sci., vol. 63, no 24, 2006, p. 2992–3017 [lien PMID lien DOI]
- ↑ Holmberg A, Blomstergren A, Nord O et al., « The biotin-streptavidin interaction can be reversibly broken using water at elevated temperatures », dans Electrophoresis, vol. 26, no 3, 2005, p. 501–10 [lien PMID lien DOI]
- ↑ (en) National Research Council, Nutrient Requirements of Dairy Cattle. 7th rev. ed., Natl. Acad. Sci., Washington, DC., 2001 (ISBN 0309069971)
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Biotin ».
- Portail de la chimie
- Portail de la biochimie
- Portail de la médecine
Catégories : Vitamine | Coenzyme | Thiolane | Imidazolidinone | Acide carboxylique
Wikimedia Foundation. 2010.
