- Vitamine B5
-
Acide panthoténique 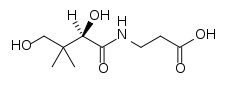
Structure de l'acide panthoténiqueGénéral Nom IUPAC (±)-N-(2,4-dihydroxy-3,3-diméthyl-1-oxobutyl)-β-alanine No CAS D ou R(+)
(racémique)
(Ca)No EINECS
(Ca)SMILES InChI Propriétés chimiques Formule brute C9H17NO5 [Isomères] Masse molaire[1] 219,235 ± 0,0101 g·mol-1
C 49,31 %, H 7,82 %, N 6,39 %, O 36,49 %,Unités du SI & CNTP, sauf indication contraire. La vitamine B5, correspondant à l’acide panthoténique, ou panthénol, est une vitamine hydrosoluble. C'est un précurseur métabolique de la coenzyme A, essentielle à la synthèse et au métabolisme des protéines, des glucides et des lipides.
Sommaire
Occurrence naturelle
La racine du mot pantothénique provient de Pantothen qui, en grec, signifie « partout » : cette vitamine se trouve en effet dans presque tous les aliments. Cependant, on la trouve en proportions particulièrement concentrées dans les germes et céréales complètes et dans les variétés d'ortie piquante. La gelée royale est le produit naturel connu le plus riche qui soit en vitamine B5.
Structure chimique
L'acide pantothénique est constitué d'une molécule d'acide pantoïque et d'une molécule de β-alanine, liées par une liaison amide.
Rôle biologique
Précurseur et constituant du coenzyme A, la vitamine B5 favorise la croissance et la résistance de la peau et des muqueuses. Elle est nécessaire au métabolisme des glucides, lipides et protéines et participe à la synthèse de certaines hormones. L'acide pantothénique est détruit par la chaleur en solution aqueuse.
Les besoins du corps humain sont estimés à 5 mg par jour à partir de 16 ans, à 2 mg chez les nourrissons et à 7 mg pour les allaitantes mais généralement seule une sous-alimentation peut entraîner une réelle carence.
Utilisation
Ses propriétés, hydratantes, sont utilisées en cosmétologie capillaire car la B5 accroît l'élasticité des cheveux et contribue à contrer leur chute. Elle est aussi utilisée pour soigner l'acné, à des doses environ de 4 000 mg par jour.
Voir aussi
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
Wikimedia Foundation. 2010.
