- Éléments chimiques
-
Élément chimique
 Pour les articles homonymes, voir Élément.
Pour les articles homonymes, voir Élément.On définit par élément chimique, ou simplement élément, une catégorie d'atomes ayant en commun le même nombre de protons dans leur noyau atomique, ce nombre, noté Z, définissant le numéro atomique de l'élément. Les propriétés chimiques sont déterminées par la configuration électronique de l'atome, qui dépend directement du numéro atomique.
L'hydrogène, le carbone, l'azote, l'oxygène, sont des éléments chimiques, de même que le fer, le cuivre, l'argent, l'or, etc. Au total, 117 éléments chimiques ont été observés à ce jour, de numéros atomiques allant de 1 à 118 à l'exception de l'élément 117. Parmi ceux-ci, 94 éléments se rencontrent dans le milieu naturel, et 80 éléments ont au moins un isotope stable : tous ceux de numéros atomiques inférieur ou égal à 82 excepté les éléments 43 et 61.
Un élément chimique ne peut pas se transformer en un autre élément par une réaction chimique, seule une réaction nucléaire appelée transmutation peut y parvenir. Cette définition moderne a été formulée en substance pour la première fois par le chimiste français Antoine Lavoisier en 1789[1],[2].
Une substance pure constituée d'atomes du même élément est appelée corps simple, et ne peut pas être décomposée en d'autres éléments distincts, ce qui différencie un corps simple d'un composé chimique. L'oxygène est un élément chimique, mais le gaz appelé couramment oxygène est un corps simple dont le nom exact est dioxygène, de formule O2, pour le distinguer de l'ozone, de formule O3, qui est également un corps simple ; l'ozone et le dioxygène sont des variétés allotropiques de l'élément oxygène. L'état standard d'un élément chimique est celui du corps simple dont l'enthalpie standard de formation est la plus faible aux conditions normales de température et de pression, par convention égale à zéro.
Les éléments chimiques sont communément classés dans une table issue des travaux du chimiste russe Dimitri Mendeleïev et appelée « tableau périodique des éléments » :
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Tableau périodique des éléments chimiques Sommaire
Les éléments
Abondance naturelle
Abondance des dix éléments les plus fréquents dans notre galaxie, estimée par spectroscopie[3] Z Élément Parties par million 1 Hydrogène 739 000 2 Hélium 240 000 8 Oxygène 10 400 6 Carbone 4 600 10 Néon 1 340 26 Fer 1 090 7 Azote 960 14 Silicium 650 12 Magnésium 580 16 Soufre 440 En tout, 117 éléments ont été observés au 1er juillet 2009. « Observé » peut simplement vouloir dire qu'on en a détecté au moins un atome de façon raisonnablement sûre : ainsi, seuls trois atomes de l'élément 118 ont été détectés à ce jour, et ce de façon indirecte à travers les produits de leur chaîne de désintégration. L'UICPA n'a validé que les 112 premiers éléments par numéro atomique croissant[4], dont elle a entériné les noms en anglais ainsi que les symboles chimiques internationaux ; le dernier en date (juin 2009) est l'élément 112, qui devrait s'appeler en français copernicium et avoir pour symbole chimique Cn.
Seuls 94 éléments sont observés sur Terre dans le milieu naturel, parmi lesquels six ne sont présents qu'à l'état de traces — le technétium 43Tc, le prométhéum 61Pm, l'astate 85At, le francium 87Fr, le neptunium 93Np et le plutonium 94Pu. Tous ces éléments ont également été détectés dans l'espace, ainsi peut-être que le californium 98Cf.
Les 22 autres éléments observés qui n'existent ni sur Terre ni dans l'espace ont été produits artificiellement par fusion nucléaire à partir d'autres éléments plus légers.
Selon le modèle standard de la cosmologie, l'abondance relative des isotopes des 95 éléments naturels dans l'univers résulte de quatre phénomènes[5] :
- la nucléosynthèse primordiale pour les quatre premiers éléments : hydrogène, hélium, lithium et béryllium
- la nucléosynthèse stellaire pour les vingt-deux éléments suivants, jusqu'au fer
- la spallation de ces noyaux qui enrichit le milieu interstellaire notamment en lithium et béryllium, détectés en surabondance dans les rayons cosmiques
- la capture neutronique sur ces mêmes noyaux dans les supernovae pour générer tous les éléments au-delà du fer, au cours de processus appelés R ou S selon qu'ils sont rapides ou lents, ainsi que la capture de protons rapides (processus RP) et la photodésintégration (processus P) pour ce qui concerne les noyaux riches en protons (tels que 196Hg).
Numéro atomique
Le numéro atomique d'un élément, noté Z (en référence à l'allemand Ordnungszahl), est égal au nombre de protons contenu dans les noyaux des atomes de cet élément. Par exemple, tous les atomes d'hydrogène ne comptent qu'un seul proton, donc le numéro atomique de l'hydrogène est Z = 1. Si tous les atomes d'un même élément comptent le même nombre de protons, ils peuvent en revanche avoir différents nombres de neutrons : chaque nombre de neutron d'un élément définit un isotope de cet élément.
Les atomes étant électriquement neutres, ils comptent autant d'électrons, chargés négativement, que de protons, chargés positivement, de sorte que le numéro atomique représente également le nombre d'électrons des atomes d'un élément donné. Les propriétés chimiques d'un élément étant déterminées avant tout par sa configuration électronique, on comprend que le numéro atomique est la caractéristique déterminante d'un élément chimique.
Le numéro atomique définit entièrement un élément : connaître le numéro atomique revient à connaître l'élément. C'est pour cela qu'il est généralement omis avec les symboles chimiques, sauf éventuellement pour rappeler la position de l'élément dans le tableau périodique. Lorsqu'il est représenté, il se positionne en bas à gauche du symbole chimique : ZX.
Nombre de masse
Le nombre de masse d'un élément, noté A, est égal au nombre de nucléons (protons et neutrons) contenu dans les noyaux des atomes de cet élément. Si tous les atomes d'un élément donné ont par définition le même nombre de protons, ils peuvent en revanche avoir des nombres différents de neutrons, et donc des nombres de masse différents, ce qu'on appelle des isotopes. Par exemple, l'hydrogène 1H a trois isotopes principaux : le protium 1H (hydrogène courant, dont le noyau à un proton n'a aucun neutron), le deutérium 2H (plus rare, dont le noyau à un proton compte également un neutron), et le tritium 3H (radioactif et présent dans le milieu naturel à l'état de traces, dont le noyau à un proton compte deux neutrons).
Le nombre de masse n'a généralement aucune incidence sur les propriétés chimiques des atomes, car il n'affecte pas leur configuration électronique ; un effet isotopique peut néanmoins être observé pour les atomes légers, c'est-à-dire le lithium 3Li, l'hélium 2He et surtout l'hydrogène 1H, car l'ajout ou le retrait d'un neutron dans le noyau de tels atomes entraîne une variation relative significative de la masse de l'atome, qui affecte la cinétique des réactions chimiques et l'intensité des liaisons chimiques. Pour les 114 autres éléments, en revanche, le nombre de masse n'a pas d'influence sur les propriétés chimiques.
Le nombre de masse n'affectant pas les proprités chimiques, il est généralement omis avec les symboles chimiques, sauf lorsqu'il s'agit de distinguer les isotopes d'un élément donné. Lorsqu'il est représenté, il se positionne en haut à gauche du symbole chimique : AX.
Masse atomique
L'unité de masse atomique a été définie par l'UICPA en 1961 comme étant exactement le douzième de la masse du noyau d'un atome de 12C (carbone 12) :
La masse au repos d'un nucléon n'est en effet pas pertinente pour mesurer la masse des atomes car protons et neutrons n'ont pas exactement la même masse au repos — respectivement 938,272013(23) MeV/c2 et 939,565560(81) MeV/c2 — et surtout cette masse diffère de celle qu'ils ont lorsqu'ils font partie d'un noyau atomique en raison de l'énergie de liaison nucléaire de ces nucléons, qui induit un défaut de masse entre la masse réelle d'un noyau atomique et le cumul des masses au repos des nucléons qui composent ce noyau.
La masse atomique d'un élément est égale au produit scalaire des nombres de masse de ses isotopes par l'abondance naturelle de ces isotopes. Appliqué par exemple au plomb, cela donne :
-
-
Isotope Abondance naturelle A Produit 204Pb 1,4 % × 204 = 2,9 206Pb 24,1 % × 206 = 49,6 207Pb 22,1 % × 207 = 45,7 208Pb 52,4 % × 208 = 109,0 Masse atomique du plomb = 207,2
-
La mole étant définie par le nombre d'atomes contenus dans 12 g de carbone 12 (soit N ≈ 6,02214179 × 1023 atomes), la masse atomique du plomb est donc de 207,2 g/mol, avec un défaut de masse de l'ordre de 7,561676 MeV/c2 par nucléon.
De ce qui précède, on comprend qu'on ne peut définir de masse atomique que pour les éléments dont on connaît la composition isotopique naturelle ; à défaut d'une telle composition isotopique, on retient le nombre de masse de l'isotope connu ayant la période radioactive la plus longue, ce qu'on indique généralement en représentant la masse atomique obtenue entre parenthèses ou entre crochets.
Isotopes
Article connexe : table des isotopes.Isotopes les plus abondants
dans le système solaire[6]Isotope Nucléides
(ppm)1H 705 700 4He 275 200 16O 5 920 12C 3 032 20Ne 1 548 56Fe 1 169 14N 1 105 28Si 653 24Mg 513 32S 396 22Ne 208 26Mg 79 36Ar 77 54Fe 72 25Mg 69 40Ca 60 27Al 58 58Ni 49 13C 37 3He 35 29Si 34 23Na 33 57Fe 28 2H 23 30Si 23 Deux atomes dont le noyau compte le même nombre de protons mais un nombre différent de neutrons sont dits « isotopes » de l'élément chimique défini par le nombre de protons de ces atomes. Parmi les 117 éléments observés, seuls 80 ont au moins un isotope stable (non radioactif) : tous les éléments de numéro atomique inférieur ou égal à 82, c'est-à-dire jusqu'au plomb 82Pb, hormis le technétium 43Tc et le prométhéum 61Pm. Parmi ceux-ci, seuls 14 n'ont qu'un seul isotope stable (par exemple le fluor, constitué exclusivement de l'isotope 19F), les 66 autres en ont au moins deux (par exemple le cuivre, dans les proportions 69 % de 63Cu et 31 % de 65Cu, ou le carbone, dans les proportions 98,9 % de 12C et 1,1 % de 13C). Il existe en tout 256 isotopes stables connus des 80 éléments non radioactifs, ainsi qu'une vingtaine d'isotopes faiblement radioactifs présents dans le milieu naturel (parfois avec une période radioactive tellement grande qu'elle en devient non mesurable), certains éléments ayant à eux seuls plus d'une demi-douzaine d'isotopes stables ; ainsi, l'étain 50Sn en compte pas moins de dix, d'occurrences naturelles fort variables :
-
-
Isotope Abondance naturelle Neutrons 112Sn 0,97 % 62 neutrons 114Sn 0,65 % 64 neutrons 115Sn 0,34 % 65 neutrons 116Sn 14,54 % 66 neutrons 117Sn 7,68 % 67 neutrons 118Sn 24,23 % 68 neutrons 119Sn 8,59 % 69 neutrons 120Sn 32,59 % 70 neutrons 122Sn 4,63 % 72 neutrons 124Sn 5,79 % 74 neutrons
-
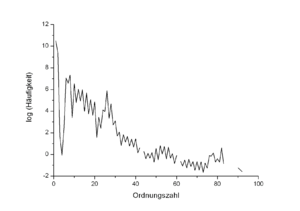
Parmi les 274 isotopes les plus stables connus (comprenant 18 isotopes « quasi-stables » ou très faiblement radioactifs), un peu plus de 60 % (165 nucléides pour être exact) sont constitués d'un nombre pair à la fois de protons (Z) et de neutrons (N), et un peu moins de 1,5 % (seulement quatre nucléides[7]) d'un nombre impair à la fois de protons et de neutrons ; les autres nucléides se répartissent à peu près à parts égales (un peu moins de 20 %) entre Z pair et N impair, et Z impair et N pair. Globalement, 220 nucléides stables (un peu plus de 80 %) ont un nombre pair de protons, et seulement 54 en ont un nombre impair ; c'est un élément sous-jacent à l'effet d'Oddo-Harkins, relatif au fait que, pour Z > 4 (c'est-à-dire à l'exception des éléments issus de la nucléosynthèse primordiale), les éléments de numéro atomique pair sont plus abondants dans l'univers que ceux dont Z est impair. Cet effet se manifeste notamment dans la forme en dents de scie des courbes d'abondance des éléments par numéro atomique croissant :
Isotones
Deux atomes qui ont le même nombre de neutrons mais un nombre différent de protons sont dits isotones. Il s'agit en quelque sorte de la notion réciproque de celle d'isotope.
C'est par exemple le cas des nucléides stables 36S, 37Cl, 38Ar, 39K et 40Ca, situés sur l'isotone 20 : ils comptent tous 20 neutrons, mais respectivement 16, 17, 18, 19 et 20 protons ; les isotones 19 et 21, quant à eux, ne comptent aucun isotope stable.
Radioactivité
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Pb Un isotope au moins de cet élément est stable Cm Un isotope a une période d'au moins 4 millions d'années Cf Un isotope a une période d'au moins 800 ans Md Un isotope a une période d'au moins 1 journée Mt Un isotope a une période d'au moins 1 minute Uuo Aucun isotope connu n'a de période dépassant 1 minute 80 des 117 éléments du tableau périodique standard possèdent au moins un isotope stable : ce sont tous les éléments de numéro atomique compris entre 1 (hydrogène) et 82 (plomb) excepté le technétium 43Tc et le prométhéum 61Pm, qui sont radioactifs.
Dès le bismuth 83Bi, tous les isotopes des éléments connus sont (au moins très faiblement) radioactifs — l'isotope 209Bi a ainsi une période radioactive valant un milliard de fois l'âge de l'univers. Lorsque la période dépasse quatre millions d'année, la radioacivité produite par ces isotopes est négligeable et ne constitue pas de risque sanitaire : c'est par exemple le cas de l'uranium 238, dont la période est de près de 4,5 milliards d'années.
Au-delà de Z = 110 (darmstadtium 281Ds), tous les isotopes des éléments ont une période radioactive de moins de 30 secondes, et de moins d'un dixième de seconde à partir de l'élément 115 (ununpentium 288Uup).
Le modèle en couches de la structure nucléaire permet de rendre compte de la plus ou moins grande stabilité des noyaux atomiques en fonction de leur composition en nucléons (protons et neutrons). En particulier, des « nombres magiques » de nucléons, conférant une stabilté particulière aux atomes qui en sont composés, ont été observés expérimentalement, et expliqués par ce modèle[8]. Le plomb 208, qui est le plus lourd des noyaux stables existants, est ainsi composé du nombre magique de 82 protons et du nombre magique de 126 neutrons.
Certaines théories[9] extrapolent ces résultats en prédisant l'existence d'un îlot de stabilité parmi les nucléides superlourds, pour un « nombre magique » de 184 neutrons et — selon les théories et les modèles — 114, 120, 122 ou 126 protons.
Une approche plus moderne de la stabilité nucléaire montre toutefois, par des calculs fondés sur l'effet tunnel, que, si de tels noyaux superlourds doublement magiques seraient probablement stables du point de vue de la fission spontanée, ils devraient cependant subir des désintégrations α avec une période radioactive de quelques microsecondes[10],[11],[12] ; un îlot de relative stabilité pourrait néanmoins exister autour du darmstadtium 293, correspondant aux nucléides définis par Z compris entre 104 et 116 et N compris entre 176 et 186 : ces éléments pourraient avoir des isotopes présentant des périodes radioactives atteignant quelques minutes.
Isomères nucléaires
Exemple d'isomérie : le tantale 179 Isomère Énergie d'excitation Période Spin 179Ta 0,0 keV 1,82 an 7/2+ 179m1Ta 30,7 keV 1,42 µs 9/2- 179m2Ta 520,2 keV 335 ns 1/2+ 179m3Ta 1 252,6 keV 322 ns 21/2- 179m4Ta 1 317,3 keV 9,0 ms 25/2+ 179m5Ta 1 327,9 keV 1,6 µs 23/2- 179m6Ta 2 639,3 keV 54,1 ms 37/2+ Un même noyau atomique peut parfois exister dans plusieurs états énergétiques distincts caractérisés chacun par un spin et une énergie d'excitation particuliers. L'état correspondant au niveau d'énergie le plus bas est appelé état fondamental : c'est celui dans lequel on trouve naturellement tous les nucléides. Les états d'énergie plus élevée, s'ils existent, sont appelés isomères nucléaires de l'isotope considéré ; ils sont généralement très instables et résultent la plupart du temps d'une désintégration radioactive.
On note les isomères nucléaires en adjoignant la lettre « m » — pour « métastable » — à l'isotope considéré : ainsi l'aluminium 26, dont le noyau a un spin 5+ et est radioactif avec une période de 717 000 ans, possède un isomère, noté 26mAl, caractérisé par un spin 0+, une énergie d'excitation de 6 345,2 keV et une période de 6,35 secondes.
S'il existe plusieurs niveaux d'excitation pour cet isotope, on note chacun d'eux en faisant suivre la lettre « m » par un numéro d'ordre, ainsi les isomères du tantale 179 présentés dans le tableau ci-contre.
Un isomère nucléaire retombe à son état fondamental en subissant une transition isomérique, qui se traduit par l'émission de photons énergétiques, rayons X ou rayons γ, correspondant à l'énergie d'excitation.
Isomères nucléaires d'intérêt particulier
Certains isomères nucléaires sont particulièrement remarquables :
- Le technétium 99m est très utilisé en médecine pour son émission de photons de 141 keV correspondant aux rayons X employés usuellement en radiologie.
- Le hafnium 178m2 est à la fois très énergétique et plutôt stable, avec une période de 31 ans ; selon certains scientifiques,[13] sa transition isomérique vers l'état fondamental pourrait être déclenchée par un rayonnement X incident (phénomène d'émission gamma induite), ce qui ouvrirait la voie à l'accumulation à très haute densité d'énergie, ainsi qu'à la réalisation d'armes de destruction massive compactes de nouvelle génération.
- Le tantale 180m1 a la particularité d'être stable sur au moins 1015 ans (près de 75 000 fois l'âge de l'univers), ce qui est d'autant plus remarquable que l'état fondamental de l'isotope 180Ta est, au contraire, très instable : le 180mTa est le seul isomère nucléaire présent dans le milieu naturel ; le mécanisme de sa formation dans les supernovae est d'ailleurs mal compris.
- Le thorium 229m est peut-être l'isomère connu ayant la plus faible énergie d'excitation, à peine quelques électron-volts : cette énergie est si faible qu'elle est difficilement mesurable, l'estimation la plus récente la situant vers 7,6 ± 0,5 eV,[14] tandis qu'un consensus plus ancien la plaçait vers 3,5 ± 1,0 eV.[15] Cela correspond à des photons dans l'ultraviolet, et, s'il était possible d'exciter l'isotope 229Th avec un laser ultraviolet de longueur d'onde adéquate, cela rendrait possible la réalisation de batteries à haute densité d'énergie, voire peut-être d'horloges atomiques de précision.
- L'américium 242m est, comme le tantale 180m1, plus stable que son état fondamental ; sa masse critique de quelques kilogrammes en ferait un possible combustible nucléaire pour des applications spatiales de propulsion par fragments de fission.
Allotropes
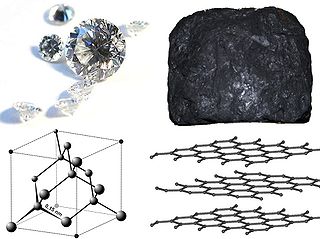
Article principal : allotropie.Un même élément chimique peut former plusieurs corps simples différant seulement les uns des autres par l'agencement des atomes dans les molécules ou les structures cristallines qui les définissent. Le carbone existe ainsi sous forme graphite à système cristallin hexagonal, sous forme diamant à structure tétraédrique, sous forme graphène qui correspond à un unique feuillet hexagonal de graphite, ou encore sous formes fullerène ou nanotube de carbone qui peuvent être vues comme des feuillets de graphène respectivement sphériques et tubulaires. Ces différentes formes de carbone sont appelées allotropes de cet élément. De la même façon, l'ozone O3 et le dioxygène O2 sont des allotropes de l'élément oxygène.
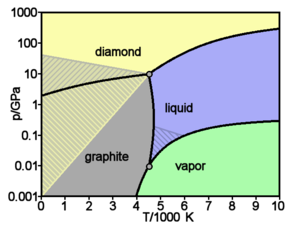
Chaque allotrope d'un élément ne peut exister que dans une gamme de températures et de pressions définies, ce qu'on représente par un diagramme de phases. Ainsi, le carbone ne cristallise sous forme diamant qu'en étant soumis à de hautes pressions, le diamant demeurant stable jusqu'à pression ambiante ; lorsqu'il cristallise à pression ambiante, le carbone donne néanmoins du graphite, et non du diamant.
État standard
Parmi toutes les variétés allotropiques d'un élément pouvant exister aux conditions normales de température et de pression, l'état standard est, par définition, celle dont l'enthalpie standard de formation est la plus faible, par convention définie comme nulle. Celui du carbone est le graphite, et celui de l'oxygène est le dioxygène, appelé pour cette raison communément oxygène en le confondant avec l'élément dont il est l'état standard.
Nomenclature et classification
Article principal : tableau périodique des éléments.L'Union internationale de chimie pure et appliquée (UICPA, souvent désignée sous son sigle anglophone IUPAC) est l'instance chargée notamment de normaliser la nomenclature internationale des éléments chimiques et de leurs symboles. Cela permet de s'affranchir des querelles de nommage des éléments, qu'il s'agisse des querelles passées (par exemple au sujet du lutécium, que les Allemands ont appelé cassiopeium jusqu'en 1949 suite à une querelle de paternité entre un Français et un Autrichien quant à la première purification de l'élément) ou présentes (notamment au sujet de l'élément 118, synthétisé conjointement par deux équipes, russe et américaine, qui s'opposent sur le nom à donner à cet élément) :
- Le nom des 112 éléments reconnus par l'UICPA est à présent fixé, et le symbole chimique de ces éléments est unifié dans le monde entier.
- Les cinq autres éléments observés, ainsi que tous les autres éléments chimiques à ce jour encore inobservés, ont reçu une dénomination systématique fondée sur leur numéro atomique qui leur tient lieu de nom en attendant que leur observation soit validée par l'UICPA. L'élément 118 est ainsi appelé ununoctium en attendant que les choses s'éclaircissent à son sujet.
L'élément 112 est le dernier en date a avoir été reconnu par l'UICPA, en juin 2009. Il avait été synthétisé pour la première fois à la fin du 20ème siècle par une équipe du GSI (le Centre de recherche sur les ions lourds basé à Darmstadt, en Allemagne), qui a proposé de l'appeler copernicium, avec le symbole chimique Cn ; l'UICPA a six mois pour valider cette proposition.
Le tableau périodique des éléments est universellement utilisé pour classer les éléments chimiques de telle sorte que leurs propriétés soient largement prédictibles en fonction de leur position dans ce tableau. Issue des travaux du chimiste russe Dmitri Mendeleïev et de son contemporain allemand méconnu Julius Lothar Meyer, cette classification est dite périodique car organisée en périodes successives au long desquelles les propriétés chimiques des éléments, rangés par numéro atomique croissant, se succèdent dans un ordre identique.
Ce tableau fonctionne parfaitement jusqu'aux deux tiers de la septième période, ce qui englobe les 95 éléments détectés naturellement sur Terre ou dans l'espace ; au-delà de la série des actinides (éléments qu'on appelle les transactinides), des effets relativistes, négligeables jusqu'alors, deviennent significatifs et modifient sensiblement la configuration électronique des atomes, ce qui altère très nettement la périodicité des propriétés chimiques aux confins du tableau.
Symboles chimiques
Le chimiste suédois Jöns Jacob Berzelius (1779-1848) est à l'origine des symboles chimiques que nous utilisons, en définissant un système typographique fondé sur l'alphabet latin sans aucun signe diacritique : une lettre majuscule, parfois suivie d'une lettre minuscule, sans point marquant normalement une abréviation, dans une démarche universaliste qui a conduit à l'adoption de symboles issus du néolatin de l'époque moderne, par exemple :
- Ag < Argentum = Argent
- Au < Aurum = Or
- C < Carbonium = Carbone
- Cl < Chlorum = Chlore
- Cu < Cuprum = Cuivre
- Fe < Ferrum = Fer
- Hg < Hydrargyrum = Mercure
- K < Kalium = Potassium
- N < Nitrogenum = Azote
- Na < Natrium = Sodium
- O < Oxygenium = Oxygène
- P < Phosphorus = Phosphore
- Pb < Plumbum = Plomb
- S < Sulphur = Soufre
- Sb < Stibium = Antimoine
- Sn < Stannum = Étain
- etc.
Tous les symboles chimiques ont une validité internationale quels que soient les systèmes d'écriture en vigueur, à la différence des noms des éléments qui doivent être traduits.
Liste des éléments chimiques avec leur symbole
La liste ci-dessous classe les éléments chimiques par numéro atomique croissant.
Cette liste peut être triée par n'importe quelle colonne en cliquant sur l'icône
 de la colonne correspondante.
de la colonne correspondante.Z Élément Symbole Série chimique Masse atomique
(g/mol)Abondance naturelle
dans
l'écorce terrestre[16]
(µg/kg)Isotopes naturels, classés par abondance décroissante
(Les isotopes radioactifs sont marqués d'un astérisque)1 Hydrogène H Non-métal 1,00794(7)[17],[18],[19] 1 400 000 1H, 2H 2 Hélium He Gaz rare 4,002602(2)[17],[19] 8 4He, 3He 3 Lithium Li Métal alcalin 6,941(2)[17],[18],[19],[20] 20 000 7Li, 6Li 4 Béryllium Be Métal alcalino-terreux 9,012182(3) 2 800 9Be 5 Bore B Métalloïde 10,811(7)[17],[18],[19] 10 000 11B, 10B 6 Carbone C Non-métal 12,0107(8)[17],[19] 200 000 12C, 13C 7 Azote N Non-métal 14,0067(2)[17],[19] 19 000 14N, 15N 8 Oxygène O Non-métal 15,9994(3)[17],[19] 461 000 000 16O, 18O, 17O 9 Fluor F Halogène 18,9984032(5) 585 000 19F 10 Néon Ne Gaz rare 20,1797(6)[17],[18] 5 20Ne, 22Ne, 21Ne 11 Sodium Na Métal alcalin 22,98976928(2) 23 600 000 23Na 12 Magnésium Mg Métal alcalino-terreux 24,3050(6) 23 300 000 24Mg, 26Mg, 25Mg 13 Aluminium Al Métal pauvre 26,9815386(8) 82 300 000 27Al 14 Silicium Si Métalloïde 28,0855(3)[19] 282 000 000 28Si, 29Si, 30Si 15 Phosphore P Non-métal 30,973762(2) 1 050 000 31P 16 Soufre S Non-métal 32,065(5)[17],[19] 350 000 32S, 34S, 33S, 36S 17 Chlore Cl Halogène 35,453(2)[17],[18],[19] 145 000 35Cl, 37Cl 18 Argon Ar Gaz rare 39,948(1)[17],[19] 3 500 40Ar, 36Ar, 38Ar 19 Potassium K Métal alcalin 39,0983(1) 20 900 000 39K, 41K, 40K* 20 Calcium Ca Métal alcalino-terreux 40,078(4)[17] 41 500 000 40Ca, 44Ca, 42Ca, 48Ca*, 43Ca, 46Ca 21 Scandium Sc Métal de transition 44,955912(6) 22 000 45Sc 22 Titane Ti Métal de transition 47,867(1) 5 650 000 48Ti, 46Ti, 47Ti, 49Ti, 50Ti 23 Vanadium V Métal de transition 50,9415(1) 120 000 51V, 50V* 24 Chrome Cr Métal de transition 51,9961(6) 102 000 52Cr, 53Cr, 50Cr, 54Cr 25 Manganèse Mn Métal de transition 54,938045(5) 950 000 55Mn 26 Fer Fe Métal de transition 55,845(2) 56 300 000 56Fe, 54Fe, 57Fe, 58Fe 27 Cobalt Co Métal de transition 58,933195(5) 25 000 59Co 28 Nickel Ni Métal de transition 58,6934(4) 84 000 58Ni, 60Ni, 62Ni, 61Ni, 64Ni 29 Cuivre Cu Métal de transition 63,546(3)[19] 60 000 63Cu, 65Cu 30 Zinc Zn Métal de transition 65,38(2) 70 000 64Zn, 66Zn, 68Zn, 67Zn, 70Zn 31 Gallium Ga Métal pauvre 69,723(1) 19 000 69Ga, 71Ga 32 Germanium Ge Métalloïde 72,64(1) 1 500 74Ge, 72Ge, 70Ge, 73Ge, 76Ge 33 Arsenic As Métalloïde 74,92160(2) 1 800 75As 34 Sélénium Se Non-métal 78,96(3)[19] 50 80Se, 78Se, 76Se, 82Se, 77Se, 74Se 35 Brome Br Halogène 79,904(1) 2 400 79Br, 81Br 36 Krypton Kr Gaz rare 83,798(2)[17][18] 0,1 84Kr, 86Kr, 82Kr, 83Kr, 80Kr, 78Kr 37 Rubidium Rb Métal alcalin 85,4678(3)[17] 90 000 85Rb, 87Rb* 38 Strontium Sr Métal alcalino-terreux 87,62(1)[17],[19] 370 000 88Sr, 86Sr, 87Sr, 84Sr 39 Yttrium Y Métal de transition 88,90585(2) 33 000 89Y 40 Zirconium Zr Métal de transition 91,224(2)[17] 165 000 90Zr, 94Zr*, 92Zr, 91Zr, 96Zr* 41 Niobium Nb Métal de transition 92,90638(2) 20 000 93Nb 42 Molybdène Mo Métal de transition 95,96(2)[17] 1 200 98Mo, 96Mo, 95Mo, 92Mo, 100Mo*, 97Mo, 94Mo 43 Technétium Tc Métal de transition [98,9063][21] Traces 99Tc*, 99mTc* 44 Ruthénium Ru Métal de transition 101,07(2)[17] 1 102Ru, 104Ru, 101Ru, 99Ru, 100Ru, 96Ru, 98Ru 45 Rhodium Rh Métal de transition 102,90550(2) 1 103Rh 46 Palladium Pd Métal de transition 106,42(1)[17] 15 106Pd, 108Pd, 105Pd, 110Pd, 104Pd, 102Pd 47 Argent Ag Métal de transition 107,8682(2)[17] 75 107Ag, 109Ag 48 Cadmium Cd Métal de transition 112,411(8)[17] 150 114Cd, 112Cd, 111Cd, 110Cd, 113Cd*, 116Cd*, 106Cd, 108Cd 49 Indium In Métal pauvre 114,818(3) 250 115In*, 113In 50 Étain Sn Métal pauvre 118,710(7)[17] 2 300 120Sn, 118Sn, 116Sn, 119Sn, 117Sn, 124Sn, 122Sn, 112Sn, 114Sn, 115Sn 51 Antimoine Sb Métalloïde 121,760(1)[17] 200 121Sb, 123Sb 52 Tellure Te Métalloïde 127,60(3)[17] 1 130Te*, 128Te*, 126Te, 125Te, 124Te, 122Te, 123Te, 120Te 53 Iode I Halogène 126,90447(3) 450 127I 54 Xénon Xe Gaz rare 131,293(6)[17],[18] 0,03 132Xe, 129Xe, 131Xe, 134Xe, 136Xe, 130Xe, 128Xe, 124Xe, 126Xe 55 Césium Cs Métal alcalin 132,9054519(2) 3 000 133Cs 56 Baryum Ba Métal alcalino-terreux 137,327(7) 425 000 138Ba, 137Ba, 136Ba, 135Ba, 134Ba, 130Ba, 132Ba 57 Lanthane La Lanthanide 138,90547(7)[17] 39 000 139La, 138La* 58 Cérium Ce Lanthanide 140,116(1)[17] 66 500 140Ce, 142Ce, 138Ce, 136Ce 59 Praséodyme Pr Lanthanide 140,90765(2) 9 200 141Pr 60 Néodyme Nd Lanthanide 144,242(3)[17] 41 500 142Nd, 144Nd*, 146Nd, 143Nd, 145Nd, 148Nd, 150Nd* 61 Prométhéum Pm Lanthanide [146,9151][21] Traces 145Pm* 62 Samarium Sm Lanthanide 150,36(2)[17] 7 050 152Sm, 154Sm, 147Sm*, 149Sm, 148Sm*, 150Sm, 144Sm 63 Europium Eu Lanthanide 151,964(1)[17] 2 000 153Eu, 151Eu* 64 Gadolinium Gd Lanthanide 157,25(3)[17] 6 200 158Gd, 160Gd, 156Gd, 157Gd, 155Gd, 154Gd, 152Gd* 65 Terbium Tb Lanthanide 158,92535(2) 1 200 159Tb 66 Dysprosium Dy Lanthanide 162,500(1)[17] 5 200 164Dy, 162Dy, 163Dy, 161Dy, 160Dy, 158Dy, 156Dy 67 Holmium Ho Lanthanide 164,93032(2) 1 300 165Ho 68 Erbium Er Lanthanide 167,259(3)[17] 3 500 166Er, 168Er, 167Er, 170Er, 164Er, 162Er 69 Thulium Tm Lanthanide 168,93421(2) 520 169Tm 70 Ytterbium Yb Lanthanide 173,054(5)[17] 3 200 174Yb, 172Yb, 173Yb, 171Yb, 176Yb, 170Yb, 168Yb 71 Lutécium Lu Lanthanide 174,9668(1)[17] 800 175Lu, 176Lu* 72 Hafnium Hf Métal de transition 178,49(2) 3 000 180Hf, 178Hf, 177Hf, 179Hf, 176Hf, 174Hf* 73 Tantale Ta Métal de transition 180,9479(1) 2 000 181Ta, 180m1Ta 74 Tungstène W Métal de transition 183,84(1) 1 250 184W, 186W, 182W, 183W, 180W* 75 Rhénium Re Métal de transition 186,207(1) 0,7 187Re*, 185Re 76 Osmium Os Métal de transition 190,23(3)[17] 1,5 192Os, 190Os, 189Os, 188Os, 187Os, 186Os*, 184Os 77 Iridium Ir Métal de transition 192,217(3) 1 193Ir, 191Ir 78 Platine Pt Métal de transition 195,084(9) 5 195Pt, 194Pt, 196Pt, 198Pt, 192Pt, 190Pt* 79 Or Au Métal de transition 196,966569(4) 4 197Au 80 Mercure Hg Métal de transition 200,59(2) 85 202Hg, 200Hg, 199Hg, 201Hg, 198Hg, 204Hg, 196Hg 81 Thallium Tl Métal pauvre 204.3833(2) 850 205Tl, 203Tl 82 Plomb Pb Métal pauvre 207,2(1)[17],[19] 14 000 208Pb, 206Pb, 207Pb, 204Pb 83 Bismuth Bi Métal pauvre 208,98040(1) 8,5 209Bi* 84 Polonium Po Métalloïde [208,9824][21] 200×10−9 209Po* 85 Astate At Halogène [209,9871][21] Traces 210At* 86 Radon Rn Gaz rare [222,0176][21] 400×10−12 222Rn* 87 Francium Fr Métal alcalin [223,0197][21] Traces 223Fr*, 221Fr* 88 Radium Ra Métal alcalino-terreux [226,0254][21] 900×10−6 226Ra* 89 Actinium Ac Actinide [227,0278][21] 550×10−9 227Ac* 90 Thorium Th Actinide 232,03806(2)[17],[21] 9 600 232Th* 91 Protactinium Pa Actinide 231,03588(2)[21] 1,4×10−3 231Pa* 92 Uranium U Actinide 238,02891(3)[17],[18],[21] 2 700 238U*, 235U*, 234U* 93 Neptunium Np Actinide [237,0482][21] Traces 237Np* 94 Plutonium Pu Actinide [244,0642][21] Traces 244Pu* 95 Américium Am Actinide [243,0614][21] — — 96 Curium Cm Actinide [247,0704][21] — — 97 Berkélium Bk Actinide [247,0703][21] — — 98 Californium Cf Actinide [251,0796][21] — — 99 Einsteinium Es Actinide [252,0829][21] — — 100 Fermium Fm Actinide [257,0951][21] — — 101 Mendélévium Md Actinide [258,0986][21] — — 102 Nobélium No Actinide [259,1009][21] — — 103 Lawrencium Lr Actinide [264][21] — — 104 Rutherfordium Rf Métal de transition [265][21] — — 105 Dubnium Db Métal de transition [268][21] — — 106 Seaborgium Sg Métal de transition [272][21] — — 107 Bohrium Bh Métal de transition [273][21] — — 108 Hassium Hs Métal de transition [276][21] — — 109 Meitnerium Mt Métal de transition [279][21] — — 110 Darmstadtium Ds Métal de transition [278][21] — — 111 Roentgenium Rg Métal de transition [283][21] — — 112 Copernicium Cn Métal de transition [285][21] — — 113 Ununtrium Uut Métal pauvre ? [287][21] — — 114 Ununquadium Uuq Métal pauvre ? [289][21] — — 115 Ununpentium Uup Métal pauvre ? [291][21] — — 116 Ununhexium Uuh Métal pauvre ? [293][21] — — 117 Ununseptium Uus Halogène ? [295] ?[22] — — 118 Ununoctium Uuo Gaz rare ? [294][21] — — Notes et références
- ↑ Traité élémentaire de chimie, p. 101.
- ↑ Le physicien et chimiste irlandais Robert Boyle, souvent présenté comme l'auteur du concept d'élément chimique, pratiquait en fait l'alchimie et recherchait le moyen de procéder à la transmutation des métaux entre eux. C'est davantage dans le domaine de l'atomisme qu'il a été précurseur, avec ses travaux fondateurs sur la physique des gaz et l'énoncé de la loi de Mariotte.
- ↑ (en) Ken Croswell, Alchemy of the Heavens, Anchor, février 1996 (ISBN 0-385-47214-5)
- ↑ Tableau périodique standard de l'UICPA du 22/06/2007 : l'élément 112 n'y figure pas encore car il n'a été reconnu qu'en juin 2009.
- ↑ (en) Abondance des éléments dans l'espace et nucléosynthèse
- ↑ (en) David Arnett, Supernovae and Nucleosynthesis, Princeton University Press, Princeton, New Jersey, 1996 (ISBN 0-691-01147-8) (OCLC 33162440)
- ↑ Ce sont : 2H, Li, B, et N ; il y en a de facto un cinquième avec le 180m1Ta, qui devrait théoriquement connaître une désintégration β en 180W ainsi qu'une capture électronique en 180Hf, mais aucune radioactivité de cette nature n'a jamais été observée, de sorte que cet élément, théoriquement instable, est considéré comme stable.
- ↑ Nuclear Shell Model : Table 1 – Nuclear Shell Structure, d'après Maria Goeppert Mayer & J. Hans D. Jensen dans « Elementary Theory of Nuclear Shell Structure », John Wiley & Sons Inc., New York, 1955.
- ↑ Notamment les théories de champ moyen et les théories MM.
- ↑ C. Samanta, P. Roy Chowdhury and D.N. Basu, « Predictions of alpha decay half lives of heavy and superheavy elements », dans Nucl. Phys. A, vol. 789, 2007, p. 142–154 [lien DOI]
- ↑ P. Roy Chowdhury, C. Samanta, and D. N. Basu, « Search for long lived heaviest nuclei beyond the valley of stability », dans Phys. Rev. C, vol. 77, 2008, p. 044603 [texte intégral lien DOI]
- ↑ P. Roy Chowdhury, C. Samanta, and D. N. Basu, « Nuclear half-lives for α -radioactivity of elements with 100 < Z < 130 », dans At. Data & Nucl. Data Tables, vol. 94, 2008, p. 781 [lien DOI]
- ↑ Carl B. Collins et al., « First experimental evidence of induced gamma emission of a longlived Hafnium-178 isomer showing a highly efficient X-rays to gamma-rays conversion », Phys. Rev. Lett. 82, 695 (1999).
- ↑ B. R. Beck et al., « Energy splitting in the ground state doublet in the nucleus 229Th », dans Physical Review Letters, vol. 98, 2007-04-06, p. 142501 [texte intégral lien DOI]
- ↑ Helmer, R. G.; Reich, C. W., « An Excited State of Th-229 at 3.5 eV », dans Physical Review Letters, vol. C49, 1994, p. 1845-1858 [lien DOI]
- ↑ David R. Lide (ed.): CRC Handbook of Chemistry and Physics, 85ème édition, CRC Press, Boca Raton, Floride, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- ↑ a , b , c , d , e , f , g , h , i , j , k , l , m , n , o , p , q , r , s , t , u , v , w , x , y , z , aa , ab , ac , ad , ae , af , ag , ah , ai , aj , ak , al et am La composition isotopique de cet élément dépend des sources de prélèvement, et la variation peut dépasser l'incertitude indiquée dans la table.
- ↑ a , b , c , d , e , f , g et h La composition isotopique de cet élément dépend des sources du marché, ce qui peut entraîner un écart significatif par rapport à la valeur indiquée ici.
- ↑ a , b , c , d , e , f , g , h , i , j , k , l , m , n et o La composition isotopique dépend des sources géologiques de sorte qu'une masse atomique plus précise ne peut être déterminée.
- ↑ La masse atomique du lithium commercial peut varier de 6,939 à 6,996 ; l'analyse de l'échantillon est nécessaire afin de déterminer la valeur exacte de la masse atomique du lithium fourni.
- ↑ a , b , c , d , e , f , g , h , i , j , k , l , m , n , o , p , q , r , s , t , u , v , w , x , y , z , aa , ab , ac , ad , ae , af , ag , ah , ai et aj Cet élément n'a pas de nucléide stable, et la valeur indiquée entre crochets correspond à la masse de l'isotope le plus stable de cet élément ou à sa composition isotopique caractérisique.
- ↑ Aucun isotope de cet élément n'a encore été synthétisé.
Voir aussi
Articles connexes
- Découverte des éléments chimiques
- Liste des éléments chimiques
- Liste des éléments chimiques, triés par température de fusion
- Table des isotopes
- Isotope stable
- Élément synthétique
- Tableau périodique des éléments
Liens externes
- Base de données de la Société Française de Chimie (SFC)
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégorie : Élément chimique
Wikimedia Foundation. 2010.