- Désintégration radioactive
-
Physique de la radioactivité
La radioactivité, terme inventé vers 1898 par Pierre Curie, est un phénomène physique naturel au cours duquel des noyaux atomiques instables se désintègrent spontanément en d'autres noyaux, avec dégagement d'énergie sous forme de divers rayonnements. Si les noyaux ainsi créés sont toujours instables, ceux-ci donnent à leur tour lieu à un phénomène radioactif. Souvent, ce processus conduit donc à une chaîne de désintégrations successives – plus ou moins longue et complexe – avant d'aboutir à des noyaux atomiques stables qui ne sont plus radioactifs.
Sommaire
Historique de la découverte de la radioactivité
La radioactivité fut découverte en 1896 par Henri Becquerel (1852–1908), lors de ses travaux sur la phosphorescence : les matières phosphorescentes émettent de la lumière dans le noir après exposition à la lumière, et Becquerel supposait que la lueur qui se produit dans les tubes cathodiques exposés aux rayons X pouvaient être liée au phénomène de phosphorescence. Son expérience consistait à sceller une plaque photographique dans du papier noir et mettre ce paquet en contact avec différents matériaux phosphorescents. Tous ses résultats d'expérience furent négatifs, à l'exception de ceux mettant en cause des sels d'uranium, lesquels impressionnaient la plaque photographique à travers la couche de papier. Cependant, il apparut bientôt que l'impression de l'émulsion photographique n'avait rien à voir avec le phénomène de phosphorescence, car l'impression se faisait même lorsque l'uranium n'avait pas été exposé à la lumière au préalable. Par ailleurs, tous les composés d'uranium impressionnaient la plaque, y compris les sels d'uranium non phosphorescents et l'uranium métallique. À première vue, ce nouveau rayonnement était semblable au rayonnement X, découvert l'année précédente (en 1895) par le physicien allemand Wilhelm Röntgen (1845–1923), mais des études ultérieures menées par Becquerel lui-même, ainsi que par Marie Curie-Skłodowska (1867–1934) qui, sur le conseil de son mari Pierre Curie (1859–1906), fit de la radioactivité le sujet de sa thèse de doctorat, ou encore par Ernest Rutherford (1871–1937) et d'autres hors de la France, montraient que la radioactivité est nettement plus complexe que le rayonnement X. En particulier, ils trouvaient qu'un champ électrique ou magnétique sépare les rayonnements « uraniques » en trois faisceaux distincts, qu'ils baptisaient α, β et γ. La direction de la déviation des faisceaux montrait que les particules α étaient chargées positivement, les β négativement, et que les γ étaient neutres. En outre, la magnitude de la déflection indiquait nettement que les particules α étaient bien plus massives que les β.

En faisant passer les rayons α dans un tube à décharge et en étudiant les raies spectrales ainsi produites, on pouvait conclure que le rayonnement α est constitué d'hélions, autrement dit de noyaux d'hélium (4He). D'autres expériences permettaient d'établir que les rayons β sont composés d'électrons comme les particules dans un tube cathodique, et que les γ sont, tout comme les rayons X, des photons très énergétiques. Par la suite, on découvrit que de nombreux autres éléments chimiques ont des isotopes radioactifs. Ainsi, en traitant des tonnes de pechblende, une roche uranifère, Marie Curie réussit à isoler quelques milligrammes de radium dont les propriétés chimiques sont tout à fait similaires à celles du baryum (les deux sont des métaux alcalino-terreux), mais qu'on arrive à distinguer à cause de la radioactivité du radium.
Les dangers de la radioactivité pour la santé ne furent pas immédiatement reconnus. Ainsi, Nikola Tesla (1856–1943), en soumettant volontairement en 1896 ses propres doigts à une irradiation par des rayons X, constata que les effets aigus de cette irradiation étaient des brûlures qu'il attribua, dans une publication, à la présence d'ozone. D'autre part, les effets mutagènes des radiations, en particulier les risques de cancer, ne furent découverts qu'en 1927 par Hermann Joseph Muller (1890–1967). Avant que les effets biologiques des radiations ne soient connus, des médecins et des sociétés attribuaient aux matières radioactives des propriétés thérapeutiques : le radium, en particulier, était populaire comme tonifiant, et fut prescrit sous forme d'amulettes ou de pastilles. Marie Curie s'est élevée contre cette mode, arguant que les effets des radiations sur le corps n'étaient pas encore bien compris. De fait, pendant les années 1930, les nombreuses morts qui semblaient pouvoir être reliées à l'utilisation de produits contenant du radium ont fait passer de mode ce genre de radiothérapie sauvage et, actuellement, la radiothérapie n'est appliquée qu'à bon escient dans les hôpitaux, notamment pour soigner des cas de cancers avérés ou, éventuellement, d'autres maladies graves.
Rayonnements émis dans les processus radioactifs
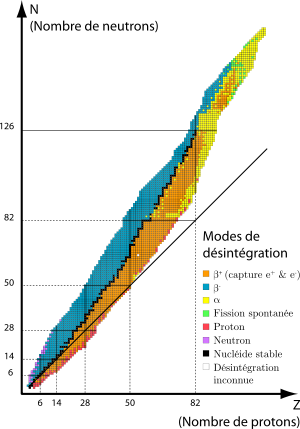
Les rayonnements émis par les noyaux atomiques radioactifs sont appelés, selon le cas, des rayons α, des rayons β ou des rayons γ. Dans un jargon franglais couramment utilisé, on distingue ainsi une radioactivité α, une radioactivité β (subdivisée en radioactivité β– et en radioactivité β+), et une radioactivité γ[1] :
- La radioactivité alpha (α) désigne la radioactivité lors de laquelle un noyau d'atome X(Z,A) de numéro atomique Z et de nombre de masse A se transforme spontanément en un autre noyau atomique Y(Z − 2,A − 4) de numéro atomique Z − 2 et de nombre de masse A − 4 et en un noyau d'hélium ou hélion He(2,4) de numéro atomique 2 et de nombre de masse 4, celui-ci étant émis en emportant une fraction de l'énergie de masse libérée par la transformation :
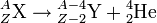 .
.Ces hélions, encore appelés particules alpha, ont une charge 2e, où e désigne la charge électrique élémentaire, et une masse de 4,001 505 8 unités de masse atomique.
- La radioactivité bêta moins (β–) affecte les nucléides X(Z,A) présentant un excès de neutrons. Elle se manifeste par la transformation spontanée dans le noyau d'un neutron n(0,1) en proton p(1,1), le phénomène s'accompagnant de l'émission d'un électron (ou particule bêta moins) e-(–1,0) et d'un antineutrino ν(0,0) :
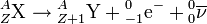
.
- La radioactivité bêta plus (β+) ne concerne que des nucléides « artificiels », obtenus dans des réactions nucléaires provoquées, qui présentent un excès de protons. Elle se manifeste par la transformation dans le noyau d'un proton p(1,1) en neutron n(0,1), le phénomène s'accompagnant de l'émission d'un positon (ou positron, ou encore particule bêta plus) e+(+1,0) et d'un neutrino ν(0,0) :
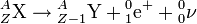
.
- La radioactivité gamma (γ) : les désintégrations α, β– et β+ sont toujours accompagnées de l'émission de photons de haute énergie ou rayons gamma, dont les longueurs d'onde sont généralement encore plus courtes que celles des rayons X, étant de l'ordre de 10–9 m ou inférieures. Cette émission gamma (γ) résulte de transitions à partir de niveaux d'énergie excités du noyau. Le spectre émis est un spectre de raies qualitativement comparable aux spectres infrarouge, optique et ultraviolet qui résultent des transitions entre les différents niveaux d'énergie dans les atomes, mais quantitativement la différence provient du fait que les énergies mises en jeu dans les atomes sont de l'ordre de l'électron-volt (eV), alors que dans les noyaux atomiques elles sont environ un million de fois plus élevées et sont de l'ordre du MeV. Il convient de ne pas confondre la radioactivité (la cause) avec les rayonnements (l'effet) qu'elle produit ; en effet, les mêmes rayonnements sont aussi produits par des processus physiques et astrophysiques qui n'ont rien à voir, de près ou de loin, avec la radioactivité.
Il est à remarquer que la radioactivité peut provenir de radioéléments naturels ou de radioéléments artificiels, ces derniers étant produits au laboratoire et dans des réacteurs nucléaires fabriqués par les êtres humains ou se constituant tout à fait exceptionnellement de façon spontanée dans la Nature, comme celui qui semble avoir fonctionné il y a deux milliards d'années sur le site d'Oklo[2] au Gabon, ou encore lors d'explosions de bombes atomiques. Dans le premier cas, on parle alors souvent de radioactivité naturelle, pour insister sur le fait que la radioactivité est produite par des radioéléments se rencontrant avec des abondances plus ou moins grandes (mais toujours assez faibles) dans la Nature, bien qu'en elle-même la radioactivité, quel que soit le noyau atomique instable considéré, soit toujours naturelle et que l'expression soit donc un pléonasme. Dans le deuxième cas, on parle de radioactivité artificielle, terme qui en soi est un non-sens, mais qui est néanmoins le terme consacré depuis que les époux Frédéric Joliot (1900–1958) et Irène Curie (1897–1956) ont reçu en 1935 le prix Nobel de chimie « pour la découverte de la radioactivité artificielle »[3]
Les radioéléments les plus fréquents dans les roches terrestres sont l'isotope 238 de l'uranium : 238U ou U(92,238), l'isotope 232 du thorium : 232Th ou Th(90,232), et surtout l'isotope 40 du potassium : 40K ou K(19,40). Outre ces isotopes radioactifs naturels encore relativement abondants, il existe dans la Nature des isotopes radioactifs en abondances beaucoup plus faibles. Il s'agit notamment des éléments instables produits lors de la suite de désintégrations des isotopes mentionnés, par exemple de divers isotopes du radium et du radon. Un autre radioélément naturel est l'isotope 235 de l'uranium : 235U ou U(92,235), qui se trouve dans la Nature en concentrations très faibles associées à l'isotope 238U, mais dont on « enrichit » la concentration par des techniques adaptées pour qu'il puisse servir à des besoins civils et militaires. Un autre radioisotope naturel est le radiocarbone, c'est-à-dire l'isotope 14 du carbone : 14C ou C(6,14). Ce dernier est constamment produit dans la haute atmosphère par des rayons cosmiques interagissant avec l'azote, et se détruit par désintégrations radioactives à peu près au même taux qu'il est produit, de sorte qu'il se produit un équilibre dynamique qui fait que la concentration du 14C reste plus ou moins constante au cours du temps dans l'air et dans les organismes vivants qui respirent cet air. Une fois un organisme mort, la concentration en 14C diminue dans ses tissus, et permet de dater le moment de la mort. Cette datation au radiocarbone est un outil de recherche très prisé en archéologie et permet de dater avec une bonne précision des objets organiques dont l'âge ne dépasse pas cinquante à cent mille ans.
Loi de désintégration radioactive
La décroissance radioactive est la réduction du nombre de noyaux radioactifs (instables) dans un échantillon. La décroissance radioactive se produit jusqu'à ce que tous les noyaux de l'échantillon soient stables. Un radionucléide quelconque a autant de chances de se désintégrer à un moment donné qu'un autre radionucléide de la même espèce, et la désintégration ne dépend pas des conditions physico-chimiques dans lesquelles le nucléide se trouve. En d'autres termes, la désintégration est régie par le hasard, et la loi de désintégration radioactive est une loi statistique. Soit N(t) le nombre de radionucléides d'une espèce donnée présents dans un échantillon à un instant t quelconque. Comme la probabilité de désintégration d'un quelconque de ces radionucléides ne dépend pas de la présence des autres radionucléides ni du milieu environnant, le nombre total de désintégrations dN pendant un bref intervalle de temps dt à l'instant t est proportionnel au nombre de radionucléides de même espèce N présents et à la durée dt de cet intervalle. On montre facilement que le nombre d'atomes décroît exponentiellement :
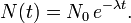
La période des radioéléments naturels varie dans des proportions énormes allant, pour ceux repris dans le tableau ci-dessous, de 0,3 µs pour le polonium 212 jusqu'à 1,405×1010 ans pour le thorium 232.
Périodes radioactives de quelques radioéléments naturels Radioisotope Notation Numéro atomique Z Abondance relative Période radioactive Rayonnement émis f–1 Produit ( * = radioactif) Rubidium 87 87Rb 37 27,835 % 47 x 109 a β– 87Sr Rhénium 187 187Re 75 62,6 % 43,5 x 109 a α, β– 183Ta, 187Os Lutécium 176 176Lu 71 2,59 % 37,8 x 109 a β– 176Hf Thorium 232 232Th 90 100 % 14,05 x 109 a α 228Ra * Uranium 238 238U 92 99,28 % 4,5 x 109 a α 234Th * Potassium 40 40K 19 0,01167 % 1,277 x 109 a β+, β– 40Ar, 40Ca Uranium 235 235U 92 0,718 % 703,8 x 106 a α 231Th * Uranium 234 234U 92 0,0056 % 245,5 x 10³ a α 230Th * Carbone 14 14C 6 traces 5730 a β– 14N Radium 226 226Ra 88 traces, 100 % 1602 a α 222Rn * Actinium 227 227Ac 89 traces, 100 % 21,773 a β–, α 227Th *, 223Fr * Polonium 210 210Po 84 traces 138,376 d α 206Pb Thorium 234 234Th 90 traces 24,1 d β 233Pa * Radon 222 222Rn 86 traces, 100 % 3,824 d α 218Po * Radon 220 220Rn 86 traces 54,5 s α 216Po * Polonium 216 216Po 84 traces 0,158 s α 212Pb * Polonium 215 215Po 84 traces 1,83 ms α 211Tl * Polonium 212 212Po 84 traces 0,29 µs α 208Pb Unités d'activité des radioéléments
On emploie trois unités différentes pour mesurer la radioactivité. Toutes les trois caractérisent l'activité d'un radioisotope par le nombre de désintégrations qui se produisent par unité de temps.
- Le Becquerel (Bq) correspond à 1 désintégration par seconde. Le nom a été donné pour honorer la mémoire du découvreur de la radioactivité.
- La plus ancienne unité, qui est encore la plus fréquemment utilisée, est le Curie (Ci). Celle-ci a été primitivement définie comme le nombre de rayons émis par seconde par un gramme de radium « en équilibre » avec ses dérivés, soit 3,7 x 1010 Bq. Toutefois, il est plus commode de définir cette unité a priori comme suit : Une source de 1 Curie est celle qui subit 37 milliards de désintégrations par seconde. Les sous-multiples usuels sont le milliCurie (mCi), le microCurie (µCi) et le nanoCurie (nCi). On a : 1 nCi = 37 Bq.
- Une unité plus récente, proposée en 1946 par le National Bureau of Standards de Washington (États Unis d'Amérique), est le Rutherford (Rd), qui correspond à un million (106) de Bq. On a donc l'équivalence : 1 mCi = 37 Rd.
Séries radioactives
La découverte de nombreux éléments radioactifs à la fin du XIXe et au début du XXe siècle a vite permis de voir qu'il existe, pour quelques-uns d'entre eux, des relations génétiques. La transformation radioactive d'un noyau atomique instable par émission α ou β conduit à un autre noyau atomique qui, souvent, est lui aussi instable. La transformation spontanée se poursuit alors selon une succession bien déterminée, pour s'achever par la formation d'un noyau atomique stable. Les noyaux qui donnent lieu à ces désintégrations successives α ou β ont été groupés en séries (ou familles) dont les éléments successifs sont les descendants les uns des autres. À ces séries d'éléments naturels viennent se rattacher un certain nombre de radioéléments dont les périodes sont trop courtes pour encore exister à l'état naturel sur la Terre ; on les produit « artificiellement » dans des réactions nucléaires et on les appelle des « radioéléments artificiels » ou, mieux, des « radioéléments synthétiques ».
Notes
- ↑ Cette terminologie est indiquée par exemple dans l'ouvrage de
- J.P. Sarmant (1988). Dictionnaire Hachette de Physique, Hachette, Paris. ISBN 2-01-007597-8.
- ↑ Consulter par exemple le site http://www.ecolo.org/documents/documents_in_french/oklo_reacteur_naturel.htm.
- ↑ * http://www.curie.fr/fondation/musee/irene-frederic-joliot-curie.cfm/lang/_fr.htm.
Voir aussi
Articles connexes
- Tableau périodique des éléments
- Demi-vie
- Radioactivité
- Rayonnement ionisant
- Radioprotection
- Géochronologie
Liens externes
- CIPR - Commission internationale de protection radiologique
- IRSN - Institut de radioprotection et de sûreté nucléaire
- SFRP - Société française de radioprotection
- LaRadioactivite.com Un site expliquant ce qu'est la radioactivité réalisé par des chercheurs du CNRS
- (histoire des sciences) articles de février et mars 1896 d'Henri Becquerel, et analyse de ces articles sur le site BibNum.
- (histoire des sciences) La découverte de la radioactivité artificielle, texte et analyse sur le site BibNum.
- Portail de la physique
- Portail des sciences de la Terre et de l’Univers
Catégories : Article à Texifier | Physique nucléaire | Géophysique | Radioactivité
Wikimedia Foundation. 2010.