- Tableau périodique
-
Tableau périodique des éléments
 Pour les articles homonymes, voir Tableau.
Pour les articles homonymes, voir Tableau.Le tableau périodique des éléments, également appelé table de Mendeleïev, classification périodique des éléments (CPE) ou simplement tableau périodique, représente tous les éléments chimiques, ordonnés par numéro atomique croissant et organisés en fonction de leur configuration électronique, laquelle sous-tend leurs propriétés chimiques.
Son invention est généralement attribuée au chimiste russe Dmitri Mendeleïev, qui construisit en 1869 une table différente de celle qu'on utilise aujourd'hui[1] mais similaire dans son principe, dont le grand intérêt était de proposer une classification systématique des éléments chimiques connus à l'époque en vue de souligner la périodicité de leurs propriétés chimiques, d'identifier les éléments qui restaient à découvrir, et même de pouvoir prédire les propriétés de ces éléments alors inconnus.
Le tableau périodique a connu de nombreux réajustements depuis lors jusqu'à prendre la forme que nous lui connaissons aujourd'hui, et est devenu un référentiel universel auquel peuvent être rapportés tous les types de comportements physique et chimique des éléments. En juin 2009, sa forme standard comportait 117 éléments, allant de 1H à 118Uuo, à l'exception de l'élément 117 qui n'a pas encore été synthétisé.
Le tableau périodique standard
Ce tableau est la représentation la plus usuelle de la classification des éléments chimiques. Certains chimistes ont proposé d'autres façons de classer les éléments, mais celles-ci restent bornées au domaine scientifique.
Tableau périodique des éléments > 1
I A2
II A3
III B4
IV B5
V B6
VI B7
VII B8
VIII B9
VIII B10
VIII B11
I B12
II B13
III A14
IV A15
V A16
VI A17
VII A18
VIII AV 1 1
H2
He2 3
Li4
Be5
B6
C7
N8
O9
F10
Ne3 11
Na12
Mg13
Al14
Si15
P16
S17
Cl18
Ar4 19
K20
Ca21
Sc22
Ti23
V24
Cr25
Mn26
Fe27
Co28
Ni29
Cu30
Zn31
Ga32
Ge33
As34
Se35
Br36
Kr5 37
Rb38
Sr39
Y40
Zr41
Nb42
Mo43
Tc44
Ru45
Rh46
Pd47
Ag48
Cd49
In50
Sn51
Sb52
Te53
I54
Xe6 55
Cs56
Ba* 72
Hf73
Ta74
W75
Re76
Os77
Ir78
Pt79
Au80
Hg81
Tl82
Pb83
Bi84
Po85
At86
Rn7 87
Fr88
Ra** 104
Rf105
Db106
Sg107
Bh108
Hs109
Mt110
Ds111
Rg112
Uub[2]113
Uut114
Uuq115
Uup116
Uuh117
Uus118
Uuo* Lanthanides 57
La58
Ce59
Pr60
Nd61
Pm62
Sm63
Eu64
Gd65
Tb66
Dy67
Ho68
Er69
Tm70
Yb71
Lu** Actinides 89
Ac90
Th91
Pa92
U93
Np94
Pu95
Am96
Cm97
Bk98
Cf99
Es100
Fm101
Md102
No103
LrMétalloïdes Non-métaux Halogènes Gaz nobles Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides
Dans des conditions normales de température et de pression (0 °C, 1 atm) :- Les éléments dont le numéro atomique est rouge sont gazeux ;
- Les éléments dont le numéro atomique est bleu sont liquides — il n'y en a que deux à 0 °C : le brome (35) et le mercure (80)[3] ;
- Les éléments dont le numéro atomique est noir sont solides.
Dans la nature :
- Les éléments avec une bordure continue grise peuvent être trouvés naturellement sur Terre, sous la forme d'un ou plusieurs isotopes stables.
- Les éléments avec une bordure en pointillés fins bleus sont artificiels (éléments synthétiques).
- Les éléments sans bordure n'ont pas encore été observés — au 30 juin 2009, il n'en restait plus qu'un : l'élément 117.
Construction du tableau
s1 s2 f d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo ↓ f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Bloc s Bloc f Bloc d Bloc p Dans la mesure où les propriétés physicochimiques des éléments reposent sur leur configuration électronique, cette dernière est sous-jacente à l'agencement du tableau périodique. Ainsi, chaque ligne du tableau (appelée période) correspond à une couche électronique, identifiée par son nombre quantique principal, noté n : il y a sept couches électroniques connues à l'état fondamental, donc sept périodes dans le tableau périodique standard, numérotées de 1 à 7. Chaque période est elle-même scindée en un nombre variable de blocs, qui correspondent aux orbitales atomiques, identifiées par leur nombre quantique secondaire, noté l : il y a quatre types d'orbitales atomiques connues à l'état fondamental, notées s, p, d et f (ces lettres viennent d'abréviations utilisées initialement en spectroscopie) et pouvant contenir chacune respectivement 2, 6, 10 et 14 électrons ; c'est la raison pour laquelle on parle de bloc s, bloc p, bloc d et bloc f.
Si l'on respecte la construction du tableau par blocs en fonction des orbitales atomiques, l'hélium doit se trouver au-dessus du béryllium dans la colonne 2 (celle dont les atomes ont une sous-couche externe ns2) et non au-dessus du néon dans la colonne 18 (dont les atomes ont une sous-couche externe np6), comme c'est le cas dans la petite table ci-contre ; l'hélium est positionné usuellement dans la colonne 18 car c'est celle des gaz rares, dont il fait chimiquement partie.
Règle de Klechkowski
Toutes les sous-couches d'une période n'appartiennent pas forcément à la même couche électronique (c'est le cas à partir de la quatrième période) : à partir de la troisième couche électronique, les sous-couches d'une même couche sont en effet réparties sur plusieurs périodes ; les électrons se distribuent en fait sur les différents niveaux d'énergie quantiques autour de l'atome selon un principe d'Aufbau (c'est-à-dire « construction » en allemand) dans des sous-couches électroniques dont l'ordre précis est donné par la règle de Klechkowski :
-
Sous-couche 1s 1 case quantique → 2 électrons → 2 éléments sur la 1ère période Sous-couche 2s 1 case quantique → 2 électrons Sous-couche 2p 3 cases quantiques → 6 électrons → 8 éléments sur la 2ème période Sous-couche 3s 1 case quantique → 2 électrons Sous-couche 3p 3 cases quantiques → 6 électrons → 8 éléments sur la 3ème période Sous-couche 4s 1 case quantique → 2 électrons Sous-couche 3d 5 cases quantiques → 10 électrons Sous-couche 4p 3 cases quantiques → 6 électrons → 18 éléments sur la 4ème période Sous-couche 5s 1 case quantique → 2 électrons Sous-couche 4d 5 cases quantiques → 10 électrons Sous-couche 5p 3 cases quantiques → 6 électrons → 18 éléments sur la 5ème période Sous-couche 6s 1 case quantique → 2 électrons Sous-couche 4f 7 cases quantiques → 14 électrons Sous-couche 5d 5 cases quantiques → 10 électrons Sous-couche 6p 3 cases quantiques → 6 électrons → 32 éléments sur la 6ème période Sous-couche 7s 1 case quantique → 2 électrons Sous-couche 5f 7 cases quantiques → 14 électrons Sous-couche 6d 5 cases quantiques → 10 électrons Sous-couche 7p 3 cases quantiques → 6 électrons → 32 éléments sur la 7ème période
C'est la succession des sous-couches électroniques de chaque période qui détermine la structure du tableau périodique, chaque période étant définie par le retour d'une sous-couche s suivant une sous-couche p de la période précédente.
Exceptions et règle de Hund
La règle de Klechkowski est observée pour plus de 80 % des 103 éléments dont la configuration électronique à l'état fondamental est connue avec précision, mais 20 éléments y font exception. L'état fondamental est en effet par définition celui dont l'énergie est la plus faible, et le spin des électrons entre en jeu pour déterminer cette énergie : plus le spin résultant des électrons d'une orbitale atomique est élevé, plus stable est la configuration de ces électrons sur cette orbitale (règle de Hund). Il s'ensuit que, pour les éléments du bloc d et du bloc f (métaux de transition, lanthanides et actinides), il est énergétiquement moins favorable de suivre la règle de Klechkowski que de favoriser l'occupation impaire des sous-couches les plus externes lorsque la couche d ou f est vide, à moitié remplie ou entièrement remplie, car l'écart d'énergie entre ces sous-couches est inférieur au gain d'énergie induit par la redistribution des électrons maximisant leur spin résultant (dans le tableau qui suit, les électrons de cœur sont en gris) :
-
Élément chimique Série chimique Configuration électronique no 24 Cr Chrome Métal de transition 1s2 2s2 2p6 3s2 3p6 4s1 3d5 no 29 Cu Cuivre Métal de transition 1s2 2s2 2p6 3s2 3p6 4s1 3d10 no 41 Nb Niobium Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d4 no 42 Mo Molybdène Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d5 no 43 Tc Technétium Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d6 no 44 Ru Ruthénium Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d7 no 45 Rh Rhodium Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d8 no 46 Pd Palladium Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10 no 47 Ag Argent Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1 4d10 no 57 La Lanthane Lanthanide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 no 58 Ce Cérium Lanthanide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f1 5d1 no 64 Gd Gadolinium Lanthanide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f7 5d1 no 78 Pt Platine Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d9 no 79 Au Or Métal de transition 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1 4f14 5d10 no 89 Ac Actinium Actinide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d1 no 90 Th Thorium Actinide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 6d2 no 91 Pa Protactinium Actinide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f2 6d1 no 92 U Uranium Actinide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f3 6d1 no 96 Cm Curium Actinide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f7 6d1 no 103 Lr Lawrencium Actinide 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 7p1
Périodicité des propriétés chimiques
Le grand intérêt de la classification périodique est d'organiser les éléments chimiques de telle sorte que leurs propriétés physicochimiques puissent être largement prédites par leur position dans la table. Ces propriétés évoluent différemment selon qu'on se déplace verticalement ou horizontalement dans le tableau.
Périodes et groupes du tableau périodique
Articles principaux : période du tableau périodique et groupe du tableau périodique.1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Tableau périodique des éléments chimiques - Une période désigne une ligne du tableau périodique. Elle se définit par le remplissage progressif des sous-couches électroniques jusqu'à atteindre la sous-couche s de la couche électronique suivante. Les propriétés des éléments varient généralement beaucoup le long d'une période, mais peuvent être localement assez similaire et constituer des séries chimiques complètes, notamment dans le bloc d (métaux dits « de transition ») et surtout dans le bloc f (lanthanides sur la 6ème période et actinides sur la 7ème période).
- Un groupe désigne une colonne du tableau périodique. Chacun des 18 groupes du tableau périodique standard (plus le 19ème groupe des éléments du bloc f, lanthanides et actinides) constitue souvent un ensemble d'éléments aux propriétés bien distinctes des groupes voisins, notamment aux extrémités gauche et droite du tableau périodique (c'est-à-dire dans les blocs s et p) où ils se sont vu attribuer des noms d'usage au cours du temps :
- métaux alcalins = groupe 1 (bloc s) excepté l'hydrogène
- métaux alcalino-terreux = groupe 2 (bloc s)
- cristallogènes = groupe 14 (bloc p)
- pnictogènes = groupe 15 (bloc p)
- chalcogènes = groupe 16 (bloc p)
- halogènes = groupe 17 (bloc p)
- gaz rares = groupe 18 (bloc p) dont l'hélium (bloc s)
- Si les termes cristallogène, pnictogène et chalcogène sont aujourd'hui assez désuets, les quatre autres en revanche sont encore très employés car ils se confondent avec des séries chimiques de même nom.
Variations des propriétés le long d'une période
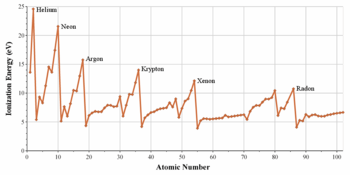 Périodicité de l'énergie d'ionisation[4] : chaque période commence par un minimum dans la colonne des métaux alcalins et s'achève par un maximum dans la colonne des gaz rares.
Périodicité de l'énergie d'ionisation[4] : chaque période commence par un minimum dans la colonne des métaux alcalins et s'achève par un maximum dans la colonne des gaz rares.
D'une manière générale, le rayon atomique tend à décroître lorsqu'on parcourt une période de gauche à droite. Ceci résulte du fait que la charge électrique du noyau atomique augmente tout au long de chaque période, ce qui augmente l'attraction du noyau sur les électrons et diminue par conséquent le volume des orbitales atomiques ; la contraction des lanthanides illustre très bien ce phénomène. En corollaire, l'énergie d'ionisation et l'électronégativité augmentent lorsqu'on parcourt une période de gauche à droite, puisque les électrons sont liés plus fortement au noyau à la droite du tableau.
L'affinité électronique tend également à croître légèrement, celle des métaux étant généralement inférieure à celle des non-métaux — hormis bien sûr celle des gaz rares.
Variation des propriétés dans un groupe
La description quantique de la configuration électronique des atomes permet d'expliquer la similitude des propriétés chimiques au sein d'un groupe par une configuration identique des électrons dans la couche de valence.
Le rayon atomique augmente rapidement de haut en bas d'un groupe, car à chaque période s'ajoute une couche électronique. En corollaire, l'énergie d'ionisation et l'électronégativité diminuent car les électrons périphériques sont moins fortement liés au noyau dans le bas du tableau.
Quelques exemples de groupes :
- Groupe 1 – métaux alcalins
Article principal : métal alcalin.- Hormis l'hydrogène, les éléments du premier groupe du tableau périodique constituent la série des métaux alcalins. Il s'agit de métaux peu denses de couleur argentée et à bas point de fusion, plutôt mous à température ambiante, formant des composés ioniques avec les halogènes et chimiquement très réactifs — ils réagissent violemment avec l'eau pour donner des hydroxydes qui sont des bases fortes — de sorte qu'on ne les trouve jamais sous forme élémentaire dans le milieu naturel.
- Groupe 2 – métaux alcalino-terreux
Article principal : métal alcalino-terreux.- Un peu plus durs et plus denses que les métaux alcalins, les métaux alcalino-terreux forment également des composés ioniques avec les halogènes mais ne réagissent pas avec l'eau à température ambiante, seulement avec la vapeur d'eau pour former des hydroxydes très basiques.
- Groupe 17 – halogènes
Article principal : halogène.- Ils existent sous forme élémentaire diatomique et forment des acides forts avec l'hydrogène. Les halogènes constituent des composés ioniques avec les métaux alcalins et les métaux alcalino-terreux.
- Groupe 18 – gaz rares
Article détaillé : gaz rare.- Aux conditions normales de température et de pression, ce sont des gaz monoatomiques incolores et inodores quasiment dépourvus de réactivité chimique, dont les points de fusion et d'ébullition sont séparés de moins de 10 °C à pression atmosphérique.
Relations diagonales
Outre les analyses par lignes et par colonnes, le tableau périodique permet également d'établir des relations diagonales entre certains éléments chimiques des deuxième et troisième périodes qui se trouvent en diagonale les uns par rapport aux autres dans le tableau. Il s'agit toujours de la direction diagonale allant du haut à gauche vers le bas à droite, car parcourir une période vers la droite et descendre le long d'une colonne se traduisent de façon opposée sur la couche de valence des atomes (respectivement : diminution et augmentation du rayon atomique, et en corollaire : augmentation et diminution de l'électronégativité ; cf. les deux paragraphes précédents). Il s'ensuit certaines similitudes entre éléments diagonaux, qui pourtant ne partagent ni la même période ni le même groupe.
Séries chimiques et autres regroupements
Au-delà des lignes, des colonnes et des diagonales, les éléments sont également regroupées en dix séries chimiques aux propriétés physicochimiques homogènes. Aux extrémités gauche et droite du tableau, ces séries se confondent avec les groupes, tandis qu'au centre du tableau elles ont plutôt tendance à ce confondre avec les blocs, voire avec les périodes :
- Série des métaux alcalins, égale au groupe 1, moins l'hydrogène.
- Série des métaux alcalino-terreux, confondue avec le groupe 2.
- Série des lanthanides, égale aux éléments du bloc f de la 6ème période, plus le lutécium 71Lu.
- Série des actinides, égale aux éléments du bloc f de la 7ème période, plus le lawrencium 103Lr.
- Série des métaux de transition, égale aux éléments du bloc d moins le lutécium 71Lu et le lawrencium 103Lr.
- Série des métaux pauvres, comprenant :
- Série des métalloïdes :
- Série des non-métaux :
- Série des halogènes, confondue avec le groupe 17.
- Série des gaz rares, confondue avec le groupe 18.
D'autres regroupements sont également en usage, par exemple :
-
- les terres rares, qui comprennent le scandium 21Sc, l'yttrium 39Y et les lanthanides ;
- le groupe du platine, qui regroupe les éléments des groupes 7 à 10 des périodes 5 et 6 excepté le technétium 43Tc.
Limites à la périodicité aux confins du tableau
La configuration électronique des éléments est décrite de façon satisfaisante par le modèle des orbitales atomiques jusqu'au milieu de la 7ème période ; pour Z >> 100, des effets relativistes deviennent significatifs sur des électrons en interaction avec un noyau très fortement chargé, certaines corrections induites par l'électrodynamique quantique ne peuvent plus être négligées, les approximations considérant les électrons de façon individuelle cessent d'être valides dans la détermination des orbitales, et des effets de couplage spin-orbite redistribuent les niveaux d'énergie, et donc les sous-couches électroniques : il s'ensuit que la distribution des électrons autour du noyau obéit de moins en moins aux règles bien vérifiées pour les six premières périodes, et que les propriétés des éléments dans cette région du tableau cessent d'être prédictibles en fonction de leur groupe.
Ainsi, l'élément 118Uuo devrait être un gaz rare en vertu de son positionnement en bas de la 18ème colonne du tableau, mais il s'agirait en fait d'un solide semiconducteur aux propriétés voisines d'un métalloïde[5], tandis que l'élément 114Uuq, qui devrait être un métal pauvre en bas de la 14ème colonne, aurait plutôt les propriétés d'un gaz rare[6].
Le copernicium 112Cn, situé parmi les métaux de transition, aurait également des propriétés le rapprochant des gaz rares[7] et serait d'ailleurs gazeux[8].
Isotopes et radioactivité
Isotopes
Article connexe : Table des isotopes.Les éléments chimiques sont identifiés dans le tableau périodique par leur numéro atomique, qui représente le nombre de protons que contient leur noyau, mais il peut exister plusieurs atomes différents pour un même élément chimique, différant les uns des autres par le nombre de neutrons dans leur noyau. Dans la mesure où ces atomes occupent la même case dans le tableau périodique, ils sont dits isotopes — avec une étymologie issue du grec ancien ἴσος τόπος signifiant « au même endroit ».
Les isotopes d'un élément ont généralement exactement les mêmes propriétés chimiques, car leur configuration électronique est identique. Mais la masse du noyau étant différente, on observe un effet isotopique d'autant plus prononcé que l'atome est léger. C'est notamment le cas pour le lithium 3Li, l'hélium 2He (du point de vue de ses propriétés physiques) et surtout l'hydrogène 1H.
L'isotope 2H (deutérium) est suffisamment différent de l'isotope 1H (protium) pour que l'UICPA admette (mais sans le recommander) l'usage d'un symbole chimique spécifique au deutérium (D) distinct de celui de l'hydrogène (H).
Radioactivité
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba * Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra * Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uuo ↓ * La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb * Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Pb Un isotope au moins de cet élément est stable Cm Un isotope a une période d'au moins 4 millions d'années Cf Un isotope a une période d'au moins 800 ans Md Un isotope a une période d'au moins 1 journée Mt Un isotope a une période d'au moins 1 minute Uuo Aucun isotope connu n'a de période dépassant 1 minute 80 des 117 éléments du tableau périodique standard possèdent au moins un isotope stable : ce sont tous les éléments de numéro atomique compris entre 1 (hydrogène) et 82 (plomb) hormis le technétium 43Tc et le prométhéum 61Pm, qui sont radioactifs.
Dès le bismuth 83Bi, tous les isotopes des éléments connus sont (au moins très faiblement) radioactifs — l'isotope 209Bi a ainsi une période radioactive valant un milliard de fois l'âge de l'univers. Lorsque la période dépasse quatre millions d'année, la radioacivité produite par ces isotopes est négligeable et ne constitue pas de risque sanitaire : c'est par exemple le cas de l'uranium 238, dont la période est de près de 4,5 milliards d'années.
Au-delà de Z = 110 (darmstadtium 281Ds), tous les isotopes des éléments ont une période radioactive de moins de 30 secondes, et de moins d'un dixième de seconde à partir de l'élément 115 (ununpentium 288Uup).
Le modèle en couches de la structure nucléaire permet de rendre compte de la plus ou moins grande stabilité des noyaux atomiques en fonction de leur composition en nucléons (protons et neutrons). En particulier, des « nombres magiques » de nucléons, conférant une stabilté particulière aux atomes qui en sont composés, ont été observés expérimentalement, et expliqués par ce modèle[9]. Le plomb 208, qui est le plus lourd des noyaux stables existants, est ainsi composé du nombre magique de 82 protons et du nombre magique de 126 neutrons.
Certaines théories[10] extrapolent ces résultats en prédisant l'existence d'un îlot de stabilité parmi les nucléides superlourds, pour un « nombre magique » de 184 neutrons et — selon les théories et les modèles — 114, 120, 122 ou 126 protons ; une approche plus moderne montre toutefois, par des calculs fondés sur l'effet tunnel, que, si de tels noyaux doublement magiques seraient probablement stables du point de vue de la fission spontanée, ils devraient cependant subir des désintégrations α avec une période radioactive de quelques microsecondes[11],[12],[13], tandis qu'un îlot de relative stabilité pourrait exister autour du darmstadtium 293, correspondant aux nucléides définis par Z compris entre 104 et 116 et N compris entre 176 et 186 : ces éléments pourraient avoir des isotopes présentant des périodes radioactives atteignant quelques minutes.
Extension du tableau périodique
Article principal : éléments de la période 8.Au-delà des sept périodes standard, une huitième période est envisagée pour classer les atomes — à ce jour inobservés — ayant plus de 118 protons. On ignore jusqu'à combien de protons et d'électrons un même atome peut contenir, la limite théorique se situant vers 173 protons : un 174ème proton conférerait à la couche nucléaire 1s1/2 une énergie de – 511 keV, égale à la masse au repos d'un électron ou d'un positon ; un tel noyau serait donc instable par rapport à la désintégration β+.[14],[15] La limite d'observabilité pratique est généralement estimée à au plus Z = 130.[16]
Cette huitième période serait la première à posséder des éléments du bloc g, caractérisés à l'état fondamental par des électrons sur une orbitale g. Néanmoins, compte tenu des limites à la périodicité aux confins du tableau — effets relativistes sur les électrons des très gros atomes — qui deviennent significatifs dès le dernier tiers de la septième période, il est peu probable que la configuration électronique de tels atomes obéisse aux règles observées tout au long des six premières périodes.
Le tableau périodique étendu à la huitième période, organisé selon la configuration électronique de la couche de valence, aurait l'aspect suivant :
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés
Une neuvième période est parfois évoquée, mais, compte tenu de l'incertitude réelle quant à la possibilité d'observer à terme plus d'une dizaine d'éléments nouveaux sur la huitième période, tous les éléments de numéro atomique supérieur à 130 relèvent a priori de la pure extrapolation mathématique.Assez peu de laboratoires dans le monde sont équipés d'infrastructures permettant d'atteindre les sensibilités requises — avec des sections efficaces très inférieures au picobarn, grandeur équivalente à 10-40 m2 — pour la détection de noyaux aussi lourds que ceux de la huitième période. Ce sont principalement :
- l'Institut unifié de recherches nucléaires (JINR) à Doubna, dans l'oblast de Moscou — un centre de recherche dont fait notamment partie le Flerov Laboratory for Nuclear Reactions (FLNR), à l'origine des dernières synthèses en date d'éléments nouveaux (notamment l'élément 118)
- le Lawrence Livermore National Laboratory (LLNL) à Livermore, en Californie
- le GSI Helmholtzzentrum für Schwerionenforschung GmbH (GSI) à Darmstadt, en Hesse.
- l'Organisation européenne pour la recherche nucléaire (CERN) à Genève, en Suisse
Le RIKEN au Japon et l'Institut Paul Scherrer (PSI) en Suisse comptent également parmi les organisations notables dans ce domaine de recherches. D'une manière générale, la mise en commun des ressources de ces laboratoires est de mise pour parvenir à des résultats probants, et la synthèse de l'élément 118 au début des années 2000 a été le fruit d'une collaboration entre le JINR russe et le LLNL américain.
Historique
De la toute première tentative de classification des éléments chimiques par Antoine Lavoisier en 1789 au tableau périodique de Glenn Seaborg que nous utilisons aujourd'hui, de nombeux hommes de sciences, issus d'horizons — et parfois de disciplines — différents, ont apporté chacun leur contribution, sur une période de près de deux siècles.
Première classification d'Antoine Lavoisier
C'est en 1789 que le chimiste français Antoine Lavoisier a publié à Paris son Traité élémentaire de chimie, présenté dans un ordre nouveau et d'après les découvertes modernes. Cet ouvrage en deux volumes a jeté les bases de la chimie moderne, en faisant le point sur les connaissances de la fin du XVIIIe siècle dans cette discipline. Il y précise notamment le concept d'élément chimique comme une substance simple qui ne peut être décomposée en d'autres substances, avec en corollaire la loi fondamentale de conservation de la masse de chacune de ces substances simples au cours des réactions chimiques. Il mentionna également le fait que de nombreuses substances considérées comme simples par le passé se sont révélées être en réalité des composés chimiques (par exemple l'huile et le sel marin), et il précisa s'attendre à ce qu'on considère sous peu les terres (c'est-à-dire certains minerais) comme des substances composées de nouveaux éléments.
Il publia dans cet ouvrage un tableau récapitulatif des « substances » considérées à son époque comme des éléments chimiques, en prenant soin d'établir une équivalence avec le vocabulaire hérité des alchimistes afin d'éliminer toute ambiguïté. Ce tableau, qui se voulait exhaustif et outil de référence, mentionnait ainsi, parmi les éléments chimiques, la lumière et le feu, encore considérés à cette époque comme des principes « chimiques » bien que Lavoisier lui-même ait invalidé la théorie du phlogistique :
Noms nouveaux Noms anciens correspondants Substances simples
qui appartiennent
aux trois règnes
et qu'on peut
regarder comme
les éléments
des corps[17]Lumière Calorique Chaleur
Principe de la chaleur
Fluide igné
Feu
Matière du feu et de la chaleurOxygène Air déphlogistiqué
Air empiréal
Air vital
Base de l'air vitalAzote Gaz phlogistiqué
Mossette
Base de la mossetteHydrogène Gaz inflammable
Base du gaz inflammableSubstances simples
non-métalliques
oxydables et
acidifiablesSoufre Phosphore Carbone Charbon pur Radical muriatique[18] Inconnu Radical fluorique[19] Inconnu Radical boracique[20] Inconnu Substances simples
métalliques
oxydables et
acidifiablesAntimoine Argent Arsenic Bismuth Cobalt Cuivre Étain Fer Manganèse Mercure Molybdène Nickel Or Platine Plomb Tungstène Zinc Substances simples
salifiables
terreuses[21]Chaux Terre calcaire
ChauxMagnésie Magnésie
Base du sel d'EpsomBarite Barote
Terre pesanteAlumine Argile
Terre de l'alun
Base de l'alunSilice Terre siliceuse
Terre vitrifiable« Tableau des substances simples » publié par Antoine Lavoisier en 1789[22]. Les éléments chimiques y sont classés en quatre familles :
-
- Les éléments impondérables (gaz et autres « essences »)
- Les non-métaux
- Les métaux
- Les « terres », à savoir des minerais (oxydes, sulfates) considérés comme corps simples.
Le chlore est désigné comme « radical muriatique », car Lavoisier considérait que tous les acides étaient des oxoacides — le nom oxygène signifie étymologiquement « formant des acides » — et cherchait donc le « radical » que l'oxygène aurait rendu acide — l'acide muriatique désignait l'acide chlorhydrique, qui ne contient cependant pas d'oxygène.
Cette classification a surtout le mérite de clarifier certaines notions fondamentales, mais ne révèle encore aucune périodicité des propriétés des éléments classés : les métaux sont ainsi recensés tout simplement par ordre alphabétique en français.
Triades de Johann Döbereiner
La première tentative de classification moderne des éléments chimiques revient au chimiste allemand Johann Wolfgang Döbereiner qui, en 1817, nota que la masse atomique du strontium (88) était égale à la moyenne arithmétique des masses atomiques du calcium (40) et du baryum (137), qui ont des propriétés chimiques semblables (aujourd'hui, ils sont classés parmi les métaux alcalino-terreux). En 1829, il avait découvert deux autres « triades » de ce type : celle des halogènes (la masse atomique du brome (80) étant égale à la moyenne arithmétique (81) de celles du chlore (35,5) et de l'iode (127)) et celle des métaux alcalins (la masse atomique du sodium (23) étant égale à la moyenne arithmétique de celles du lithium (7) et du potassium (39)).
D'autres chimistes identifièrent d'autres séries d'éléments, et Leopold Gmelin publia en 1843 la première édition de son Handbuch der Chemie, qui mentionnait des triades, ainsi que trois « tétrades » et une « pentade » — azote, phosphore, arsenic, antimoine et bismuth, que nous connaissons aujourd'hui comme les éléments du groupe 15.
Tétrades de Jean-Baptiste Dumas
En 1859, le chimiste français Jean-Baptiste Dumas généralisa les triades de Döbereiner en les étendant en tétrades incluant les éléments les plus légers, définies non plus par les moyennes arithmétiques, mais par une progression similaire d'une tétrade à l'autre, par exemple :
Bien qu'en apparence similaire à celle de Döbereiner, l'approche de Dumas était potentiellement bien plus féconde car applicable de façon pertinente à un bien plus grand nombre d'éléments : alors que les progressions arithmétiques sont restreintes à quelques groupes d'éléments, l'incrément constaté par Dumas entre éléments successifs aux propriétés similaires mesure précisément la longueur de la période qui sépare ces deux éléments — incrément d'environ 16 entre les deux premiers éléments d'une tétrade, puis incrément d'environ 48 entre deuxième et troisième éléments, puis entre troisième et quatrième éléments.
Vis tellurique de Chancourtois
Le premier à remarquer la périodicité des propriétés chimiques des éléments fut le géologue français Alexandre-Émile Béguyer de Chancourtois lorsqu'il classa en 1862 les éléments chimiques alors connus en fonction de leur masse atomique déterminée en 1858 par le chimiste italien Stanislao Cannizzaro. Il normalisa la masse atomique de tous les éléments en prenant celle de l'oxygène égale à 16, et, considérant que « les propriétés des éléments sont les propriétés des nombres, » organisa les éléments chimiques en spirale sur un cylindre divisé en seize parties, de telle sorte que les éléments aux propriétés similaires apparaissent l'un au-dessus de l'autre.
Chancourtois remarqua alors que certaines « triades » se retrouvaient précisément alignées dans cette représentation, ainsi que la tétrade oxygène – soufre – sélénium – tellure, qui se trouvait également avoir des masses atomiques à peu près multiples de seize (respectivement 16, 32, 79 et 128). C'est la raison pour laquelle il appela cette représentation « vis tellurique, » en référence au tellure. C'était la première ébauche de classification périodique des éléments. Celle-ci ne retint cependant pas l'attention de la communauté scientifique, car Chancourtois n'était pas chimiste et avait employé des termes appartenant plutôt au domaine de la géochimie dans la publication qu'il avait adressée à l'Académie des sciences, laquelle fut éditée de surcroît sans ses schémas explicatifs, ce qui rendit le texte abscons.
D'un point de vue conceptuel, c'était une grande avancée, mais, d'un point de vue pratique, Chancourtois n'avait pas identifié la période correcte pour les éléments les plus lourds, de sorte que, dans sa représentation, une même colonne regroupait le bore, l'aluminium et le nickel, ce qui est correct pour les deux premiers mais totalement erroné d'un point de vue chimique pour le troisième.
Loi des octaves de John Newlands
Dans la foulée, le chimiste anglais John Alexander Reina Newlands publia en 1863 une classification périodique qui eut, elle, un plus fort retentissement (quoique tardif, et a posteriori), car il avait organisé les premiers éléments alors connus par masse atomique croissante — plus précisément, par masse équivalente croissante — dans un tableau à sept lignes en les arrangeant de telle sorte que leurs propriétés chimiques soient similaires par lignes, sans hésiter à placer deux éléments dans une même case si nécessaire pour éviter de laisser des cases vides par ailleurs.
Ce faisant, il avait identifié une nouvelle triade, dont les extrémités étaient le silicium et l'étain, et dont l'élément médian restait à découvrir : il prédit ainsi l'existence du germanium, en lui assignant une masse atomique d'environ 73. Mais la grande faiblesse de son travail était qu'il n'avait pas laissé de case vide dans son tableau pour accueillir notamment le futur germanium : il avait en fait cherché avant tout à classer les éléments connus dans un tableau complet sans chercher de classification plus large tenant compte de possibles éléments à découvrir, qu'il avait pourtant pressentis. De plus, comme Chancourtois, il avait un problème de périodicité, car si les éléments légers connus à l'époque avaient bien une périodicité chimique tous les sept éléments, cela cessait d'être valable au-delà du calcium, et le tableau de Newlands s'avère alors inopérant :
I. II. III. IV. V. VI. VII. VIII. 1 H F Cl Co & Ni Br Pd I Pt & Ir 2 Li Na K Cu Rb Ag Cs Tl 3 Be Mg Ca Zn Sr Cd Ba & V Pb 4 B Al Cr Y Ce & La U Ta Th 5 C Si Ti In Zr Sn W Hg 6 N P Mn As Di & Mo Sb Nb Bi 7 O S Fe Se Rh & Ru Te Au Os Tableau de John Newlands illustrant la « loi des octaves »[23], 1865. La mise en évidence d'une périodicité globale jusqu'au calcium était néanmoins une grande avancée, et Newlands présenta cette classification en l'appelant « loi des octaves » par analogie avec les sept notes de musique, mais ce travail fut assez mal accueilli par ses pairs de la Société de chimie de Londres, qui le tournèrent souvent en ridicule et firent obstacle à sa publication ; ce n'est qu'après la publication des travaux de Dmitri Mendeleïev que la qualité de cette analyse a été reconnue.
Notation d'éléments manquants par William Odling
Le chimiste anglais William Odling — secrétaire de la Société de chimie de Londres, et donc rival de Newlands — travaillait également, dans les années 1860, sur une table périodique des éléments chimiques remarquablement proche de celle que publierait Mendeleïev en 1869. Elle était organisée en périodes verticales avec des cases vides pour les éléments manquants et plaçait — à la différence du premier tableau de Mendeleïev — le platine, le mercure, le thallium et le plomb dans les bons groupes. Son action négative à l'encontre de Newlands entacha néanmoins définitivement la renommée d'Odling, et sa contribution à l'élaboration du tableau périodique des éléments est aujourd'hui largement méconnue.
Introduction de la valence avec Lothar Meyer
La contribution du chimiste allemand Lothar Meyer est à peine mieux reconnue que celle d'Odling, car ses travaux décisifs ont été publiés après ceux de Mendeleïev alors qu'ils étaient pour la plupart antérieurs. Il publia ainsi une première version de sa classification des éléments en 1864, puis finalisa en 1868 une seconde version plus aboutie qui ne fut intégralement publiée qu'à sa mort, en 1895.
Le premier tableau de Meyer comprenait vingt-huit éléments classés en six familles définies par leur valence : c'était un grand pas en direction de la forme moderne du tableau périodique, organisé en groupes dépendant de la configuration électronique des éléments, elle-même directement en relation avec leur valence ; ce n'était néanmoins pas encore le même tableau qu'aujourd'hui, car les éléments étaient toujours rangés par masse atomique croissante. Le second tableau de Meyer, qui élargissait et corrigeait le premier, fut publié en 1870, quelques mois après celui de Mendeleïev, dont il renforça l'impact sur la communauté scientifique en apportant aux thèses du chimiste russe, encore très contestées, le soutien de travaux indépendants. La grande force de ce travail résidait dans les périodes de longueur variable, avec une disposition des éléments qui permettait d'éviter les regroupemets fâcheux de Newlands, tels que le fer, l'or et certains éléments du groupe du platine parmi l'oxygène, le soufre, et les autres éléments du groupe 16 :
I. II. III. IV. V. VI. VII. VIII. IX. B = 11,0 Al = 27,3 ? ?In = 113,4 Tl = 202,7 ? ? ? C = 11,97 Si = 28 ? Sn = 117,8 Pb = 206,4 Ti = 48 Zr = 89,7 ? N = 14,01 P = 30,9 As = 74,9 Sb = 122,1 Bi = 207,9 V = 51,2 Nb = 93,7 Ta = 182,2 O = 15,96 S = 31,98 Se = 78 Te = 128? ? Cr = 54,4 Mo = 95,6 W = 183,5 ? F = 19,1 Cl = 35,38 Br = 79,75 I = 126,5 ? Mn = 54,8 Ru = 103,5 Os = 198,6 Fe = 55,9 Rh = 104,1 Ir = 196,7 Co = Ni = 58,6 Pd = 106,2 Pt = 196,7 Li = 7,01 Na = 22,99 K = 39,04 Rb = 85,2 Cs = 132,7 ? Cu = 63,3 Ag = 107,66 Au = 196,2 ?Be = 9,3 Mg = 23,9 Ca = 39,9 Sr = 87,0 Ba = 136,8 ? Zn = 64,9 Cd = 116,6 Hg = 199,8 Tableau périodique des éléments chimiques de Lothar Meyer[24], publié en 1870. Meyer avait également remarqué que si l'on trace une courbe représentant en abscisse la masse atomique et en ordonnée le volume atomique de chaque élément, cette courbe présente une série de maxima et de minima périodiques, les maxima correspondant aux éléments les plus électropositifs.
Classification périodique de Mendeleïev
 Tableau périodique de Mendeleïev, publié en 1870.
Tableau périodique de Mendeleïev, publié en 1870.
Malgré la qualité réelle des travaux de ses contemporains, c'est bien au chimiste russe Dimitri Ivanovich Mendeleïev qu'on doit le premier tableau périodique des éléments s'approchant de celui que nous utilisons aujourd'hui, non seulement dans sa forme mais surtout par la vision qui l'accompagne. A la différence de ses prédécesseurs, Mendeleïev a en effet formulé explicitement en quoi son tableau constituait un outil d'analyse théorique des propriétés de la matière :
- Les éléments chimiques, lorsqu'ils sont ordonnés par masse atomique croissante, montrent une périodicité de leur propriétés chimiques.
- Les éléments qui ont des propriétés chimiques semblables ont ou bien des masses atomiques semblables (osmium, iridium, platine par exemple) ou bien des masses atomiques croissant de façon arithmétique (potassium, rubidium, césium par exemple).
- La disposition des éléments ou des groupes d'éléments dans la table par masse atomique croissante correspond à leur valence et est en rapport, dans une certaine mesure, avec leurs propriétés chimiques.
- Les éléments les plus abondants dans le milieu naturel sont ceux qui ont la plus faible masse atomique.
- La valeur de la masse atomique détermine les propriétés des éléments chimiques.
- La masse atomique de certains éléments devrait parfois être revue, car le tableau est plus cohérent en réarrangeant certains éléments — typiquement, le tellure — sans tenir compte de leur masse atomique expérimentale.
- On doit s'attendre à découvrir des éléments inconnus au moment de la publication de ce tableau, par exemple des éléments analogues à l'aluminium et au silicium, avec une masse atomique comprise entre 65 et 75.
- Il est possible de prédire certaines propriétés des éléments à partir de leur masse atomique.
L'avancée était significative :
-
- Mendeleïv prédit ainsi l'existence d'une série d'éléments, dont il précisa certaines propriétés, à commencer par leur masse atomique :
- l'eka-bore (44), correspondant au scandium (45), découvert en 1879
- l'eka-aluminium (68), correspondant au gallium (69,7), découvert en 1875 — une réussite particulièrement brillante, car Mendeleïev avait prévu une densité de 6 g/cm3 et un bas point de fusion, les valeurs réelles étant 5,9 g/cm3 et 29,78 °C
- l'eka-silicium (72), correponsant au germanium (72,5), découvert en 1882 — là encore, avec un remarquable accord entre les observations et les propriétés physicochimiques prédites par Mendeleïev
- l'eka-manganèse (100), correspondant au technétium (99), découvert en 1937
- Il identifia par sa théorie une dizaine d'éléments dont la masse atomique avait été déterminée de façon incorrecte
- Il réorganisa sans le savoir certains éléments en fonction de leur numéro atomique et non de leur masse atomique
- Mendeleïv prédit ainsi l'existence d'une série d'éléments, dont il précisa certaines propriétés, à commencer par leur masse atomique :
Les travaux de Mendeleïev ont été accueillis avec scepticisme par ses pairs, mais la publication subséquente de plusieurs résultats similaires (ceux de John Newlands et de Lothar Meyer en particulier) obtenus de façon indépendante ont fait basculer le consensus en faveur de cette nouvelle vision des éléments chimiques.
Découverte de l'argon par William Ramsay et Lord Rayleigh
C'est en voulant mesurer avec précision la masse atomique de l'oxygène et de l'azote par rapport à celle de l'hydrogène que John William Strutt Rayleigh nota une divergence entre la masse atomique de l'azote produit à partir d'ammoniac et celle de l'azote séparé de l'air atmosphérique, légèrement plus lourd. Employant une méthodologie rigoureuse, William Ramsay parvint en 1894 à isoler l'argon à partir de « l'azote » atmosphérique, et expliqua l'anomalie apparente de la masse atomique de l'azote atmosphérique en déterminant la masse atomique de ce nouvel élément, pour lequel rien n'était prévu dans le tableau de Mendeleïev. Sa nature gazeuse et son inertie chimique l'avaient rendu jusqu'alors invisible aux chimistes.
La masse atomique de l'argon (un peu moins de 40) est très voisine de celle du calcium (un peu plus de 40) et donc supérieure à celle du potassium (39,1), ce qui posa quelques problèmes de classification car il semblait y avoir « plus de place » dans le tableau périodique entre le chlore et le potassium qu'entre le potassium et le calcium. Les choses se compliquèrent encore lorsque Ramsay et Morris Travers découvrirent le néon en 1898, matérialisant, avec l'hélium (découvert en 1868 par l'astronome français Jules Janssen et l'Anglais Joseph Norman Lockyer), le groupe nouveau des gaz rares (ou gaz nobles), appelé « groupe 0 » : la masse atomique du néon (20,2) était exactement intermédiaire entre celles du fluor (19) et du sodium (23). Ainsi, les gaz rares semblaient se positionner tantôt entre un métal alcalin et un métal alcalino-terreux, tantôt entre un halogène et un métal alcalin.
Rangement par numéro atomique avec Henry Moseley
A la suite de la découverte de l'électron et de celle des isotopes par l'Anglais Joseph John Thomson — qui ont accompagné les débuts de la physique de l'atome avec les travaux de l'Allemand Max Planck, du Néo-Zélandais Ernest Rutherford et du Danois Niels Bohr — les recherches du physicien anglais Henry Moseley sur la corrélation entre la charge du noyau atomique et le spectre aux rayons X des atomes ont abouti en 1913 au classement des éléments chimiques non plus par masse atomique croissante, mais par numéro atomique croissant. C'était une évolution majeure, qui résolvait toutes les inconsistances issues du classement en fonction de la masse atomique, lesquelles devenaient gênantes depuis les travaux de systématisation de Dmitri Mendeleïev.
L'argon était ainsi placé entre le chlore et le potassium, et non plus entre le potassium et le calcium, tandis que le cobalt était clairement positionné avant le nickel bien qu'il soit un peu plus lourd. Il confirma que le tellure devait être placé avant l'iode sans nécessiter de revoir sa masse atomique, contrairement à ce qu'avait suggéré Mendeleïev. Il releva également que les éléments de numéro atomique 43 et 61 manquaient à l'appel : l'élément 43 avait déjà été prédit par Mendeleïev comme eka-manganèse (il s'agit du technétium, radioactif, synthétisé en 1937) mais l'élément 61 était nouveau — il s'agit du prométhéum, radioactif également, isolé en 1947 :
O I II III IV V VI VII VIII A B A B A B A B A B A B A B 1
H2
He3
Li4
Be5
B6
C7
N8
O9
F10
Ne11
Na12
Mg13
Al14
Si15
P16
S17
Cl18
Ar19
K29
Cu20
Ca30
Zn21
Sc31
Ga22
Ti32
Ge23
V33
As24
Cr34
Se25
Mn35
Br26
Fe27
Co28
Ni36
Kr37
Rb47
Ag38
Sr48
Cd39
Y49
In40
Zr50
Sn41
Nb51
Sb42
Mo52
Te(43)
53
I44
Ru45
Rh46
Pd54
Xe55
Cs79
Au56
Ba80
Hg57-71
Ln81
Tl72
Hf82
Pb73
Ta83
Bi74
W84
Po75
Re(85)
76
Os77
Ir78
Pt86
Rn(87)
88
Ra89
Ac90
Th91
Pa92
U57
La58
Ce59
Pr60
Nd(61)
62
Sm63
Eu64
Gd65
Tb66
Dy67
Ho68
Er69
Tm70
Yb71
LuTableau périodique des éléments publié en 1913 par Henry Moseley[25]. Ce tableau, directement inspiré de celui de John Newlands, constituait l'étape intermédiaire conduisant à la disposition contemporaine. En particulier, la numérotation des groupes avec des chiffres romains de I à VIII, qui remontent à Newlands, et les lettres A et B, introduites par Moseley, était encore largement utilisée à la fin du XXe siècle :
I A II A III B IV B V B VI B VII B VIII I B II B III A IV A V A VI A VII A O 1
H2
He3
Li4
Be5
B6
C7
N8
O9
F10
Ne11
Na12
Mg13
Al14
Si15
P16
S17
Cl18
Ar19
K20
Ca21
Sc22
Ti23
V24
Cr25
Mn26
Fe27
Co28
Ni29
Cu30
Zn31
Ga32
Ge33
As34
Se35
Br36
Kr37
Rb38
Sr39
Y40
Zr41
Nb42
Mo(43)
44
Ru45
Rh46
Pd47
Ag48
Cd49
In50
Sn51
Sb52
Te53
I54
Xe55
Cs56
Ba57-71
Ln72
Hf73
Ta74
W75
Re76
Os77
Ir78
Pt79
Au80
Hg81
Tl82
Pb83
Bi84
Po(85)
86
Rn(87)
88
Ra89
Ac90
Th91
Pa92
U(93)
(94)
(95)
(96)
(97)
(98)
(99)
57
La58
Ce59
Pr60
Nd(61)
62
Sm63
Eu64
Gd65
Tb66
Dy67
Ho68
Er69
Tm70
Yb71
LuTableau périodique dans les années 1920-1930, suite aux travaux d'Henry Moseley[26] Il était identique au tableau actuel, hormis quant à la septième période.
Concept des actinides de Glenn Seaborg
Le physicien américain Glenn Theodore Seaborg contribua dès 1942 au projet Manhattan dans l'équipe du physicien italien Enrico Fermi. Il était chargé d'isoler le plutonium — que lui-même avait synthétisé et caractérisé en février 1941 — de la matrice d'uranium au sein de laquelle il se formait. C'est au cours de ce travail qu'il développa une connaissance approfondie de la chimie particulière de ces éléments. Il établit ainsi que leur position dans le tableau périodique (l'uranium était alors placé sous le tungstène et le plutonium sous l'osmium) ne rendait pas compte de leurs propriétés.
En 1944, il parvint à synthétiser et à caractériser l'américium et le curium (éléments 95 et 96), ce qui lui permit de formaliser le concept des actinides, c'est-à-dire d'une nouvelle série chimique aux propriétés spécifiques et formée des éléments 89 à 103, située sous les lanthanides dans le tableau périodique, qui prit ainsi sa configuration actuelle. Seaborg conjectura également l'existence des superactinides, regroupant les éléments 121 à 153 et situés sous les actinides.
Le tableau périodique utilisé de nos jours est celui remanié en 1944 par Seaborg.
Présentations alternatives
De très nombreuses présentations alternatives du tableau périodique ont été proposées tout au long du XXe siècle, et des présentations graphiques innovantes sont encore régulièrement proposées. L'une des plus anciennes et des plus simples est celle d'un autodidacte français par ailleurs inconnu, Charles Janet, qui a donné son nom à une disposition du tableau élaborée au début du XXe siècle et récemment redécouverte par les Anglo-saxons, chez lesquels elle est assez bien connue des spécialistes du sujet (sous les noms de Janet Form ou de Left-Step Periodic Table) car elle a le double mérite de rester familière et de disposer les éléments dans l'ordre naturel des blocs (de droite à gauche), à la différence du tableau usuel :
f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 s1 s2 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo Uue Ubn Tableau périodique organisé à la façon de Charles Janet[27]. Une autre représentation est celle de Theodor Benfey, datée de 1960, dont l'objectif était de remédier aux discontinuités du tableau standard à l'aide d'une représentation en spirale :
De nombreux modèles en trois dimensions ont également été proposés afin d'enrichir la représentation des éléments par diverses informations spécifiques, qu'on peut retrouver en suivant ce lien très complet.
Moyens mnémotechniques
Voir la section « Tableau périodique des éléments ».
Notes et références
- ↑ Elle était organisée en cinq colonnes comptant jusqu'à vingt éléments, mais surtout les éléments chimiques y étaient rangés par masse atomique croissante, et non en fonction de leur numéro atomique.
- ↑ Le GSI a proposé d'appeler cet élément Copernicium (14 juillet 2009) :
Helmholtz Association of German Research Centres, « 'Copernicium' proposed as name for newly discovered element 112 », dans PhysOrg.com, 14/07/2009 [texte intégral (page consultée le 14/07/2009)]
Une recommandation provisionnelle de l'UICPA préconise d'employer le symbole Cn : NAME AND SYMBOL OF THE ELEMENT WITH ATOMIC NUMBER 112 - ↑ Noter que le francium fond dès 26,9 °C, le césium dès 28,4 °C, le gallium dès 29,8 °C et le rubidium dès 39,3 °C, et qu'on peut avoir ces éléments liquides à température « ambiante » par surfusion.
- ↑ (en) W. C. Martin, Atomic, Molecular, & Optical Physics Handbook, American Institute of Physics, 1996
- ↑ Gas Phase Chemistry of Superheavy Elements : Conférence de Heinz W. Gäggeler, Novembre 2007 — Page consultée le 07/07/2009.
- ↑ Rapport 2008 du FLNR au JINR : « Chimie des éléments 112 et 114 », p. 87, accédé le 08/07/2009.
- ↑ "Chemistry of Hassium", 2002, Gesellschaft für Schwerionenforschung mbH. Consulté le 31 janvier 2007
- ↑ Indication d'un élément 112 gazeux
- ↑ Nuclear Shell Model : Table 1 – Nuclear Shell Structure, d'après Maria Goeppert Mayer & J. Hans D. Jensen dans « Elementary Theory of Nuclear Shell Structure », John Wiley & Sons Inc., New York, 1955.
- ↑ Notamment les théories de champ moyen et les théories MM.
- ↑ C. Samanta, P. Roy Chowdhury and D.N. Basu, « Predictions of alpha decay half lives of heavy and superheavy elements », dans Nucl. Phys. A, vol. 789, 2007, p. 142–154 [lien DOI]
- ↑ P. Roy Chowdhury, C. Samanta, and D. N. Basu, « Search for long lived heaviest nuclei beyond the valley of stability », dans Phys. Rev. C, vol. 77, 2008, p. 044603 [texte intégral lien DOI]
- ↑ P. Roy Chowdhury, C. Samanta, and D. N. Basu, « Nuclear half-lives for α -radioactivity of elements with 100 < Z < 130 », dans At. Data & Nucl. Data Tables, vol. 94, 2008, p. 781 [lien DOI]
- ↑ CEA Saclay – Spectroscopy of very heavy elements Slide #16 – Limit of stability: positron emission.
- ↑ Walter Greiner, Stefan Schramm, « Resource Letter QEDV-1: The QED vacuum », dans American Journal of Physics, vol. 76, no 6, 2008, p. 509-518(10) [texte intégral lien DOI (pages consultées le 26/06/2009)] avec notamment tout une liste de références à consulter sur le thème de l'électrodynamique quantique.
- ↑ Encyclopaedia Britannica : article « Transuranium Element », dont la brève section « End of Periodic Table » en fin d'article situe entre 170 et 210 la borne supérieure théorique au numéro atomique, et à Z ≈ 130 la limite d'observabilité des atomes.
- ↑ Par cette formule, Lavoisier entendait regrouper les substances « impalpables ».
- ↑ Lavoisier désigne ainsi indirectement le chlore.
- ↑ Il s'agit du fluor.
- ↑ Il s'agit du bore.
- ↑ Il s'agissait d'oxydes ou de sulfates d'éléments métalliques pour certains déjà connus de Lavoisier, qui soupçonnait d'ailleurs que certaines de ces « substances simples » fussent en réalité des substances composées de plusieurs éléments différents.
- ↑ CNRS – Œuvres de Lavoisier : Tableau des substances simples
- ↑ On the Law of Octaves : Chemical News volume 12, 18 août 1865, page 83.
- ↑ Extrait : Annalen der Chemie, Supplementband, 7, 354 (1870).
- ↑ Moseley's Periodic Law
- ↑ An early history of LBNL by Glenn T. Seaborg : Periodic table before World War II
- ↑ WebElements : The Janet Periodic Table.
Voir aussi
Articles connexes
Liens externes
- Site de l'Union internationale de chimie pure et appliquée :
- (fr) Tableau périodique dynamique Actualisé et très clair
- (fr) Le tableau périodique des éléments, sur le site de la Cité des sciences (néanmoins assez ancien et non mis à jour)
- (en) Quantum Mechanics Consistent Periodic Tables
- (en) (fr) (de) (it) (hr) (es) tableau périodique sur le site de la Faculté de technologie et de chimie de Split (Croatie).
- (en) Le tableau périodique vu par 96 artistes graveurs
- (fr) Tableau périodique, Astronoo
- Portail de la chimie
Catégories : Classification chimique | Atome
Wikimedia Foundation. 2010.