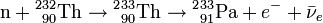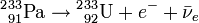- Thorium 233
-
Thorium
Le thorium est un élément chimique, un métal de la famille des actinides, de symbole Th et de numéro atomique 90.
Il a été découvert en 1829 par Jöns Jacob Berzelius et nommé d'après Thor, dieu scandinave du tonnerre.
Ses principales applications sont dans les alliages de magnésium utilisés pour les moteurs d'aéronefs. Il a un énorme potentiel comme combustible nucléaire, mais cette voie est encore en cours d'exploration (avec les centrales HTR).
Sommaire
Historique
Le thorium a été découvert sous forme d'un minéral noir sur l'île de Løvøy, en Norvège, par M. T. Esmark. Il en envoya un échantillon au professeur Jens Esmark, minéralogiste distingué, qui ne fut pas en mesure de l'identifier, et en envoya un échantillon au Chimiste suédois Jöns Jakob Berzelius pour examen en 1828. [1] Berzelius en fit l'analyse, et nomma le nouvel élément Thorium, d'après Thor, dieu scandinave du tonnerre.
Ce nouveau métal resta pratiquement inutilisé jusqu'à l'invention du manchon à incandescence en 1885.
Entre 1900 et 1903, Ernest Rutherford et Frederick Soddy démontrèrent que le thorium se désintègre suivant une loi de décroissance exponentielle en une série d'autres éléments. Ce constat conduisit à identifier la demi-vie comme l'une des caractéristiques importantes associées aux particules alpha, expériences qui les conduirent à leur théorie de la radioactivité.[2]
La méthode de la zone fondue, découverte par Anton Eduard van Arkel et Jan Hendrik de Boer en 1925, permit de produire du Thorium métallique de haute pureté.[3]
Au début de l'étude de la radioactivité, le nom de ionium avait été donné à l'isotope 230Th isotopique, trouvé dans la chaîne de désintégration de 238 U, avant que l'on ne réalise que ionium et thorium sont chimiquement identiques. Cet hypothétique élément reçut le symbole Io.
Propriétés
Physique et chimie
Lorsqu’il est pur, le thorium est un métal gris-blanc qui conserve son lustre pendant plusieurs mois, grâce à l'oxyde qui le protège. Toutefois, quand il est exposé à l'oxygène, le thorium ternit lentement dans l'air, devient gris et finalement noir.
→ L'oxyde de thorium (ThO2) est un des meilleurs matériaux réfractaires avec une température de fusion de 3 300 °C[4].Le Thorium métal en poudre est souvent pyrophorique et doit être manipulé avec soin. Chauffé dans l'air, des copeaux de thorium peuvent s'enflammer et brûler brillamment avec une lumière blanche.
Le thorium est l'élément qui a la plus grande plage de température pour son état liquide : 3033 K entre son point de fusion et son point d'ébullition (à pression atmosphérique).
Radionucléide
Le thorium 232 est un isotope fertile : en absorbant un neutron, il se transmute en thorium 233 (radioactif), qui se désintègre ensuite en protactinium 233 (radioactif), qui se désintègre à son tour en uranium 233, fissile.
Tous les isotopes du thorium sont radioactifs. Le thorium naturel n'est constitué que du seul isotope, le thorium 232, à très longue période radioactive (14 milliards d'années).
Son activité massique[5] est de 4,10.103 Bq.g-1
Radiotoxicité
Le Thorium naturel se désintègre plus lentement que la plupart des autres matières radioactives, et les rayonnement alpha émis ne peuvent pas pénétrer la peau humaine. La détention et la manipulation de petites quantités de thorium, comme celle contenue dans un manchon à incandescence, est considéré comme non dangereuse tant que l'on prend soin de ne pas ingérer le thorium - les poumons et les autres organes internes peuvent être atteints par les rayonnement alpha. Une exposition à un aérosol de thorium peut conduire à une augmentation du risque de cancer du poumon, du pancréas et du sang. Une ingestion de thorium conduit à une augmentation du risque de maladies du foie.
Cet élément n'a pas de rôle biologique connu. Il est parfois utilisé comme medium de contraste pour les radiographies.
La chaîne de désintégration du Thorium produit du « thoron » (220Rn), qui est un émetteur alpha et présente un risque radiologique. Comme pour tous les isotopes du radon, son état gazeux le rend susceptible d'être facilement inhalé. Une bonne ventilation des zones où le thorium est stocké ou manipulé est donc essentielle.
Géologie et minéralogie
Abondance et gisements
Faiblement radioactif, le thorium 232 se désintègre très lentement (sa demi-vie est environ trois fois l'âge de la terre, 14,05×10^9 a). Le thorium se trouve en petites quantités dans la plupart des roches et sols, il est environ trois fois plus abondant que l'uranium, à peu près aussi fréquent que le plomb. Un terrain normal contient en moyenne environ 12 parties par million (ppm) de thorium.
Le thorium se rencontre dans plusieurs minéraux. Les minerais de thorium sont la thorite ThSiO4, la thorianite ThO2 et surtout la monazite (Ce,La,Nd,Th)PO4, le plus commun, phosphate de thorium et de terre rare, qui peut contenir jusqu'à environ 12% d'oxyde de thorium.
Il en existe de grands gisements en Bretagne, en Australie, en Inde et en Turquie. On trouve de la monazite à forte teneur en thorium en Afrique, en Antarctique, en Australie, en Europe, en Amérique du Nord et en Amérique du Sud. [6]
D'autres isotopes du thorium se rencontrent à l'état de traces, dans la chaîne de désintégration du thorium (le 228Th, 1,91 an) de l'uranium 238 (le 230Th, 75 000 ans) et de l'uranium 235 (le 231Th, 25,2 h). Leur courte durée de vie entraîne une activité massique importante, et les rend beaucoup plus radioactif que 232Th; mais en masse, ils sont d'une abondance négligeable.
Extraction minière
Le thorium est principalement extrait de la monazite, par un traitement en plusieurs étapes. Dans un premier temps, le sable de monazite est dissous dans un acide inorganique tels que l'acide sulfurique (H 2SO4). Dans un deuxième temps, le thorium est extrait dans une phase organique contenant une amine. Ensuite, il est séparé à l'aide d'ions tels que les nitrates, chlorure, hydroxyde ou carbonate, ce qui fait passer à nouveau le thorium en phase aqueuse. Enfin, le thorium est précipité et recueilli. [7]
Utilisation
Le thorium a de nombreuses applications industrielles:
- électrode, cathode : le thorium possède un travail de sortie bas, ce qui permet une intense émission d'électrons par émission thermoïonique. Pour cette raison on l'utilise dans les électrodes de tubes à décharge en revêtement des filaments de tungstène, ainsi que pour les cathodes de nombreux dispositifs électroniques.
- verres optiques : dans la fabrication de lentilles de qualité pour les appareils photo et des instruments scientifiques. Le verre contenant de l'oxyde de thorium a un indice de réfraction élevé et une faible dispersion, ce qui diminue l'aberration optique.
- manchon à incandescence : on utilise la très mauvaise conductivité thermique de l'oxyde de thorium (en mélange avec l'oxyde de cérium) pour augmenter la température des manchons d'éclairage et donc leur luminosité.
- produit réfractaire (creuset) : Pour les applications à haute température de matériau céramique, par addition d'oxyde de thorium, on obtient un type de porcelaine très dure et résistante aux températures élevées.
- Comme agent d'alliage dans les structures en acier. On l'utilise également pour faire des électrodes de soudage, en alliage de tungstène qui a le plus grand point de fusion connu, près de 4000°.
- Il est utilisé dans l'industrie électronique comme détecteur d'oxygène.
- Il est utilisé en chimie comme catalyseur dans la transformation de l'ammoniac dans l'acide nitrique, dans l'industrie pétrolière pour le cracking et l'extraction d'hydrocarbures de carbone, et pour la production industrielle d'acide sulfurique.
De plus, il est prometteur pour ses applications à l'énergie nucléaire : l'abondance (terrestre) du thorium 232 est 3 à 4 fois plus grande que celle de l'uranium 238[8](l'autre isotope naturel fertile). Le thorium constitue ainsi une importante réserve d'énergie nucléaire, en raison de son abondance ; il pourrait ainsi fournir plus d'énergie que l'uranium, le charbon et le pétrole réunis. Son utilisation nécessite la mise au point d'une nouvelle filière de réacteurs nucléaires surgénérateurs.
Industrie nucléaire
Isotope fertile
Le Thorium, ainsi que l'uranium et le plutonium, peut être utilisé comme combustible dans un réacteur nucléaire. Bien qu'il ne soit pas fissible lui-même, 232 Th est un isotope fertile comme l'uranium-238. En réacteur, il absorbe un neutron thermique pour produire un atome d'uranium-233, qui est fissible.
Le 232Th absorbe un neutron pour devenir 233Th qui, en principe, émet un électron et un antineutrino (
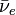 ) par radioactivité β- pour se transformer en protactinium-233 (233Pa), lequel émet encore électron et anti-neutrinos par une deuxième radioactivité β- pour se transformer en uranium-233(233U):
) par radioactivité β- pour se transformer en protactinium-233 (233Pa), lequel émet encore électron et anti-neutrinos par une deuxième radioactivité β- pour se transformer en uranium-233(233U):Le combustible irradié peut ensuite être déchargés du réacteur, l'Uranium-233 séparé du thorium (ce qui est un processus relativement simple puisqu'il s'agit d'une séparation chimique et non d'une séparation isotopique), et réinjecté dans un autre réacteur dans le cadre d'un cycle du combustible nucléaire fermé.
Cycle du thorium
En tant que produit fissile, 233U présente de meilleures propriétés que les deux autres isotopes fissiles utilisées dans l'industrie nucléaire, l'uranium-235 et le plutonium-239. Avec des neutrons lents, il fissionne en donnant plus de neutrons par neutron absorbé (en revanche, dans les réacteurs à neutrons rapides, le rendement neutronique du plutonium-239 augmente considérablement, dépassant celui du thorium). A partir de matières fissibles (U-235 ou Pu-239) il est possible de l'utiliser dans un cycle surgénérateur plus efficace que celui actuellement possible avec le plutonium ou l'uranium.
Les problèmes d'un tel cycle sont :
- le coût élevé de fabrication du combustible, nécessitant un cycle externe avec une source de neutrons pour créer l'233U (réacteur hybride ou ADS "Accelerator driven system" );
- des problèmes similaires sur le recyclage, en raison du thorium hautement radioactif 228Th (qui n'est pas transformé en U-233 et s'accumule au fil des cycles) ;
- un certain caractère proliférant de 233U (ce qui est le cas de toutes les matières fissibles) ;
- des problèmes techniques dans le retraitement non encore résolu de façon satisfaisante.
D'importants travaux de développement seront encore nécessaires avant que le cycle du combustible thorium ne puisse être exploité commercialement et cet investissement ne semble pas attractif tant que l'uranium est disponible en abondance.
Néanmoins, le cycle du combustible nucléaire à base de thorium bénéficie de solides atouts à long terme et est donc un facteur clé dans l'énergie nucléaire durable :
- il présente l'avantage de ne pas nécessiter de réacteur à neutrons rapides pour faire de la surgénération ;
- le cycle du combustible ne créé que peu de plutonium et d'actinides mineurs et génère par conséquent des déchets radioactifs beaucoup plus faciles à gérer ;
- la contamination de la matière fissile 233U par des traces de 232U, émetteur de rayonnement gamma très énergétique, rend celle-ci beaucoup plus facilement détectable, ce qui facilite le contrôle de la non-prolifération nucléaire ;
- le thorium est beaucoup plus abondant que l'uranium.
L'un des premiers essais du cycle du thorium a eu lieu à Oak Ridge dans les années 1960. Un réacteur à sel fondu expérimental a été construit pour étudier la faisabilité d'une telle approche en utilisant un sel de fluorure de thorium suffisamment chaud pour être liquide ce qui éliminait le besoin de fabriquer des éléments combustibles. L'expérience utilisait du Thorium-232 comme élément fertile et de l'uranium-233 comme combustible fissile. Le programme a été interrompu en 1976 faute de crédits.
Contrôle des matières nucléaires
Article détaillé : Contrôle des matières nucléaires.Le thorium est une matière nucléaire dont la détention est réglementée (Article R1333-1 du code de la défense).
Références
- ↑ Thorium, BBC.co, 2007-01-18
- ↑ Simmons, John, Le scientifique 100, 1996, Seacaucus NJ: Carol.
- ↑ van Arkel, AE, et Boer, JH: Préparation de titane, de zirconium, hafnium, et le thorium métal. Zeitschrift für Anorganische und Allgemeine Chemie, vol. 148, pp 345-350, 1925
- ↑ Emsley John, Nature's Building Blocks, Oxford University Press 2001, ISBN 0198503407
- ↑ Fiche Tritium de l'IRSN
- ↑ Http://www.mindat.org/min-2751.html
- ↑ Crouse, David Brown, Keith (Décembre 1959) "sessid = 6006l3 l'AMEX processus d'Extraction de minerais de thorium avec Alkyl Amines ". Industrial & Engineering Chemistry51 '(12): 1461. Récupérée sur 2007-03-09
- ↑ Actualités - Le Thorium
Liens externes
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
- Portail de l’énergie
Catégories : Élément chimique | Actinide | Matériau nucléaire
Wikimedia Foundation. 2010.