- Fièvre du Nil occidental
-
Virus du Nil occidental
Virus du Nil occidental
Virus du Nil occidental au microscope Classification classique Règne Virus Groupe Groupe IV Famille Flaviviridae Genre Flavivirus Espèce Virus du Nil occidental 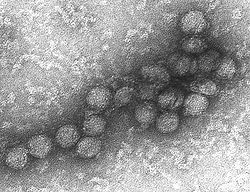
Virus du Nil occidental
au microscope électroniqueParcourez la biologie sur Wikipédia : Fièvre du Nil Occidental
Classification et ressources externesCIM-10 A92.3 CIM-9 066.3 DiseasesDB 30025 MeSH D014901 Le Virus du Nil occidental (en anglais : West Nile Virus) est un virus de la famille des flaviviridae et du genre Flavivirus. (qui comprend également le virus de la fièvre jaune, le virus de la dengue, le virus de l'encéphalite de Saint Louis et le virus de l'encéphalite japonaise). On le retrouve à la fois dans les régions tropicales et les zones tempérées.
Son nom vient du district de West Nile en Ouganda où il a été isolé pour la première fois en 1937 chez une femme souffrant d'une forte fièvre. Il a ensuite été détecté chez des hommes, des oiseaux et des moustiques en Égypte dans les années 1950, et a depuis été retrouvé chez l'homme ou l'animal dans divers pays.
Il infecte principalement les oiseaux, mais on a la preuve qu’il peut infecter, outre les hommes, les chevaux, les chiens, les chats, les chauve souris, les tamias, les mouffettes, les écureuils et les lapins domestiques. La principale voie d'infection de l’homme est la piqûre d'un moustique infecté.
Les reconstructions d'image et la microscopie électronique révèlent un virion de 45-50 nm recouvert d'une protéine de surface relativement lisse. Cette structure est similaire à celle du virus de la dengue, appartenant comme lui au genre des Flavivirus au sein de la famille des Flaviviridae. Le matériel génétique du virus du Nil occidental est constitué d’un seul brin d’ARN, à polarité positive, qui comprend entre 11.000 et 12.000 nucléotides.Ses gènes codent sept protéines non structurelles et trois protéines de structure. Le brin d'ARN est contenu dans une nucléocapside formée de fragments de protéines de 12 uma, la capside est contenue dans une membrane produite par l’hôte et modifiée par deux glycoprotéines virales.
Symptômes
Le virus du Nil occidental peut se manifester de trois façons différentes sur les humains. La première est une infection asymptomatique chez la grande majorité des gens qui ne présentent aucun trouble apparent, la seconde est un discret syndrome fébrile, semblable à la grippe, connu sous le nom de fièvre du Nil Occidental,[1] la troisième enfin, est une maladie neuroinvasive appelée méningite ou encéphalite du Nil occidental.[2] Chez les nombreuses personnes infectées le ratio entre les trois états est à peu près de 110:30:1. [3]
Dans la seconde éventualité, l’épisode fébrile apparaît après une période d'incubation de 3 à 6 jours. Il se caractérise par la survenue, accompagnée de maux de tête et de dos, de frissons, de sueurs, de douleurs musculaires, d'un gonflement des ganglions du cou, d'une toux, et de symptômes respiratoires. En plus de ce syndrome grippal, il existe parfois une brève éruption cutanée et certains patients présentent des symptômes gastro-intestinaux avec des nausées, des vomissements, une perte d'appétit ou des douleurs abdominales, ainsi que de la diarrhée. Tous les symptômes sont spontanément résolutifs en 7 à 10 jours, mais la fatigue peut se prolonger pendant plusieurs semaines et les adénopathies persister jusqu’à deux mois.
Dans moins de 15% des cas, des complications peuvent survenir telles que méningites, encéphalites, ou autres.
L'encéphalite qui est la forme la plus grave se manifeste par des symptômes similaires aux précédents mais aussi par une baisse de la vigilance, pouvant aller jusqu’à un état comateux. Les réflexes ostéo-tendineux sont d'abord vifs, puis abolis. Il existe également des troubles extrapyramidaux. La récupération est marquée par une longue période de convalescence avec une grande fatigue.
La survenue de flambées récentes a conduit à une étude plus approfondie de la maladie et d'autres formes, plus rares, ont été identifiées. La moelle épinière peut être infectée, avec apparition d’une myélite antérieure avec ou sans encéphalite. [4] Une association avec le syndrome de Guillain-Barré a été identifiée[5] et parmi d'autres effets rares on a observé une choriorétinite multifocale (qui possède une spécificité à 100% pour l'identification d’une infection par le virus du Nil Occidental chez les patients atteints d'encéphalite),[6] une hépatite, une myocardite, une néphrite, une pancréatite et une splénomégalie.[7][8][9]
Taux de mortalité
Généralement le malade récupère spontanément, parfois avec des séquelles, mais la maladie peut s'avérer mortelle, chez les personnes âgées ou immunodéprimées dans 3 à 15% des cas.
Aux États-Unis en 2007, sur un total de 3630 cas d'infection par le virus du Nil Occidental avec maladie neuro-invasive, 124 décès ont été signalés. [10] Cela signifie que pour les infections sévères, on observe 3,4% de décès et que le taux de mortalité général a été probablement largement inférieur à 4% puisque la plupart des cas sont bénins.
Transmission et réceptivité
Transmission
 Trompe d'un moustique Aedes albopictus se nourrissant de sang humain. Dans des conditions expérimentales, le moustique Aedes albopictus (également connu sous le nom de moustique tigre asiatique) a été identifié comme le vecteur du virus du Nil occidental.
Trompe d'un moustique Aedes albopictus se nourrissant de sang humain. Dans des conditions expérimentales, le moustique Aedes albopictus (également connu sous le nom de moustique tigre asiatique) a été identifié comme le vecteur du virus du Nil occidental.
Le virus est transmis par les moustiques vecteurs, et en particulier les Culex, qui sont les principaux vecteurs du virus du Nil occidental, lorsqu’ils piquent les oiseaux et les infectent. Tous les facteurs favorisant la pullulation des moustiques (pluies abondantes, irrigation, températures plus élevées que la normale...) sont susceptibles d'augmenter l'incidence de la fièvre liée à ce virus dans les secteurs géographiques où il circule.
Les principaux hôtes sont les oiseaux, qu'ils soient sauvages ou domestiques (canards, pigeons...), car ils jouent un rôle crucial dans la dissémination de ce virus. Les oiseaux migrateurs permettent notamment le passage du virus de l'Afrique aux zones tempérées d'Europe et d'Asie au printemps. Une fois arrivés, les moustiques locaux s'infectent lorsqu'ils piquent ces oiseaux pour leur repas de sang, disséminant sur d'autres oiseaux sains le virus et perpétuant le cycle moustiques/oiseaux essentiel à la circulation du virus.
Les oiseaux sont des hôtes amplificateurs, développant une charge virale suffisante pour transmettre l'infection à d'autres moustiques piqueurs qui vont infecter d'autres oiseaux (dans l’hémisphère Ouest, le merle d'Amérique et la corneille d'Amérique sont les porteurs les plus fréquents) ainsi que les êtres humains. Les espèces de moustiques infectés varient selon les zones géographiques, aux Etats-Unis Culex pipiens (Est des États-Unis), Culex tarsalis (Middle Ouest et Ouest) et Culex quinquefasciatus(Sud-Est) sont les principales sources de contamination. [11]
Les mammifères (bétail, chiens, chats, chevaux, humains ...) sont quant à eux considérés comme des hôtes accidentels du virus.
Chez les mammifères, le virus ne se multiplie pas aussi facilement (à savoir qu’il ne développe pas une virémie élevée lors de l'infection), et on croit que les moustiques piquant les mammifères infectés n’ingèrent pas une quantité de virus suffisante pour être infectés, [12] faisant des mammifères ce qu’on appelle une impasse pour l'infection.
Un article paru 2004 dans Science a révélé que les moustiques Culex pipiens étaient répartis en deux populations en Europe, une qui pique les oiseaux et une qui pique l'homme. En Amérique du Nord 40% des Culex pipiens se sont révélés être des hybrides des deux types, ceux qui piquent les oiseaux et ceux qui piquent les humains, fournissant ainsi un vecteur pour le virus du Nil Occidental. Ce fait est censé fournir une explication des raisons pour lesquelles la maladie du Nil occidental s'est propagée plus rapidement en Amérique du Nord qu'en Europe. [13] Toutefois, ces conclusions ont été contestées.[14]
Réceptivité
On a d’abord cru que transmission directe d’homme à homme ne se rencontrait qu’à la suite d’une exposition professionnelle,[15] ou d’une projection de sang infecté sur les conjonctives. [16] La flambée survenue aux États-Unis a révélé de nouveaux modes de transmission, par la transfusion sanguine, [17] la transplantation d'organe,[18]l’exposition intra-utérine du foetus, [19] et l'allaitement. [20]
Les infections par le virus du Nil Occidental les plus graves sont clairement associées à un âge avancé [21] et aux antécédents du patient, transplantation d'organes [22] et diabète. Un facteur génétique semble également augmenter la susceptibilité à la maladie du Nil occidental. Une mutation du gène CCR5 donne une certaine protection contre le VIH, mais conduit à une plus grande susceptibilité aux complications les plus graves au cours d'infection par le virus du Nil Occidental. Les porteurs de deux copies mutées du CCR5 représentaient 4 à 4,5% d'un échantillon de personnes souffrant de la maladie du Nil occidental, tandis que la fréquence du gène dans la population générale n'est que de 1%.[23][24]
Récemment, le potentiel infectant de la salive des moustiques salive pour la transmission du virus du Nil Occidental a été démontrée. [25][26][27] Les moustiques inoculent leur salive dans la peau tout en aspirant le sang. La salive des moustiques est un cocktail pharmacologique de molécules, principalement des protéines, qui peuvent affecter la constriction vasculaire, la coagulation sanguine, l’agrégation plaquettaire, l’inflammation et l’immunité. Il est devenu clair que la salive de moustiques modifie la réponse immunitaire d'une manière qui peut être favorable au virus. [28][29][30][31] des études ont montré qu'il peut moduler spécifiquement la réponse immunitaire au début de l’infection virale, [32]et le processus d'alimentation du moustique peut aggraver l'infection par le virus débouchant sur un accroissement de la virémie et l’évolution vers des formes plus sévères de la maladie. [25][26][27] On ne sait pas quel est l'avantage, le cas échéant, que le moustique retire en aidant ainsi le virus, il est donc probable que le virus exploite tout simplement les qualités préexistantes de la salive du moustique développées à d'autres fins.
On ne dispose pas de vaccin pour les humains. Il existe un vaccin pour les chevaux préparé à partir de virus tués et certains Zoos ont administré ce vaccin à leurs oiseaux, mais son efficacité n’est pas encore démontrée. Les chiens et les chats montrent peu ou pas de signes d'infection. Il n'existe aucun cas connu de transmission directe du chien ou du chat à l'homme, bien que ces animaux puisent être infectés, il est peu probable qu'ils soient à leur tour capables d'infecter des moustiques indigènes, perpétuant ainsi le cycle de la maladie.[33]
Eviter les piqûres de moustiques est le moyen le plus simple de prévenir l'infection :[34] rester à l'intérieur (tout en empêchant les moustiques d’entrer), à l'aube et au crépuscule, porter des vêtements de couleur qui couvrent les bras et les jambes ainsi que le tronc, utiliser un répulsif sur la peau et les vêtements (comme le N,N-diéthyl-3-méthylbenzamide, la picaradine, ou l'huile de corymbia citriodora pour la peau et la perméthrine pour les vêtements). [35] Si l'on est infecté, en général, le traitement est purement symptomatique : analgésique contre la douleur en cas d’atteinte neurologique, réhydratation en cas de nausées, de vomissements ou de diarrhée; l’encéphalite peut également nécessiter une protection des voies respiratoires et la prévention des crises convulsives.
Le nombre de cas signalés aux Etats-Unis en 2005 a dépassé celui de 2004 et le niveau de 2006 a dépassé celui de 2005. Le 19 août , 2006, le Los Angeles Times a rapporté que le taux d'incidence attendue de la maladie du virus du Nil Occidental chutait au fur et à mesure que la population locale était davantage exposée au virus. "Dans des pays comme l'Egypte et l'Ouganda, où le virus du Nil occidental a été détecté pour la première fois, les gens ont été pleinement immunisés contre le virus au moment où ils ont atteint l'âge adulte", selon les autorités sanitaires fédérales.[36] Toutefois, quelques jours plus tard, le CDC déclarait que le virus du Nil occidental pourrait atteindre un niveau élevé au bout de trois ans parce que l’élévation des températures avait permis l’éclosion d’une quantité plus importante de moustiques. [37]
Histoire
Selon des chercheurs américains, l'épidémiologiste John Marr et le microbiologiste Charles Calisher, le conquérant Alexandre le Grand aurait été victime, non pas du paludisme ou de la fièvre typhoïde, mais du virus du Nil occidental. [38] Ils fondent leur hypothèse sur une relecture du récit de l'auteur grec Plutarque et de ceux des autres historiens contemporains au décès du jeune empereur de 32 ans.
Jusqu'à présent, il était communément admis que sa mort avait été causée, à son retour du sous-continent indien, soit par un empoisonnement, soit par une des nombreuses maladies infectieuses qui sévissaient alors en Mésopotamie. Au moment de pénétrer dans Babylone, il éprouva les premiers signes de sa mystérieuse maladie, avant de succomber deux semaines plus tard, épuisé par la conjonction d'une fièvre croissante et d'un grand affaiblissement qui dégénérera en encéphalopathie.
La nouvelle hypothèse se fonde sur l’existence de cas rapportés de mortalité aviaire survenus avant la maladie d’Alexandre [39]
Dans Les vies des hommes illustres, Plutarque raconte : « Lorsque Alexandre fut près des murs de la ville, il vit plusieurs corbeaux qui se battaient avec acharnement et il en tomba même quelques-uns à ses pieds ». Selon les chercheurs, cette observation qui jusqu'à présent était passée inaperçue, rappelle étrangement les nombreux décès d'oiseaux observés en 1999, au Zoo du Bronx ou au Wildlife Conservation Park à New York, quelques semaines avant la survenue des premiers cas humains de fièvre causée par le virus du Nil occidental.
La Mésopotamie, région de l'Irak actuel, régulièrement inondée par les crues du Tigre et de l'Euphrate, est un havre de choix pour le moustique Culex. Cependant certains détracteurs objectent que les épidémies de fièvre sont actuellement seulement observées au mois de juillet alors qu'Alexandre le Grand est décédé au mois de mai. Il est quand même à noter que certaines années les premiers cas apparaissent dès le mois de juin.
Les études de lignées phylogénétiques ont déterminé que le virus du Nil Occidental a émergé comme virus distinct, il y a environ 1000 ans.[40] Ce virus initial a évolué vers deux lignées distinctes, la lignée 1 et ses multiples variantes est la source de la transmission de l'épidémie en Afrique et partout dans le monde, tandis que la lignée 2 reste une zoonose purement Africaine.
Le virus du Nil Occidental a été isolé pour la première fois chez une femme Omogo fiévreuse âgée de 37 ans dans la région du Nil Occidental de l’Ouganda en 1937 lors de recherches sur le virus de la fièvre jaune.[41] Une série de tests sérologiques réalisés en 1939 en Afrique centrale ont trouvé des résultats positifs pour les anticorps contre le virus allant de 1,4% (Congo) à 46,4% (région du Nil Blanc, au Soudan). Il a ensuite été identifié en Égypte (1942) et en Inde (1953), une enquête sérologique en 1950 en Egypte a révélé que 90% des habitants âgés de plus de 40 ans présentaient des anticorps contre le virus. L'écologie a été caractérisée en 1953 par des études en Égypte [42] et Israël.[43] Le virus a été identifié comme une cause possible de graves méningo-encéphalite chez les patients âgés, durant une épidémie survenue en Israël en 1957. Cette maladie a été observée chez les chevaux en Egypte et en France au début des années 1960 et s’est révélée largement répandue en Europe du Sud, Asie du sud-ouest et Australie.
La première apparition du virus du Nil Occidental dans l'hémisphère occidental date de 1999 avec des cas d'encéphalite signalés chez les humains, les chiens, les chats et les chevaux, et la propagation ultérieure aux États-Unis, épisode qui constituera sans doute un jalon important dans l'histoire évolutive de ce virus. La flambée américains a commencé dans la zone de New York (plus particulièrement, College Point, dans le Queens) et le virus a été retrouvé plus tard au New Jersey et au Connecticut . La maladie est censée avoir été transmise par un oiseau infecté ou des moustiques, bien qu'il n'existe aucune preuve évidente. [44]Le virus des États-Unis était très étroitement apparenté à une souche de lignée 1 découverte en Israël en 1998. Depuis les premiers cas en Amérique du Nord en 1999, le virus a été signalé partout aux États-Unis, au Canada, au Mexique, aux Caraïbes et en Amérique centrale. Il y a eu des cas humains et chez les chevaux, et de nombreux oiseaux ont été infectés. Le Macaque berbère, Macaca sylvanus a été le premier primate non-humain à contracter le virus du Nil Occidental.[45] Les souches américaines et israéliennes sont toutes les deux remarquables par des taux de mortalité élevés dans les populations aviaires infectées, la présence d'oiseaux morts, surtout des corvidés, pouvant être un indicateur précoce de l'arrivée du virus.
Par le biais d’un cirque médiatique le public a été sensibilisé au virus du Nil Occidental en 2001/2002. Cette couverture journalistique a été vraisemblablement le résultat d'apparitions successives du virus dans de nouvelles zones, et a eu pour effet involontaire d'augmenter le financement de la recherche sur ce virus et le domaine connexe des virus transmis par les arthropodes. Ces recherches ont amélioré notre connaissance des virus transmis par les moustiques.
Mécanismes d’hivernage
La transmission verticale du virus du Nil occidental par des femelles de moustiques Culex pipiens à leur descendance a été démontrée en laboratoire. Il a été suggéré que les Culex infectés verticalement pouvaient survivre à l'hiver pour relancer un cycle d'amplification du virus, le printemps suivant. Les moustiques Culex passent l'hiver en hibernation dans les structures protégées telles que les silos à légumes, les granges, les grottes, les tunnels abandonnés et autres lieux souterrains. Les premiers moustiques adultes présentant après hivernage un test positif pour le virus ont été découverts à New York, en 2000. Depuis lors, des échantillons positifs ont été identifiés dans le New Jersey, en 2003 et en Pennsylvanie, en 2003, 2004 et 2005. [46]
Distribution géographique
Dans les zones tempérées, les cas d'encéphalites dus à ce virus se produisent généralement en fin d'été ou au début de l'automne. Dans les autres régions plus chaudes, le virus est susceptible d'être transmis tout au long de l'année.
Des cas humains de fièvre, liés au virus du Nil occidental, ont été rapportés en Afrique, au Moyen-Orient, en Inde, en Europe, en Océanie (sous-type Kunjin) et, plus récemment sur le continent américain, où une première épidémie s'est déclarée dans la ville de New York en 1999.
De récentes flambées d'encéphalite à virus du Nil Occidental chez les humains ont eu lieu en Algérie (1994), Roumanie (1996 à 1997), République tchèque (1997), République démocratique du Congo (1998), Russie (1999), Etats-Unis (1999 à 2009), Canada (1999-2003), et Israël (2000).
Les épizooties de la maladie chez les chevaux se sont produites au Maroc (1996), en Italie (1998), aux Etats-Unis (1999 à 2001), et en France (2000). En 2003, le virus du Nil occidental s’est propagé chez les chevaux au Mexique.
Aux Etats-Unis en 2008, le virus du Nil Occidental a été isolé chez des animaux dans 47 Etats des USA et à Porto Rico. 45 Etats ont signalé des cas humains en 2008, le Maine l’Alaska et Hawaï étant les seuls états n'ayant jamais présenté de cas humain. (le Maine a recensé des cas occasionnels chez les animaux.)[47]
Dans le sud de la France, la première épidémie humaine décrite a eu lieu en 1962 avec 50 cas d'encéphalites dont 10 cas sévères, et entre 1975 et 1980, de nouveaux cas humains ont été identifiés en Camargue et en Corse.
Epidémies récentes
1999 États-Unis 149 cas 18 décès 1999 Canada 1 décès 2000 Israël 120 cas 10 décès 2001 Canada 10 cas 2002 États-Unis 4156 cas 284 décès 2002 Canada 416 cas 2003 États-Unis 9858 cas 264 décès 2003 Canada 1000 cas 7 décès Août 2003 France (Var) 7 cas Août 2006 Canada 1 cas Etats-Unis: De 1999 à 2001, le CDC a confirmé 149 cas d’infections par le virus du Nil Occidental, responsables de 18 décès. En 2002, 4156 cas au total ont été signalés, dont 284 mortels. 13 cas en 2002 ont été contractés par transfusion sanguine. Le coût en soins de santé liés au virus du Nil occidental en 2002 était estimé à 200 millions de dollars. Le premier cas humain de la maladie a été détecté en Juin 2003 et un autre a été également identifié le même mois suite à une transfusion de sang infecté. Au cours de la flambée de 2003, 9862 cas et 264 décès ont été signalés par les CDC. Au moins 30% de ces cas ont été jugés graves, impliquant une méningite ou une encéphalite. En 2004, il y a eu seulement 2539 cas signalés et 100 décès. En 2005, on a noté une légère augmentation du nombre de cas, avec 3000 cas et 119 décès enregistrés. 2006 a vu une nouvelle augmentation, avec 4269 cas et 177 décès. En 2007, le nombre de cas signalés est descendu à 3.623 et le nombre de décès est tombé à 124. En 2007, 1.227 cas de maladie neuro-invasive et 117 décès sont survenus. En 2008, dans les données de surveillance du virus du Nil Occidental signalées aux CDC, sur un total de 28 États on a noté 236 cas de maladies humaines dues au virus. La totalité des 137 patients pour lesquels on disposait de données étaient de sexe masculin, l’âge médian des patients était de 48 ans. Les dates du début de la maladie sont réparties du 17 janvier au 14 août: Deux cas ont été mortels. Voir:Carte des cas d'infection par le virus du Nil Occidental aux Etats Unis
Canada: Un décès humain a été publié en 1999. En 2002, dix décès humains parmi les 416 cas confirmés et probables ont été signalés par les autorités sanitaires canadiennes. En 2003, 14 décès et 1494 cas confirmés et probables ont été signalés. Des cas ont été signalés en 2003 en Nouvelle-Écosse, au Québec, en Ontario, au Manitoba, au Saskatchewan, en Alberta, en Colombie-Britannique, et au Yukon. En 2004, seuls 26 cas et deux décès ont été signalés, mais en 2005, on a noté 239 cas et 12 décès. Le 28 octobre, 2006, 127 cas et aucun décès n'a été signalé. Un cas asymptomatique a été découvert seulement grâce à un don du sang. En 2007, 445 Manitobains ont confirmé des cas de virus du Nil occidental, deux personnes sont mortes et une troisième est décédée mais la cause du décès n’a pas été confirmée et le virus est seulement soupçonné. [48] 17 personnes ont été testées positives ou suspectées d’avoir contracté le virus au Saskatchewan, et une personne seulement a été testée positive en Alberta.[49] Le Saskatchewan a signalé 826 cas de virus du Nil Occidental et trois décès.[50]. La propagation des moustiques infectés par le virus du Nil Occidental en Colombie-Britannique a été signalée pour la première fois en 2009 [51]
Israël: En 2000, le CDC a constaté qu'il y avait 417 cas confirmés, avec 326 hospitalisations. 33 de ces personnes sont mortes. Les tableaux cliniques principaux étaient l'encéphalite (57,9%), la maladie fébrile (24,4%) et la méningite (15,9%).[52]
Roumanie: En 1996-1997, environ 500 cas se sont déclarés en Roumanie avec un taux de létalité de près de 10%.
Méthodes de surveillance
Le virus du Nil occidental peut être isolé sur des échantillons prélevés à partir de l'environnement sur des moustiques piégés, de tests pratiqués sur des échantillons de sang prélevés sur des oiseaux sauvages, des chiens et des singes sentinelles, ainsi que des tests sur le cerveau des oiseaux trouvés morts par différents organismes de contrôle des animaux ou des particuliers. Les tests réalisés sur des moustiques nécessitent l'utilisation de RT-PCR pour amplifier les anticorps et montrer la présence de virus dans les échantillons prélevés. Lorsqu’on utilise des sérums d'oiseaux sauvages et de poulets sentinelles, les échantillons doivent être testés pour la présence d’anticorps contre le virus du Nil occidental par l'utilisation de méthodes d’immunohistochimie [53] or Enzyme-Linked Immunosorbent Assay (ELISA).[54]
Après autopsie, les différents tissus des oiseaux morts sont testés pour le virus soit par RT-PCR soit immunohistochimie, qui permet de visualiser le virus qui se présente comme une taché brune sur tissu en raison d'une réaction du substrat avec un enzyme.
Prévention individuelle
Au niveau individuel, les moyens de prévention traditionnels contre les moustiques sont efficaces : moustiquaire, insecticide, crème anti-moustique. Le port de vêtements couvrants protège également.
Il est recommandé d’éviter tout contact à mains nues avec des animaux morts.
En 2003 :
- Une recherche faite aux États-Unis, sur les dons de 6,2 millions de donneurs de sang a permis de trouver 1 000 donneurs positifs et deux cas probables de transmission d’encéphalite, liée à ce virus, par transfusion sanguine (0,00016 %).
Depuis cette, les banques de sang des États-Unis dépistent systématiquement le virus chez les donneurs de sang. [55]
- Une même étude faite dans le département du Var en France, a permis, sur un panel test de 200 donneurs de sang de mettre en évidence que deux d’entre eux avaient été en contact avec le virus (1 %). D’autres donneurs ayant été au contact avec le virus ont été trouvés en 2003 aux Antilles françaises, en Guyane et à la Réunion.
Par mesure de précaution, le National Blood Service du Royaume-Uni effectue un test pour rechercher cette maladie chez les donneurs qui font un don dans les 28 jours qui suivent un voyage aux Etats-Unis ou au Canada, et entre les mois de Mai et de Septembre n'accepte plus aucun don de quelqu'un qui a visité ces deux pays au cours des 28 jours précédents.
La Croix-Rouge suisse a également pris des mesures préventives : toute personne revenant des zones où sévit le virus, dont les États-Unis, est sous le coup d'une interdiction de donner son sang pour une période de six mois. L'Établissement français du sang interdit également le don de sang pendant une durée d'un mois après un voyage aux États-Unis.
Contrôle collectif
Les campagnes de désinsectisation par voie aérienne sont le seul moyen d’éliminer les moustiques et les larves sur de grandes surfaces dans les étangs et les marais.
Le contrôle du virus est réalisé par la lutte contre les moustiques, par l’élimination des gîtes de larves de moustiques, les traitements larvicides des zones de reproduction active et l’incitation à l'usage personnel des répulsifs. Le public est également invité à passer moins de temps à l'extérieur, à porter des vêtements longs couvrant, appliquer des produits contenant du N,N-diéthyl-3-méthylbenzamide et à faire en sorte que les moustiques ne puissent pas pénétrer dans les bâtiments.[56]
Les écologistes ont condamné les tentatives de contrôle des moustiques vecteurs par pulvérisation de pesticides, en disant que les effets néfastes de la pulvérisation sur la santé l'emportent sur le nombre relativement peu nombreux de vies qui pourraient être sauvées, et qu'il existe des moyens de lutte contre les moustiques plus respectueux de l'environnement. Ils s’interrogent également sur l'efficacité de la pulvérisation d'insecticides, car ils pensent que les moustiques qui sont au repos ou en vol au-dessus de la pulvérisation ne seront pas tués, le vecteur le plus commun dans le nord-est américain, Culex pipiens, est un habitant des forêts (canopée ).
Un vaccin efficace chez le cheval a été introduit par Fort Dodge Animal Health (Wyeth).
Dépistage et traitement
Il existe un test de dépistage, mais aucun traitement spécifique, ni vaccin contre le virus du Nil occidental. Les traitements proposés visent uniquement à atténuer les symptômes de la maladie.
Recherche thérapeutique
L’AMD3100, qui avait été proposé comme traitement antirétroviral pour le VIH, s'est révélé prometteur contre l'encéphalite du Nil Occidental. Un morpholino d’oligonucléotides conjugués à un peptide pénétrant la cellule s’est montré capable de protéger partiellement les souris de l’infection par le virus du Nil Occidental. [57] Il y a eu également des tentatives pour traiter les infections en utilisant la ribavirine , les immunoglobulines par voie intraveineuse, ou l’interféron alpha. [58] GenoMed, une société de biotechnologie américaine, a démontré que le blocage de l'angiotensine II pouvait traiter l’attaque de cytokines dans l’encéphalite du virus du Nil occidental ainsi que d'autres virus. [59]
En 2007, la World Community Grid a lancé le projet Discovering Dengue Drugs - Together. Cette organisation utilise un réseau d'ordinateurs distribué à des volontaires via le Berkeley Open Infrastructure for Network Computing pour effectuer des simulations informatiques de l'interaction des molécules. Des milliers de petites molécules sont testées pour leurs propriétés anti-virales potentielles à l'égard du virus du Nil occidental et des virus apparentés.
Voir aussi
- CCR5
- arbovirose
- arbovirus
Notes et références
- Cet article a été en partie rédigé à partir du bulletin de liaison n°98, édité par l'Établissement Français du Sang - site de Haute-Savoie.
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « West Nile virus ».
- ↑ Olejnik E, « Infectious adenitis transmitted by Culex molestus », dans Bull Res Counc Isr, vol. 2, 1952, p. 210–1
- ↑ Smithburn KC, Jacobs HR, « Neutralization-tests against neurotropic viruses with sera collected in central Africa », dans Journal of Immunology, vol. 44, 1942, p. 923
- ↑ Tsai TF, Popovici F, Cernescu C, Campbell GL, Nedelcu NI, « West Nile encephalitis epidemic in southeastern Romania », dans Lancet, vol. 352, no 9130, 1998, p. 767–71 [texte intégral lien PMID lien DOI]
- ↑ Sejvar JJ, Haddad MB, Tierney BC, et al., « Neurologic manifestations and outcome of West Nile virus infection », dans JAMA, vol. 290, no 4, 2003, p. 511–5 [lien PMID lien DOI]
- ↑ Ahmed S, Libman R, Wesson K, Ahmed F, Einberg K, « Guillain-Barré syndrome: An unusual presentation of West Nile virus infection », dans Neurology, vol. 55, no 1, 2000, p. 144–6 [texte intégral lien PMID]
- ↑ Abroug F, Ouanes-Besbes L, Letaief M, et al., « A cluster study of predictors of severe West Nile virus infection », dans Mayo Clin. Proc., vol. 81, no 1, 2006, p. 12–6 [lien PMID lien DOI]
- ↑ Perelman A, Stern J, « Acute pancreatitis in West Nile Fever », dans Am. J. Trop. Med. Hyg., vol. 23, no 6, 1974, p. 1150–2 [texte intégral lien PMID]
- ↑ Omalu BI, Shakir AA, Wang G, Lipkin WI, Wiley CA, « Fatal fulminant pan-meningo-polioencephalitis due to West Nile virus », dans Brain Pathol., vol. 13, no 4, 2003, p. 465–72 [lien PMID]
- ↑ Mathiot CC, Georges AJ, Deubel V, « Comparative analysis of West Nile virus strains isolated from human and animal hosts using monoclonal antibodies and cDNA restriction digest profiles », dans Res. Virol., vol. 141, no 5, 1990, p. 533–43 [lien PMID lien DOI]
- ↑ « West Nile virus activity—United States, 2007 », dans MMWR Morb. Mortal. Wkly. Rep., vol. 57, no 26, July 2008, p. 720–3 [texte intégral lien PMID]
- ↑ Hayes EB, Komar N, Nasci RS, Montgomery SP, O'Leary DR, Campbell GL, « Epidemiology and transmission dynamics of West Nile virus disease », dans Emerging Infect. Dis., vol. 11, no 8, 2005, p. 1167–73 [texte intégral lien PMID]
- ↑ Taylor RM, Hurlbut HS, Dressler HR, Spangler EW, Thrasher D, « Isolation of West Nile virus from Culex mosquitoes », dans J Egypt Med Assoc, vol. 36, no 3, 1953, p. 199–208 [lien PMID]
- ↑ Fonseca DM, et al., « Emerging vectors in the Culex pipiens complex », dans Science, vol. 303, no 5663, March 2004, p. 1535–8 [lien PMID lien DOI]
- ↑ Spielman A, et al., « Outbreak of West Nile Virus in North America », dans Science, vol. 306, no 5701, November 2004, p. 1473–5 [lien PMID lien DOI]
- ↑ « Laboratory-acquired West Nile virus infections--United States, 2002 », dans MMWR Morb. Mortal. Wkly. Rep., vol. 51, no 50, 2002, p. 1133–5 [lien PMID]
- ↑ Fonseca K, Prince GD, Bratvold J, et al., « West Nile virus infection and conjunctival exposure », dans Emerging Infect. Dis., vol. 11, no 10, 2005, p. 1648–9 [lien PMID]
- ↑ « Investigation of blood transfusion recipients with West Nile virus infections », dans MMWR Morb. Mortal. Wkly. Rep., vol. 51, no 36, 2002, p. 823 [lien PMID]
- ↑ « West Nile virus infection in organ donor and transplant recipients—Georgia and Florida, 2002 », dans MMWR Morb. Mortal. Wkly. Rep., vol. 51, no 35, 2002, p. 790 [lien PMID]
- ↑ « Intrauterine West Nile virus infection—New York, 2002 », dans MMWR Morb. Mortal. Wkly. Rep., vol. 51, no 50, 2002, p. 1135–6 [lien PMID]
- ↑ « Possible West Nile virus transmission to an infant through breast-feeding--Michigan, 2002 », dans MMWR Morb. Mortal. Wkly. Rep., vol. 51, no 39, 2002, p. 877–8 [lien PMID]
- ↑ Panthier R, Hannoun C, Beytout D, Mouchet J, « [Epidemiology of West Nile virus. Study of a center in Camargue.] », dans Ann Inst Pasteur (Paris), vol. 115, no 3, 1968, p. 435–45 [lien PMID]
- ↑ Kumar D, Drebot MA, Wong SJ, et al., « A seroprevalence study of west nile virus infection in solid organ transplant recipients », dans Am. J. Transplant., vol. 4, no 11, 2004, p. 1883–8 [lien PMID lien DOI]
- ↑ WG Glass, « Chemokine receptor CCR5 promotes leukocyte trafficking to the brain and survival in West Nile virus infection », dans Journal of Experimental Medicine, vol. 202, no 8, October 17 2005, p. 1087–98 [lien PMID lien DOI]
- ↑ WG Glass, « CCR5 deficiency increases risk of symptomatic West Nile virus infection », dans Journal of Experimental Medicine, vol. 203, no 1, January 23 2006, p. 35–40 [lien PMID lien DOI]
- ↑ a et b Schneider BS, McGee CE, Jordan JM, Stevenson HL, Soong L, Higgs S, « Prior exposure to uninfected mosquitoes enhances mortality in naturally-transmitted west nile virus infection », dans PLoS ONE, vol. 2, no 11, 2007, p. e1171 [texte intégral lien PMID lien DOI]
- ↑ a et b Styer LM, Bernard KA, Kramer LD, « Enhanced early West Nile virus infection in young chickens infected by mosquito bite: effect of viral dose », dans Am. J. Trop. Med. Hyg., vol. 75, no 2, 2006, p. 337–45 [texte intégral lien PMID]
- ↑ a et b Schneider BS, Soong L, Girard YA, Campbell G, Mason P, Higgs S, « Potentiation of West Nile encephalitis by mosquito feeding », dans Viral Immunol., vol. 19, no 1, 2006, p. 74–82 [lien PMID lien DOI]
- ↑ Wasserman HA, Singh S, Champagne DE, « Saliva of the Yellow Fever mosquito, Aedes aegypti, modulates murine lymphocyte function », dans Parasite Immunol., vol. 26, no 6–7, 2004, p. 295–306 [texte intégral lien PMID lien DOI]
- ↑ Limesand KH, Higgs S, Pearson LD, Beaty BJ, « Effect of mosquito salivary gland treatment on vesicular stomatitis New Jersey virus replication and interferon alpha/beta expression in vitro », dans J. Med. Entomol., vol. 40, no 2, 2003, p. 199–205 [lien PMID]
- ↑ Wanasen N, Nussenzveig RH, Champagne DE, Soong L, Higgs S, « Differential modulation of murine host immune response by salivary gland extracts from the mosquitoes Aedes aegypti and Culex quinquefasciatus », dans Med. Vet. Entomol., vol. 18, no 2, 2004, p. 191–9 [texte intégral lien PMID lien DOI]
- ↑ Zeidner NS, Higgs S, Happ CM, Beaty BJ, Miller BR, « Mosquito feeding modulates Th1 and Th2 cytokines in flavivirus susceptible mice: an effect mimicked by injection of sialokinins, but not demonstrated in flavivirus resistant mice », dans Parasite Immunol., vol. 21, no 1, 1999, p. 35–44 [texte intégral lien PMID lien DOI]
- ↑ Schneider BS, Soong L, Zeidner NS, Higgs S, « Aedes aegypti salivary gland extracts modulate anti-viral and TH1/TH2 cytokine responses to sindbis virus infection », dans Viral Immunol., vol. 17, no 4, 2004, p. 565–73 [lien PMID lien DOI]
- ↑ CDC
- ↑ Hayes EB, Gubler DJ, « West Nile virus: epidemiology and clinical features of an emerging epidemic in the United States », dans Annu. Rev. Med., vol. 57, 2006, p. 181–94 [lien PMID lien DOI]
- ↑ Fradin MS, Day JF, « Comparative efficacy of insect repellents against mosquito bites », dans N. Engl. J. Med., vol. 347, no 1, 2002, p. 13–8 [lien PMID lien DOI]
- ↑ CDC
- ↑ Yahoo
- ↑ John S. Marr, Charles H. Calisher, « Alexander the Great and West Nile Virus Encephalitis », dans Emerg Infect Dis, 2003 Dec [texte intégral]
- ↑ "Alexander the Great and West Nile Virus Encephalitis". Centers for Disease Control and Prevention. Retrieved on 2009-04-26
- ↑ Galli M, Bernini F, Zehender G, « Alexander the Great and West Nile virus encephalitis », dans Emerging Infect. Dis., vol. 10, no 7, July 2004, p. 1330–2; author reply 1332–3 [lien PMID]
- ↑ Smithburn KC, Hughes TP, Burke AW, Paul JH, « A Neurotropic Virus Isolated from the Blood of a Native of Uganda », dans Am. J. Trop. Med., vol. 20, no 1, June 1940, p. 471–92
- ↑ Work TH, Hurlbut HS, Taylor RM, « Isolation of West Nile virus from hooded crow and rock pigeon in the Nile delta », dans Proc. Soc. Exp. Biol. Med., vol. 84, no 3, 1953, p. 719–22 [lien PMID]
- ↑ Bernkopf H, Levine S, Nerson R, « Isolation of West Nile virus in Israel », dans J. Infect. Dis., vol. 93, no 3, 1953, p. 207–18 [lien PMID]
- ↑ Calisher CH, « West Nile virus in the New World: appearance, persistence, and adaptation to a new econiche—an opportunity taken », dans Viral Immunol., vol. 13, no 4, 2000, p. 411–4 [lien PMID lien DOI]
- ↑ C. Michael Hogan. 2008. Barbary Macaque: Macaca sylvanus, GlobalTwitcher.com
- ↑ LM Bugbee, « The discovery of West Nile virus in overwintering Culex pipiens (Diptera: Culicidae) mosquitoes in Lehigh County, Pennsylvania », dans Journal of the American Mosquito Control Association, vol. 20, no 3, September 2004, p. 326–7 [lien PMID]
- ↑ 2008 Final West Nile Activity Map, Centers for Disease Control and Prevention
- ↑ Province of Manitoba | Manitoba Health | West Nile virus
- ↑ Error
- ↑ CTV.ca | Sask. reports 339 cases of West Nile, one death
- ↑ News | West Nile virus found in BC mosquitoes
- ↑ MY Chowers, « Clinical characteristics of the West Nile fever outbreak, Israel, 2000 », dans Emerging Infectious Diseases, vol. 7, no 4, Jul–Aug 2001, p. 675–8 [texte intégral lien PMID (pages consultées le 2006-06-07)]
- ↑ M Jozan, « Detection of West Nile virus infection in birds in the United States by blocking ELISA and immunohistochemistry », dans Vector-borne and Zoonotic Diseases, vol. 3, no 3, Fall 2003, p. 99–110 [lien PMID lien DOI]
- ↑ RA Hall, « Immunodominant epitopes on the NS1 protein of MVE and KUN viruses serve as targets for a blocking ELISA to detect virus-specific antibodies in sentinel animal serum », dans Journal of Virological Methods, vol. 51, no 2–3, February 1995, p. 201–10 [lien PMID lien DOI]
- ↑ « Detection of West Nile virus in blood donations--United States, 2003 », dans MMWR Morb. Mortal. Wkly. Rep., vol. 52, no 32, 2003, p. 769–72 [texte intégral lien PMID]
- ↑ Safety and Health Information Bulletins (SHIBs), « Workplace Precautions Against West Nile Virus ». Consulté le 2007-11-21
- ↑ Tia S Deas, « In vitro resistance selection and in vivo efficacy of morpholino oligomers against West Nile virus », dans Antimicrob Agents Chemother, vol. 51, May 2007, p. 2470 [lien PMID lien DOI]
- ↑ Hayes EB, Sejvar JJ, Zaki SR, Lanciotti RS, Bode AV, Campbell GL, « Virology, pathology, and clinical manifestations of West Nile virus disease », dans Emerging Infect. Dis., vol. 11, no 8, 2005, p. 1174–9 [texte intégral lien PMID]
- ↑ Moskowitz DW, Johnson FE, « The central role of angiotensin I-converting enzyme in vertebrate pathophysiology », dans Curr Top Med Chem, vol. 4, no 13, 2004, p. 1433–54 [lien PMID lien DOI]
Liens externes en français
- Site de Santé Canada à propos du VNO
- Institut National de Santé Publique du Québec
- [1]
- Site du Cirad consacré à la surveillance de la fièvre du Nil Occidental en France
Liens externes en anglais
- West Nile Virus - U.S. Centers for Disease Control and Prevention (CDC) page
- U.S. National Institute for Occupational Safety and Health (NIOSH) pages
- West Nile Virus Resource Guide—National Pesticide Information Center
- Vaccine Research Center (VRC)—Information concerning WNV vaccine research studies
- equinewestnile.com
- Canadian Case Surveillance
- West Nile Virus and Insecticides
- Petersen LR, Marfin AA, « West Nile virus: a primer for the clinician », dans Ann. Intern. Med., vol. 137, no 3, 06 August 2002, p. 173–9 [texte intégral lien PMID]
- (en) Morse, Dale; International Conference on the West Nile Virus; White, Dennis, West Nile Virus: Detection, Surveillance and Control (Annals of the New York Academy of Sciences, V. 951), New York Academy of Sciences, New York, N.Y, 2001 (ISBN 1-57331-375-0)
- Nature news article on West Nile paralysis
- CBC News Coverage of West Nile in Canada
- Hubálek Z, Halouzka J, « West Nile fever—a reemerging mosquito-borne viral disease in Europe », dans Emerging Infect. Dis., vol. 5, no 5, 1999, p. 643–50 [texte intégral lien PMID]
- West Nile Virus and Wildlife Disease
- West Nile Cases Drop as Immunities Emerge, Experts Say
- Nash D, Mostashari F, Fine A, et al., « The outbreak of West Nile virus infection in the New York City area in 1999 », dans N. Engl. J. Med., vol. 344, no 24, June 2001, p. 1807–14 [texte intégral lien PMID lien DOI]
- Low literacy materials in Spanish for WNV prevention
- Gene mutation turned West Nile virus into killer disease among crows
- West Nile Virus Genomes database search results from the Viral Bioinformatics Resource Center
- Portail de la médecine
- Portail de la biologie
- Portail de la microbiologie
Catégorie : Flaviviridae
Wikimedia Foundation. 2010.


