- Point critique (thermodynamique)
-
 Pour les articles homonymes, voir Point critique.
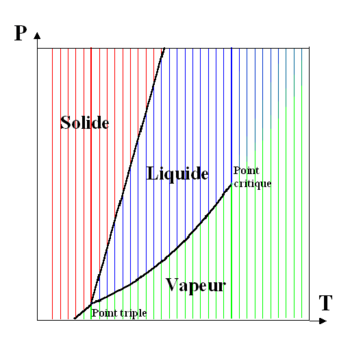
Pour les articles homonymes, voir Point critique.Le point critique d’un corps pur est le point d’une courbe reliant pression, température et masse volumique tel que la transition de phase entre l’état liquide et l’état gazeux est impossible — la masse volumique des deux états du corps considéré étant désormais de même valeur à partir de ce point, de même que l’indice de réfraction à l’état gazeux et celui à l’état liquide, quel que soit l’état précédent (liquide ou gazeux). Exemple de l’eau : température critique = 374,15 °C, pression critique = 221,2 bars. Le point critique ne doit pas être confondu avec le point triple des diagrammes de phase traditionnels.
Un corps réunissant ces trois conditions dites critiques de température, de pression, et de masse volumique est dit en « état critique ».
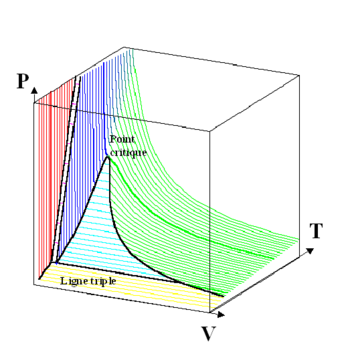
Toute élévation supplémentaire d’un des trois paramètres au-delà de sa valeur critique (donc au-delà du point critique) conduit à l’état qualifié de « supercritique » dans lequel le corps ne peut donc physiquement être ni liquide ni gazeux. C’est l’état que l’on observe dans la partie haute de ce graphique tridimensionnel Volume/Température/Pression ci-dessous.
Chaque corps chimique possède donc un « point critique » caractérisé par une température critique, une pression critique, et une masse volumique (ou un volume massique) critique.
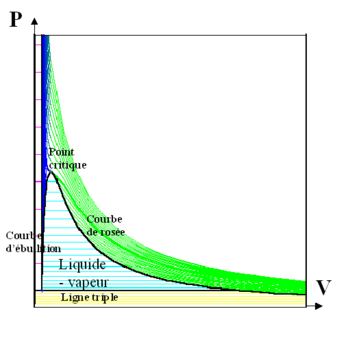
Fait remarquable : si l’on considère un changement d’état à une température constante très proche du point critique, on voit qu’une différence de pression « faible » produit un changement de volume « important ». La courbe représentant la relation pression/volume à la température critique est tangente à la surface de changement d’état, qui est une surface réglée cylindrique d’axe parallèle à celui des volumes ; elle est donc au point de tangence parallèle à cet axe : la compressibilité est infinie au point critique, une différence de pression infime provoque alors des variations de volume et de densité sensibles. Les propriétés dépendant de la densité (constante diélectrique, indice de réfraction) sont mal définies dans cet état de la matière, les fluctuations statistiques deviennent macroscopiques : le fluide se comporte vis-à-vis de la lumière comme un brouillard concentré ; on parle de « phénomène d’opalescence critique ». Ce phénomène de « contournement du point critique » est particulièrement exploité en microscopie électronique pour sécher totalement un échantillon sans le détruire. Historiquement, la description de ces fluctuations par Einstein et Smoluchowski fut une étape importante du triomphe des théories atomistes.
On peut faire assez facilement l’expérience dite de « contournement du point critique » qui consiste à transformer un corps de la phase liquide à la phase gazeuse, puis en une phase fluide « super critique » (sans qu’il ait cette fois de transition visible), puis à nouveau en phase liquide.
Les gaz organiques (alcanes ou alcènes par exemple) ont aussi un point critique.
Voir aussi
Articles connexes
Liens externes
- Une vidéo explicative sur le point critique et l’expérience de contournement du point critique
- La réalisation de l’expérience (C’est une expérience dangereuse.)
- La page du Pr Pierre Carlès, chercheur au CNRS et professeur de mécanique des fluides à Jussieu
- Équilibre liquide-vapeur du cours de thermodynamique du Pr Claude Saint-Blanquet, maître de conférence, spécialiste des transferts thermiques.
Wikimedia Foundation. 2010.