- Propan-1,2,3-triol
-
Glycérol
Glycérol 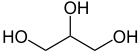
Général Nom IUPAC propan-1,2,3-triol
ou
1,2,3-propanetriolSynonymes glycérine
TrihydroxypropaneNo CAS No EINECS No E E422 FEMA SMILES InChI Apparence liquide incolore, hygroscopique, visqueux.[1] Propriétés chimiques Formule brute C3H8O3 [Isomères] Masse molaire 92,0938 g∙mol-1
C 39,13 %, H 8,76 %, O 52,12 %,pKa 14,4[2] Propriétés physiques T° fusion 18,2 °C[2] T° ébullition 290 °C[2] (se décompose au-delà de 171 °C) Solubilité Miscible avec l'eau (1,00 E+06⋅mg⋅L-1 à 25 °C[2]), l'alcool.
Soluble dans 11 parts d'acétate d'éthyle,
500 parts d'Éther diéthylique.
Insoluble dans le benzène, le chloroforme, les huiles, CCl4, CS2, l'éther de pétroleMasse volumique (eau = 1) : 1.26[1] T° d’auto-inflammation 370 °C [3] Point d’éclair 160 °C[3] Limites d’explosivité dans l’air en volume % dans l'air : 0.9-?[1] Pression de vapeur saturante 1,68×10-4 mmHg (25 °C)[2] Viscosité dynamique 1,49 Pa⋅s à 20 °C Précautions NFPA 704 SIMDUT[4] Produit non contrôlé Écotoxicologie DL50 20 ml/kg (rats, oral)
4,4 ml/kg (rats, i.v.)
4,09 g/kg (souris, oral)[2]
4,25 g/kg (souris, i.v.)[2]Autre Peut exploser au contact d'oxydants forts (CrO3, KClO3, KMnO4) LogP -1.76[1] Composés apparentés Autres composés Nitroglycérine Unités du SI & CNTP, sauf indication contraire. Le glycérol ou la glycérine (C3H8O3) est un polyol. Son nom officiel est le propan-1,2,3-triol (ou 1,2,3-propanetriol). C'est un triol, il possède 3 fonctions alcool.
Sommaire
Histoire
En 1783, le chimiste suédois Carl Wilhelm Scheele obtient du glycérol en faisant bouillir de l'huile d'olive avec de l'oxyde de plomb.
En 1823, le chimiste français Eugène Chevreul démontre que le corps gras est formé d’une combinaison entre le glycérol et des acides gras.
Propriétés
Propriétés physiques
Le glycérol se présente sous la forme d'un liquide transparent, visqueux, incolore, inodore, non toxique et au goût sucré.
Le glycérol peut se dissoudre dans les solvants polaires grâce à ses 3 groupes hydroxyle. Il est miscible dans l'eau et l'éthanol; et insoluble dans le benzène, le chloroforme et le tétrachlorométhane[3].
Propriétés chimiques
Dans les organismes vivants, le glycérol est un composant important des glycérides (graisses et huiles) et des phospholipides. Quand le corps utilise les graisses stockées comme source d'énergie, du glycérol et des acides gras sont libérés dans le sang.
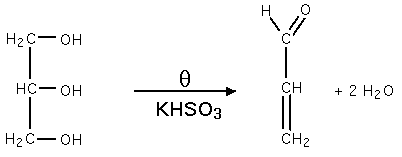
Déshydratation
Elle est faite à chaud, en présence d'hydrogénosulfite de potassium (KHSO3) produit de l'acroléine selon la réaction :
Estérification
Elle conduit à des (mono, di ou tri)glycérides. Consulter l'article à propos des glycérides.
Autre propriétés
Le glycérol a un goût sucré de puissance moitié moindre que le saccharose, son pouvoir sucrant est de 0,56-0,64 à poids égal[5].
Le glycérol a des propriétés laxatives et diurétiques faibles[3].
Synthèse
La synthèse historique de la glycérine est due à Wurtz, à partir du tribromure d'allyle. Toutefois cette synthèse n'est pas totale car le tribromure d'allyle est lui-même préparé à partir de la glycérine. La synthèse totale est due à Charles Friedel et Silva à partir du propylène.
Le glycérol est formé durant la fermentation alcoolique du moût de raisin lors de la production du vin.Le glycérol est un sous-produit de la réaction de saponification, dont le but premier est de fabriquer du savon à partir de matières grasses animales ou végétales. Cette réaction s'écrit :
corps gras + soude ➪ savon + glycérol
La glycérine est un sous-produit de la transestérification d'huiles végétales lors de la production d'esters méthyliques d’huiles végétales (EMHV) qui servent de carburants sous la dénomination de biodiesel ou diester.
Les huiles de noix de coco et de palmiste qui contiennent un pourcentage élevé (70-80%) d'acides gras en C6 à C14 libèrent de plus grandes quantités de glycérol que les gras et huiles qui contiennent majoritairement des acides gras en C16 et C18, comme les graisses animales, les huiles de graines de coton, graines de soja, olives et palme[6].
Utilisation
Médicaments
- Hydratant qui améliore l'onctuosité et la lubrification des préparations pharmaceutiques
- Utilisé dans les suppositoires, sirops contre la toux (expectorants).
Cosmétiques
- Dans les cosmétiques, le glycérol est souvent utilisé comme agent hydratant, solvant et lubrifiant.
- Il a meilleur goût et est plus soluble que le sorbitol qui le remplace souvent.
- Utilisé dans les dentifrices, les bains de bouche, les crèmes hydratantes, les produits capillaires et les savons.
- Composant des savons à la glycérine, notamment les savons de Marseille dont la séparation par hauteurs des eaux glycérineuses amène à la finalisation de ce produit.
Alimentation
Le glycérol est utilisé comme humectant (pour retenir l’humidité), solvant (support d'arôme[7]), émulsifiant, stabilisant et épaississant dans une large variété de produits alimentaires[8].
En Europe, il est utilisé comme additif alimentaire sous le numéro E422[7].
Le JECFA a attribué au glycérol une dose journalière admissible non spécifié depuis 1976[9], ce qui indique qu'il ne présente pas de danger pour la santé lorsqu'il est utilisé dans les proportions requises pour obtenir l'effet désiré.
Vin
- Le glycérol, formé au début de la fermentation alcoolique du moût (fermentation glycéropyruvique), donne au vin son onctuosité.
- Les sucres se transforment en acide pyruvique et en glycérol.
C6H12O6 → CH2OH-CHOH-CH2OH + CH3-CO-COOH.
- Les premiers 50 g de sucre fermenté donnent plus de la moitié de la teneur en glycérol du vin. Sa formation dépend de la quantité initiale de sucre, de la nature des levures et des conditions de fermentation : température, acidité, aération, sulfitage. La proportion de glycérol est relativement constante : elle varie de 6 à 10 g pour 100 g d’alcool. Cependant dans les vins blancs liquoreux provenant de raisins pourris (Botrytis), les teneurs en glycérol dépassent souvent de beaucoup ces proportions. Les Sauternes sont sucrés et doux au palais. Le glycérol se trouve également dans les vins rouges (bons Bourgognes). La formation de ‘coulées’ ou larmes sur les parois d’un verre après agitation n´est pas un indice de qualité dû au glycérol mais s'explique par une différence d´évaporation et de tension capillaire entre l´eau et l´alcool (l´effet Marangoni).
Chimie
- C'est l'un des principaux composants de la fabrication de la nitroglycérine.
- C'est aussi l'un des composants indispensables pour faire des bulles de savon.
- On peut faire du feu sans allumette si l'on mélange le glycérol à du permanganate de potassium (KMnO4) en poudre. La réaction est très lente au début (on n'observe rien durant les 30 premières secondes), puis elle est tellement exothermique qu'elle enflamme le permanganate : on voit des flammes violettes dues à l'ion MnO4- et des flammes orange dues à l'ion K+. Grâce à ce dégagement de chaleur, la vitesse de réaction qui était faible devient très grande.
- En grande quantité la réaction peut atteindre des températures supérieures à 1 000 °C.
- Ne pas rajouter de substances à cette réaction sans connaitre leurs propriétés. Par exemple l'aluminium en poudre mélangé au KMnO4 + Glycérol rend la réaction très explosive.
Cellophane
- Plastifiant dans la cellophane.
Autres applications
- Plastifiant et lubrifiant dans la fabrication du papier
- Lubrifie et assouplit les fils et les tissus
- Utilisé dans les fluides anti-gel
- Appliqué sur un miroir, il évite l'apparition de buée
- Sert aussi pour des effets spéciaux tels que la simulation de transpiration ou des fumigènes
- Sert dans l'aéronautique à lubrifier les tuyauteries d'eau potable en raison de son caractère non polluant.
- Composant alternatif au PG dans les recharges de Cigarette électronique
Notes et références
- ↑ a , b , c et d GLYCEROL, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b , c , d , e , f et g (en) ChemIDplus, « Glycerin - RN: 56-81-5 » sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine. Consulté le 23/07/2008.
- ↑ a , b , c et d (en) (en) Peter M. Collins, Dictionary of carbohydrates, CRC Press, 2005, 1282 p. (ISBN 0849338298), p. 584-986
- ↑ « Glycérine » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ (en) (en) Robert Shallenberger, Taste Chemistry, Springer, London, 1993, 613 pages p. (ISBN 0751401501), « Chapter 4 - Polyhydroxy alcohols, cyclitols and carbonyl compounds », p. 141-152
- ↑ (en) Lowen R. Morrison, Procter & Gamble, Kirk-Othmer encyclopedia of chemical technology, 4th ed. : Glycerol, vol. 12, John Wiley & Sons., 1991
- ↑ a et b Parlement européen et Conseil de l'europe, « La Directive 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants », dans Journal officiel de l'Union européenne, no L 61, 20/02/1995, p. 1-56 [texte intégral (page consultée le 19/05/2008)]. [pdf]
- ↑ (en) Codex Alimentarius Commission, « Updated up to the 31st Session of the Codex Alimentarius Commission for Glycerol (422) » sur http://www.codexalimentarius.net, 2008, GSFA Online, Codex Alimentarius. Consulté le 16/10/2008.
- ↑ (en) JECFA, « Monograph 1 Glycerol - INS N° 422 » sur http://www.fao.org, 2006, Food additive Monograph, FAO, p. 1-4. Consulté le 16/10/2008. [pdf]
Voir aussi
Articles connexes
Liens externes
- (en) Glycerol sur BioChemInfo.org
- (en) Physical Property of glycerol
- Portail de la biochimie
- Portail de la chimie
- Portail de la pharmacie
Catégories : Additif alimentaire | Édulcorant | Excipient | Polyol | Lipide | Produit chimique domestique
Wikimedia Foundation. 2010.

