- Saponification
-
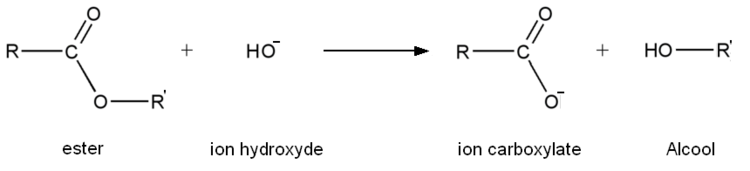
La saponification est, dans le cadre général, une réaction chimique transformant un ester en un ion carboxylate et un alcool. Il s'agit en fait de l'hydrolyse en milieu basique d'un ester.
Cette réaction permet la synthèse du savon.
Sommaire
Histoire
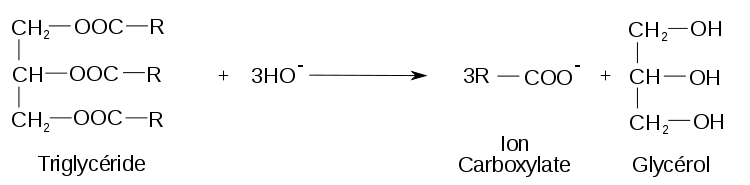
Initialement cette réaction est connue pour transformer le mélange d'un ester de glycérol et d'une base forte en un mélange de savon (ou acide gras) et glycérol, d'où son nom. Elle a été expliquée en 1823 par le chimiste français Eugène Chevreul qui a démontré que les corps gras sont formés d’une combinaison entre le glycérol et des acides gras.
Réaction
Propriétés
La saponification est une réaction lente mais totale. C'est une réaction exothermique.
Il existe plusieurs procédés de saponification :
- le procédé discontinu ou marseillais est ancien mais toujours utilisé
Article détaillé : savon de Marseille.
- les procédés continus.
Pour accélérer la réaction, on peut jouer sur plusieurs facteurs :
- maintenir une température élevée ;
- agiter le mélange soude - ester pour permettre aux réactifs de se rencontrer plus facilement et maintenir une émulsion.
Mécanisme
Il se décompose en trois étapes (plus une acidification du milieu si on veut ré-obtenir un acide carboxylique, et non plus un ion carboxylate).
- Première étape: addition de HO- sur l'ester.
- Seconde étape: élimination du groupe alcoolate.
À ce stade, la réaction pourrait être terminée (ce qui serait très pratique, pour hydrolyser un ester, il suffirait de rajouter de la soude ou de la potasse...). Il n'en est hélas rien car on forme dans cette étape, certes un acide carboxylique, acide faible (pKa compris en général entre 3 et 4, mais relativement le plus fort dans le milieu, l'autre étant l'eau) mais aussi une base très forte, l'ion alcoolate (pKa compris entre 18 et 20). Il y a donc forcément réaction acide-base entre l'acide le plus fort et la base la plus forte, donc transformation de l'acide carboxylique en ion carboxylate.
- Troisième étape : réaction acide-base entre l'acide carboxylique et l'ion alcoolate.
Comme on peut le remarquer, cette réaction est la seule du mécanisme qui soit irréversible, et (quasiment) totale (1014 < K< 1017 ). Ainsi elle déplace les équilibres des réactions précédentes (en consommant entièrement leurs produits), les rendant elles aussi totales (ou presque).
Dans le cadre de la synthèse d'un savon, on peut s'arrêter à cette dernière étape. Par contre, si l'on veut obtenir un acide carboxylique, il faut réacidifier le milieu :
Applications
Synthèse de savon
Au cours de cette réaction, des corps gras (graisses ou huiles) sont hydrolysés en milieu alcalin par une base, généralement de la potasse (KOH) ou de la soude (NaOH), à une température comprise entre 80 °C et 100 °C. La température élevée sert à accélérer la réaction de saponification, car c'est une facteur cinétique. La saponification des corps gras produit du glycérol et un mélange de carboxylates (de sodium ou de potassium) qui constitue le savon. A noter que les carboxylates de Sodium (Na) produisent des savons "durs" et que les carboxylates de Potassium (K) produisent des savons "mous ou liquides"
L'indice de saponification est un des paramètres qui permettent d'apprécier la qualité d'une huile végétale. C'est la quantité de potasse KOH, exprimée en milligrammes, nécessaire à la saponification d'un gramme d'huile.
Voir aussi
- le procédé discontinu ou marseillais est ancien mais toujours utilisé
Wikimedia Foundation. 2010.