- Eau De Javel
-
Eau de Javel
Hypochlorite de sodium 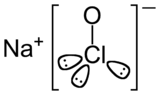
Structure chimique de l'hypochlorite de sodium Général Nom IUPAC Hypochlorite de sodium Synonymes Oxychlorure de sodium No CAS No EINECS PubChem SMILES InChI Apparence solution limpide, jaunatre, d'odeur caracteristique[1]. Propriétés chimiques Formule brute NaClO Masse molaire 74,442 g∙mol-1
Cl 47,62 %, Na 30,88 %, O 21,49 %,Propriétés physiques T° fusion 24,5 °C (pentahydrate) T° ébullition 111 °C Solubilité 94,2 g dans 100 g d'eau
(à 23 °C) (Pentahydrate)Masse volumique (eau = 1) : 1.1 (solution aqueuse, 5,5 %),
(eau = 1) : 1.21 (solution aqueuse, 14 %)[1]Précautions Directive 67/548/EEC 
C
NPhrases R : 31, 34, 50, Phrases S : 1/2, 28, 45, 50, 61, [2] Transport 80 1791 NFPA 704 Inhalation Dangereuse, peut être mortelle Peau Irritant, provoque des brûlures, peut être mortelle Yeux Irritant, provoque des brûlures Ingestion Dangereuse, voire mortelle Autre Intraveineuse : Irritant, provoque des infections Unités du SI & CNTP, sauf indication contraire. L’eau de Javel (appelée aussi Javel) est une solution liquide oxydante fréquemment utilisée comme désinfectant et/ou comme décolorant.
Étudiée particulièrement à partir de 1775 par le chimiste français Claude Louis Berthollet, dont la manufacture de produits chimiques a été construite dans le quartier de Javel à Paris, elle est composée d'hypochlorite de sodium pur (NaClO), en solution aqueuse avec du sel (NaCl), résiduel du procédé de fabrication.
La réaction de fabrication de l'eau de Javel (NaClO) à partir de chlore et de soude (NaOH) est :
Cl2 + 2 NaOH → NaCl + NaClO + H2O.
L'eau de Javel contenant des atomes de chlore, on dit souvent par extension que de l'eau javellisée est « chlorée », terme qui est imprécis, car l'acide chlorhydrique est également une solution chlorée, et l'odeur caractéristique de l'eau de Javel n'a rien à voir avec l'odeur du dichlore.
Sommaire
Historique
Le chlore a été découvert en 1774 par le chimiste suédois Scheele. Claude Louis Berthollet étudie quelques années après les propriétés décolorantes du chlore et en tire un procédé de blanchiment des toiles utilisant une solution de chlorure et d'hypochlorite de potassium : il vient d'inventer la "lessive de BERTHOLLET", bientôt dénommée eau de Javel suite à la localisation de son premier site de production[3] : la manufacture de produits chimiques construite en 1777 dans le village de Javel, à l'ouest de Paris, qui donnera son nom au produit.
L'eau de Javel a rapidement connu un vif succès comme décolorant (Auparavant, les toiles devaient être exposées au soleil pendant des mois pour les blanchir).
En 1820, le pharmacien Antoine Germain Labarraque étudie les qualités désinfectantes des dérivés chlorés et des hypochlorites de potassium et de sodium. Il met au point une solution de chlorure et d'hypochlorite de sodium qu'il appelle « liqueur de Labarraque ». En 1900, on appelait eau de Javel l'hypochlorite de potassium, et eau de Labbaraque l'hypochlorite de sodium. Plus tard, le procédé de fabrication a remplacé le potassium par le sodium, sans changement de nom.
À partir du XIXe siècle, l'eau de Javel est couramment utilisée comme désinfectant et pour le traitement de l'eau potable (voir verdunisation).
Les chlorures décolorants, hypochlorites de sodium (eau de Javel) et de calcium (chlorure de chaux), ont été le premier débouché du chlore. Ils étaient obtenus par action du chlore sur les solutions de soude ou sur la chaux éteinte. Le chlore liquide a remplacé peu à peu le chlorure de chaux, qui est un mélange d'hypochlorite de calcium Ca(ClO)2 et de chlorure de calcium CaCl2 utilisé comme agent décolorant actif avant l’eau de Javel (jusqu'en 1925).
Présentation
L'eau de Javel se présente sous forme liquide (en bouteilles ou en berlingots) ou sous forme solide (en pastilles). Pour éviter les accidents, l'eau de javel et les effluents en contenant sont stockés dans des emballages en matière plastique. L'INRS précise[4] que le verre est utilisable, mais dans des bonbonnes protégées par une enveloppe métallique convenablement ajustée.
L'eau de Javel est commercialisée sous plusieurs niveaux de dilution. La quantité de chlore est exprimée en pourcentage de chlore actif (c.a.). Le pourcentage de chlore actif représente la masse de dichlore formée à partir de 100 g d'eau de Javel. On trouve par exemple des bouteilles d’eau de Javel à 2,6 % de chlore actif et des berlingots d'eau de Javel concentrée à 9,6 % de chlore actif.
Les pastilles d'eau de Javel sont en fait des pastilles de dichloroisocyanurate de sodium. Lorsque ces pastilles sont dissoutes dans l'eau, le dichloroisocyanurate de sodium réagit avec l'eau pour donner de l'hypochlorite de sodium et de l'acide cyanurique.
Aujourd'hui, l'eau de Javel est incorporée dans des détergents pour proposer des produits « 2 en 1 » qui nettoient et désinfectent.
L'eau de Javel doit être conservée à l'abri de la lumière et de la chaleur.Utilisation
Le produit commercial change de nom en fonction de la dilution et on parlera :
- d’extrait de Javel pour un produit titrant 40 ° chlorométriques minimum.
- d’eau de Javel si la concentration est comprise entre 9,6 ° et 35 ° chlorométriques.
- d’eau de Labarraque pour un produit titrant 2 ° chlorométriques.
L'eau de Javel désinfecte l'eau lors du traitement de l'eau potable. Le chlore a des propriétés rémanentes, ce qui signifie que son action désinfectante est valable sur tout le long du réseau de distribution d'eau.
L'eau de Javel peut être utilisée pour désinfecter les sanitaires, les sols, les éviers et les paillasses. Elle est parfois ajoutée à la lessive pour « blanchir » le linge.
Elle est également utilisée pour désinfecter l'eau des piscines.
L'eau de Labarraque est le principal composant de la liqueur de Dakin, utilisée comme antiseptique.
Unités
L'unité officielle est la masse de dichlore produite par une masse donnée de solution, exprimée en % (% de chlore actif ou ca). Exemple : 1 g de dichlore produit par 100 g de solution.
L'unité chimique est le nombre de moles de dichlore par Litre ou kg de solution.
Rappel : 1 ppm correspond à 1 mg/kg soit 0,001 g par kg, soit 0,0001 g pour 100 gEffets sur la santé et l'environnement
Toxicologie (Effets sur la santé)
L'eau de Javel est toxique et corrosive. Elle provoque des brûlures sur la peau, les muqueuses (les yeux notamment), surtout sous forme concentrée.
Son inhalation peut provoquer une réaction respiratoire (irritation bronchique, avec œdème dans les cas graves accompagné d'une baisse de la pression partielle de l'oxygène dans le sang) se manifestant par une dyspnée (manque de souffle, sensation d'étouffement) et une toux (qui peut persister plusieurs années).
L’hypochlorite de sodium réagit avec les substances azotées, dont celles émises par l'Homme dans les piscines (sueur et traces d'urine…) comme elle peut réagir avec les protéines animales et végétales lors des opérations de désinfection de locaux ou des végétaux, ou dans les égouts ou bondes d'évier. Elle produit alors des dérivés chlorés dont certains sont susceptibles de dégazer dans l'air. Les chloramines produites peuvent piquer les yeux.Toxicocinétique et métabolisation
Les voies d’absorption classiques sont l’ingestion, le passage transcutané et l’inhalation.
Chez l’animal, l’ingestion orale induit un taux plasmatique maximal 2 heures après (chez le rat à jeun, et après 4 heures chez un animal nourri).
Demie vie : Il faut 44 heures pour diviser par deux le taux sanguin chez le rat à jeun et 88,5 heures s’il est nourri.
Métabolisation : Une solution aqueuse de [36CI]-hypochlorite de sodium est métabolisée par le rat en ions chlorures retrouvés (96 heures après en plus grande quantité dans le plasma), puis dans le sang total, mais aussi dans la moelle osseuse, les testicules, les reins et le poumon[5].Une heure seulement après ingestion d’hypochlorite de sodium, le plasma et le contenu intestinal de rats (nourris ou à jeun) contenaient de l’acide trichloroacétique, de l'acide dichloroacétique et du dichloroacétonitrile. Après 96 heures, 51,2 % de la dose initiale seulement était éliminée (à 36,4 % dans l’urine et 14,8 % dans les excréments). Après 120 heures, on trouvait encore chez ces rats des traces significatives du produit ([36CI]-hypochlorite de sodium).
Toxicité aigüe
La toxicité aigue est d’abord liée au caractère corrosif de l’hypochlorite de sodium.
- - DL50 orale : 5 800 mg/kg chez la souris ;
- - DL50 cutanée : supérieure à 10 000 mg/kg chez le lapin ;
- - CL50 par inhalation : supérieure à 10,5 mg/l pour une exposition d’une heure chez le rat.
Inhalation : chez la souris, la RD50 (dose induisant une diminution de 50 % de la fréquence respiratoire) est de 4,1 ppm pour une atmosphère d’hypochlorite mesurée en chlore libre (chiffre proche de la RD50 du chlore pur, 6,7 ppm).
Ingestion : des brûlures oropharyngées, œsophagiennes et gastriques sont constatées chez le chien pour 100 ml d’une solution à 5,25 %. Au-dessus de 5 ml/kg, des lésions corrosives apparaissent.
Exposition cutanée : elle induit un épaississement de la peau chez la souris (pour une solution à 1 g/l appliquée 10 minutes par jour durant 4 jours). Les cellules basales de l’épiderme sont moins viables chez le cobaye (pour une solution à 0,5 % appliquée sur la peau durant 2 semaines).
La peau du lapin est corrodée après 15 à 30 minutes d’application d’une solution à 3,5 %. L’irritation augmente avec la dose.
Les muqueuses y sont naturellement plus sensibles ; chez le lapin, une solution à 0,5 % provoque une vive douleur sur l’œil, avec une irritation réversible en 24 heures. À 5 % on constate un obscurcissement passager de la cornée, un œdème de la conjonctive[6], qui sont réversibles en 24 heures si l’œil a été rincé à l’eau dans les 30 secondes (sinon, les lésions persistent une semaine). Chez le singe, la lésion – à dose identique – est plus rapidement réversible. À 15 %, la douleur est aiguë et - sans lavage oculaire immédiat - s’accompagne d’une hémorragie de la conjonctive et du nez, d’un œdème de la conjonctive. La cornée devient vitreuse, il y a un léger hématome ; la lésion est partiellement réversible en 2 à 3 semaines (séquelles).Sources : bases de données[7],[5],[8]
Exposition chronique
Jusqu’à 4 000 mg/l, l’hypochlorite de sodium ingérée via l’eau de boisson n'influe pas sur la survie de rats, de souris (jusqu’à 2 754 mg/l) ou de cobaye (50 mg/l) expérimentalement exposés, mais des effets génotoxiques semblent possibles (démontrés chez la souris). Une étude montre aussi que les rats boivent moins d'eau quand elle est assez fortement javellisée, les plus jeunes grossissant légèrement[9],[7].
D'éventuels effets sur la fertilité sont discutés :
On n'a mesuré aucun chez le rat mâle ou femelle, mais chez la souris, à forte dose, il induit des anomalies spermatiques (Génotoxicité envisagée chez l'Homme[9],[7]). Des rats exposés durant 2,5 mois (avant et lors de la gestation) via 100 mg/l dans leur eau de boisson, ont produit des fœtus lègèrement moins lourds, et présentent une légère augmentation d'anomalies (squelette et tissus mous), mais une exposition sur 7 générations n’a pas prouvé d’effet sur la croissance ni sur la survie.Valeur limite
En 2006 (source INRS), aucun seuil n’avait été établi pour l’hypochlorite de sodium par l’Union Européenne, ni par la France (ministère chargé du Travail), ni par les États-Unis (ACGIH) ni par l’Allemagne (MAK).
Écotoxicologie
L'eau de Javel est un puissant biocide nécessitant des précautions pour sa manipulation et pour éviter les rejets de ce produit dans la nature. Les eaux javellisées et extraits concentrés de Javel oxydent la matière organique qu'elles rencontrent en étant susceptible de produire des organochlorés toxiques et de nombreux produits de dégradation (chlorures) et métabolites lorsqu'elle a été ingérée par des animaux ou autres organismes aquatiques. L'effet toxique sur la faune est donc persistant en se transmettant via la chaîne alimentaire. Ces transformations seraient cancérigènes et mutagènes[10]. L'eau de Javel, au contact de l'air, se décompose lentement (à température ambiante, plus rapidement au soleil et/ou exposée à la chaleur, ou en contact avec des métaux) en formant des chlorates et du chlorure de sodium, en libérant du dioxygène selon les réactions :
- 3 NaClO ⇒ NaClO3 + 2 NaCl
- 2 NaClO ⇒ 2 NaCl + O2
De nombreux métaux (dont le cuivre (souvent utilisé pour les tuyauteries), le nickel et leurs alliages) peuvent avoir un effet catalytique et accélérer la décomposition de l'eau de Javel.
L'eau de Javel utilisée pour la désinfection des sols ou des WC est présente via les effluents domestiques des bâtiments tertiaires ou industriels dans les égouts et dans certaines stations d'épuration, où elle perd rapidement son pouvoir oxydant en raison de la grande quantité de matière oxydable qui y est présente, mais elle pourrait contribuer à y sélectionner des organismes chlororésistants ou produire des métabolites indésirables.
En raison de son action corrosive et super-oxydante, tout rejet accidentel ou chronique direct en milieu naturel peut avoir des conséquences écotoxicologiques locales (Le plancton est par exemple très sensible à de faibles doses de chlore). L'incinération de matières organiques contenant de l'eau de Javel active devrait être évitée en raison du risque de production d'organochlorés stables tels que furanes et dioxines.Précautions d'emploi
En cas de projection, rincer longuement et abondamment à l'eau claire.
Les accidents les plus fréquents sont liés à l'ingestion volontaire (tentative de suicide) ou involontaire et aux mélanges avec d'autres produits (Elle doit surtout ne pas être mélangée aux acides, qui provoquent un violent dégagement gazeux de dichlore, très toxique.)
Les pastilles doivent être tenues hors de portée des enfants parce qu'elles risquent d'être confondues avec des bonbons.L'eau de Javel doit être conservée en emballage opaque et au frais, car les ions hypochlorite sont dégradés par les UV solaires et la chaleur. Elle ne doit pas être mélangée à de l'eau chaude, ni mélangée à d'autres biocides ou agents nettoyants (émanations toxiques possibles). Combinée à l’ammoniaque (présent dans certains produits de nettoyage), elle produit des chloramines (avec éventuel dégagement d’azote). Combinée à des acides, par exemple des acides chlorhydrique ou sulfurique ou même des acides doux présents dans certains produits de nettoyage ou décapants, elle réagit violemment en émettant de la vapeur de chlore, très toxique (du vinaigre ou du jus de citron suffisent à produire ce type de réaction).
L'INRS rapporte aussi qu'appliqué sur des matériaux finement divisés (fibres textiles, papier ou poussière de bois), l'extrait de Javel peut dégager de la vapeur d'eau contenant un peu de chlore, ces matériaux devenant ensuite plus inflammables à l’état sec.
Pour la désinfection des surfaces, elle doit être correctement diluée et uniquement utilisée après nettoyage complet par un détergent suivi d'un rinçage, pour une désinfection efficace et pour ne pas favoriser l'apparition du phénomène de résistance au chlore chez certains microbes et parasites, dont les cryptosporidies (et notamment Cryptosporidium parvum, parasite (protozoaire) qui peut se développer dans les piscines et qui développe rapidement des résistances à de nombreux biocides).
Certaines bactéries se sont montrées également capables après phénomène de sélection naturelle de développer des résistances à des concentrations importantes de chlore. Des tapis de bactéries dites chlororésistantes ont ainsi été trouvés dans l'Aa durant plusieurs années, sur plusieurs kilomètres, suite à l'usage de quantités importantes de désinfectants chlorés dans le processus d'une usine riveraine de la rivière.L'eau de Javel ne doit pas être employée pour nettoyer des ustensiles en aluminium, inox ou argent, qu'elle noircit.
Pour être efficace, une dose ouverte doit être rapidement utilisée, et il convient de respecter la date limite d'utilisation du produit.Composition
L'hypochlorite de sodium NaClO est un sel de sodium de l'acide hypochloreux HClO. En solution, l'hypochlorite de sodium NaClO se décompose en ions sodium Na+ et hypochlorite ClO-.
- NaClO → Na+ + ClO-
HClO est un acide faible dont la base conjuguée est l'ion hypochlorite ClO-. L'équilibre acido-basique du couple HClO / ClO- s'écrit :
- HClO ↔ H+ + ClO- (1)
La composition de l'eau de Javel dépend du pH, selon les deux équilibres chimiques suivants :
- HClO ↔ H+ + ClO- (1)
- HClO + H+ + Cl- ↔ Cl2 + H2O (2)
Propriétés
Propriétés désinfectantes
Ce biocide désinfecte grâce à son pouvoir oxydant, il est :
Cependant, l'eau de Javel ne lave pas ; Pour désinfecter une surface, il faut d'abord la nettoyer avec un détergent, avant d'appliquer l'eau de javel sur la surface propre.
L'eau de Javel permet de tuer les bactéries et autres microbes qui entrent en contact avec elle ou avec certains de ses sous-produits (chlore gazeux). Pour cela il faut que les microbes ne soient pas protégés dans un biofilm, dans un autre organisme qui ferait écran, ou dans un épais mucus). L'eau de javel peut être utilisée pour le traitement de l'eau potable. Pour être totalement efficace, l'eau de Javel doit agir au moins un quart d'heure.Réaction avec les acides
L'eau de Javel mise en contact avec un acide va libérer des ions H+, l'équilibre chimique (2) va être déplacé vers la droite. La réaction suivante va se produire :
- HClO + H+ + Cl- → Cl2 + H2O
Il se produit alors un dégagement de dichlore qui est un gaz très toxique. C'est pour cela que l'eau de Javel ne doit jamais être en contact avec des acides, que l'on trouve par exemple dans les produits détartrants ou dans l'urine.
Réaction avec l'ammoniac
Lorsqu'ils sont mis en présence, l'acide hypochloreux (HClO) et l'ammoniac (NH3) donnent des chloramines selon les réactions suivantes :
- NH3 + HOCl → NH2Cl + H2O
- ammoniac + acide hypochloreux → monochloramine + eau
puis :
- NH2Cl + HOCl → NHCl2 + H2O
- monochloramine + acide hypochloreux → dichloramine + eau
et ensuite :
- NHCl2 + HOCl → NCl3 + H2O
- dichloramine + acide hypochloreux → trichloramine + eau
Les chloramines gazeuses sont très irritantes. C'est pour cela qu'il ne faut pas mélanger l'eau de Javel avec de l'ammoniaque.
C'est la même réaction qui a lieu lorsqu'un nageur urine dans l'eau d'une piscine désinfectée au chlore. C'est aussi la raison pour laquelle il ne faut pas nettoyer une litière d'un animal domestique avec de l'eau de Javel. L'urée contenue dans l'urine est un produit azoté. Il va donc se former des chloramines irritantes pour les muqueuses et les yeux.
Propriétés oxydantes
L'eau de Javel a des propriétés oxydantes dues à l'ion hypochlorite ClO-. L'ion ClO- est un oxydant puissant. Cet agent actif est à l'origine du pouvoir blanchissant de l'eau de Javel. L'ion Cl- est son réducteur conjugué. On définit le couple rédox ClO- / Cl-. La réaction de réduction de l'ion hypochlorite ClO- s'écrit :
- ClO- + 2 H3O+ + 2e- → Cl- + 3 H2O
La décomposition de l'eau de Javel en ion hypochlorite et acide hypochloreux dépend fortement du pH du milieu : à des pH supérieurs à 8, l'eau de Javel perd de son activité désinfectante car elle ne libère plus que 25 % (environ) d'ion biocide ClO-. Il faut alors avoir recours à un complément, le brome par exemple.
Autres propriétés
Le pH de l'eau de Javel est basique et compris entre 5,5 et 12,5.
Voir aussi
Notes et références de l'article
- ↑ a et b HYPOCHLORITE DE SODIUM (SOLUTION, CHLORE ACTIF =5% et HYPOCHLORITE DE SODIUM (SOLUTION, CHLORE ACTIF >5%), fiches de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultées le 9 mai 2009
- ↑ ESIS. Consulté le 6 décembre 2008
- ↑ un document sur l'histoire de l'eau de javel[pdf]
- ↑ Voir fiche toxicologique déjà citée dans les notes et références de cette page
- ↑ a et b (en) Report of an expert panel – Interpretive review of potential adverse effects of chlorinated organic chemicals on human health and environment. Chapitre 2 : Chlorine. Regulatory Toxicology and Pharmacology, 1994, 20, 1, 2e partie, p. S69-S125
- ↑ (en)Sodium hypochlorite – In: Base de données HSDB. Hamilton, Centre Canadien d’Hygiène et de Sécurité, 1999
- ↑ a , b et c (en)Sodium hypochlorite – In: Base de données IUCLID. Ispra, CEC, ECB, Environment Institute, 1995.
- ↑ (en)Sodium hypochlorite – In: Base de données CHEMINFO. Hamilton, CentreCanadien d’Hygiène et de Sécurité, 1999, n° 351.
- ↑ a et b (en)IARC Monographs on the evaluation of carcinogenic risks of chemicals to humans – Hypochlorite salts – In: Chlorinated drinking-water ; Chlorination by-products ; some other halogenated compounds; cobalt and cobalt compounds. Lyon, CIRC/IARC (Centre international de recherche sur le cancer), 1991, vol. 52, p. 159-176.
- ↑ [1] Article sur l'eau de Javel. Raffa
Articles connexes
- Chlore
- Désinfectant, Biocide
- Résistances (d'organismes vivant)
- Eau de Dakin (eau de javel à usage médical)
Liens externes
- Fiche toxicologique INRS (Version 2006)(fr)
- L'eau de Javel sur le site de la Société française de chimie (fr)
- Chambre Syndicale Nationale de l’Eau de Javel (CSNEJ) (fr)
- Portail de la chimie
Catégories : Composé du sodium | Produit chimique corrosif | Produit chimique dangereux pour l'environnement | Hypochlorite | Solution | Produit chimique domestique | Hygiène
Wikimedia Foundation. 2010.


