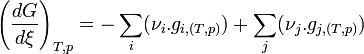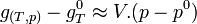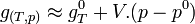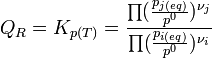- Equilibre chimique
-
Équilibre chimique
Un système chimique est à l'équilibre lorsque les variables intensives qui le décrivent (température, pression et activités chimiques des réactifs et des produits) sont homogènes dans tout le système et restent constantes au cours du temps.
Une réaction chimique ne se traduit pas toujours par la disparition complète des réactifs en étant qualifiée alors de réaction totale. De nombreuses réactions sont partielles et aboutissent à un équilibre entre les réactifs de départ et les produits de la réaction. L'ampleur de la réaction est caractérisé par l'état d'avancement :
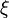 . Lorsqu'une réaction est équilibrée, cela signifie que la vitesse de la réaction dans le sens réactifs-produits est égale à la vitesse de la réaction dans le sens produits-réactifs. L'état d'équilibre obtenu dans ce cas peut être qualifié de dynamique ou stationnaire.
. Lorsqu'une réaction est équilibrée, cela signifie que la vitesse de la réaction dans le sens réactifs-produits est égale à la vitesse de la réaction dans le sens produits-réactifs. L'état d'équilibre obtenu dans ce cas peut être qualifié de dynamique ou stationnaire.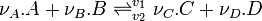
où
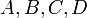 sont des espèces chimiques,
sont des espèces chimiques, 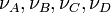 les coefficients stœchiométriques et
les coefficients stœchiométriques et 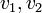 les vitesses de réaction.
les vitesses de réaction.
Dans le cas de réactions élémentaires, c'est à dire s'effectuant en une seule étape, les vitesses dépendent des concentrations![[A],[B],[C],[D]~](/pictures/frwiki/55/7449d544db8f53afc3d3e693a71a6a4e.png) , des espèces en présence, selon les expressions:
, des espèces en présence, selon les expressions:![v_1 = k_1 . [A]^{\nu_A}.[B]^{\nu_B}~](/pictures/frwiki/102/fb1a5b4d58cd62a8836cba1a8da84f01.png)
![v_2 = k_2 . [C]^{\nu_C}.[D]^{\nu_D}~](/pictures/frwiki/100/d4a7203e25a5c53475c79856a06321f5.png)
L'égalité des vitesses des réactions opposées entraîne la relation suivante:
![\frac {k_1}{k_2} = \frac {[C]^{\nu_C}.[D]^{\nu_D}}{[A]^{\nu_A}.[B]^{\nu_B}} = K_c~](/pictures/frwiki/48/091d5dfcdc804b5ba0ff0168958683e5.png)
Guldberg et Waage (1865), en s'inspirant de propositions de Berthollet, ont ainsi montré empiriquement qu'il existait une relation entre les concentrations des espèces présentes à l'équilibre en solution.
La constante d'équilibre
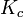 , relative aux concentrations, a été appelée constante de Guldberg et Waage ou constante de la loi d'action des masses.
, relative aux concentrations, a été appelée constante de Guldberg et Waage ou constante de la loi d'action des masses.Le développement ultérieur de la thermodynamique et l'application de la fonction enthalpie libre : G aux réactions chimiques effectuées à température et pression constante, a permis de démontrer cette loi d'action des masses et d'établir la relation formulée empiriquement par Guldberg et Waage. Pour cela, il est nécessaire de définir précisément des grandeurs de réaction indispensables à la compréhension des phénomènes : enthalpie libre de réaction,
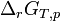 , enthalpie libre standard de réaction,
, enthalpie libre standard de réaction, 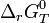 , quotient de réaction,
, quotient de réaction, 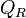 et constante d'équilibre,
et constante d'équilibre, 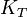 . Ces outils permettent alors de prévoir le sens d'une réaction, le positionnement de l'équilibre et la composition du système.
. Ces outils permettent alors de prévoir le sens d'une réaction, le positionnement de l'équilibre et la composition du système.Le développement mathématique qui suit est plutôt difficile, mais il est essentiel pour comprendre les relations, leurs conditions d'application et leurs limites.
Réaction chimique et avancement de réaction
- Considérons une réaction chimique effectuée à T et à pression constante dont l'équation bilan est la suivante:
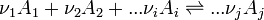
- Les constituants du premier membre (réactifs) sont indicés
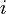 ; ceux du second membre (produits) étant indicés
; ceux du second membre (produits) étant indicés 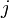 .
.
Lorsque la réaction progresse les constituants
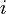 disparaissent alors que se forment les constituants
disparaissent alors que se forment les constituants 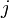 . Considérons une petite progression caractérisée par une variation élémentaire de l'état d'avancement,
. Considérons une petite progression caractérisée par une variation élémentaire de l'état d'avancement, 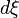 de la réaction, et appelons
de la réaction, et appelons 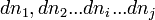 , les variations élémentaires du nombre de moles de chaque constituant, à ce stade de la réaction.
, les variations élémentaires du nombre de moles de chaque constituant, à ce stade de la réaction.La réaction progresse en respectant la stoechiométrie de l'équation bilan ce qui implique que tous les rapports
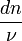 sont égaux au signe près.
sont égaux au signe près.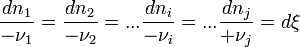
La variable
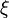 peut donc être définie sur l'un quelconque des constituants et il existe une relation entre
peut donc être définie sur l'un quelconque des constituants et il existe une relation entre 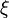 et chaque constituant. La connaissance de
et chaque constituant. La connaissance de 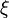 permet donc de connaître la composition du système. C'est donc une variable de composition.
permet donc de connaître la composition du système. C'est donc une variable de composition.Enthalpie libre de réaction:
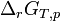
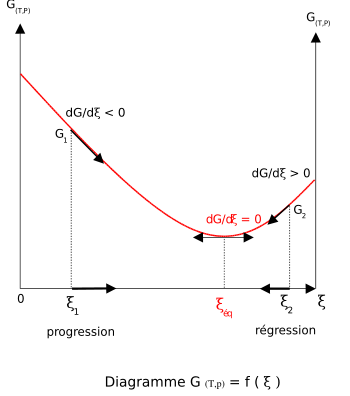
La fonction enthalpie libre, G permet de définir le sens d'une réaction chimique effectuée à T et P constante. Si la réaction est équilibrée, le minimum de G permet de définir l'équilibre et la composition du système réactionnel. Il faut donc calculer G pour un avancement donné
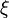 . L'enthalpie libre est une grandeur extensive égale à la somme des enthalpies libres des constituants du système (théorème d'Euler).
. L'enthalpie libre est une grandeur extensive égale à la somme des enthalpies libres des constituants du système (théorème d'Euler).- Soient
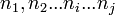 les nombres de moles pour l'état
les nombres de moles pour l'état 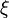 et
et 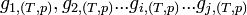 les enthalpies libres molaires de chaque constituant à T et P.
les enthalpies libres molaires de chaque constituant à T et P. - L'enthalpie libre molaire est une grandeur molaire partielle définie par la relation:
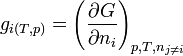 .
.
- Il s'ensuit:
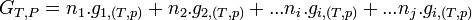
- Pour une variation élémentaire
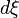 :
: 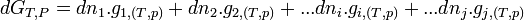
- or
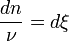 en tenant compte du signe négatif pour les réactifs
en tenant compte du signe négatif pour les réactifs 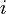 .
. - Donc,
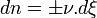
- d'où
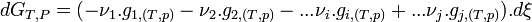
- Regroupons les termes correspondant aux réactifs
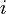 et aux produits
et aux produits 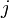 .
.
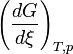 est la dérivée de G par rapport à
est la dérivée de G par rapport à 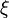 . Elle est égale à l'opposée de l'affinité chimique
. Elle est égale à l'opposée de l'affinité chimique 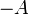 . La connaissance de son signe permettra de connaître le sens de l'évolution de G et donc le sens de la réaction. Lorsque cette dérivée sera nulle, la fonction G sera minimale et le système réactionnel sera à l'équilibre.
. La connaissance de son signe permettra de connaître le sens de l'évolution de G et donc le sens de la réaction. Lorsque cette dérivée sera nulle, la fonction G sera minimale et le système réactionnel sera à l'équilibre.
- L'expression
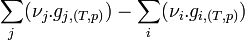 est appelé enthalpie libre de réaction à T,p et est formalisée par l'expression
est appelé enthalpie libre de réaction à T,p et est formalisée par l'expression 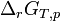 .
.
- Remarques: On exprime souvent l'enthalpie libre de réaction sans différencier les réactifs
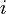 des produits
des produits 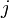 et l'enthalpie libre molaire
et l'enthalpie libre molaire 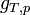 est appelé potentiel chimique défini par la relation:
est appelé potentiel chimique défini par la relation: 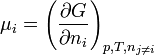 .
.
- ce qui donne:
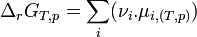 .
.
Pour résumer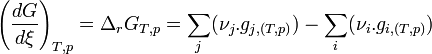
Variation de l'enthalpie libre molaire en fonction de P à T constante
Les valeurs d'enthalpies libres molaires de chaque constituant peuvent être calculées à partir de tables thermodynamiques ( en réalité elles ne sont pas connues de façon absolue; une échelle arbitraire d'enthalpie libre ayant été définie: voir enthalpie standard de formation) mais ces valeurs correspondent à la pression standard P° = 1 bar. Il faut donc connaître la variation de
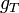 en fonction de P. De plus, même si la réaction est effectuée à pression constante, dans le cas d'un mélange homogène de gaz, les pressions partielles de chaque gaz du mélange varient au cours de la réaction à pression totale constante. C'est ce phénomène qui permet d'aboutir à un équilibre correspondant au minimum de la fonction G.
en fonction de P. De plus, même si la réaction est effectuée à pression constante, dans le cas d'un mélange homogène de gaz, les pressions partielles de chaque gaz du mélange varient au cours de la réaction à pression totale constante. C'est ce phénomène qui permet d'aboutir à un équilibre correspondant au minimum de la fonction G.
Pour un corps pur la différentielle de G est égale à: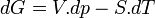 (voir enthalpie libre)
(voir enthalpie libre)
A température constante, la différentielle de l'enthalpie libre molaire est:
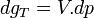 .
.Intégrons entre P° et P
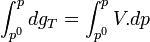
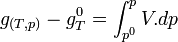
Trois cas principaux peuvent se présenter:
- Le système ne comprend que des phases condensées (solides ou liquides) séparées. Le milieu est hétérogène.
- Le système comprend un mélange de gaz (considérés comme parfait: système idéal).
- Le système est une solution contenant des espèces moléculaires ou ioniques.
Les phases condensées sont peu compressibles. Si la variation de pression n'est pas trop importante ( quelques dizaines de bar), le volume molaire variera peu et on peut dans ce cas considérer que V est pratiquement constant.
Il est même possible de considérer, avec une bonne approximation que
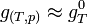 (appelée enthalpie libre molaire standard à T équivalente au potentiel chimique,
(appelée enthalpie libre molaire standard à T équivalente au potentiel chimique, 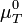 ).
).
Dans le cas d'un système composé d'un mélange de gaz parfaits, l'évolution en fonction de P ne peut plus être négligée car les gaz sont compressibles. Si on applique l'équation d'état du gaz parfait: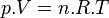
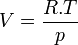 si n est égal à 1 mol.
si n est égal à 1 mol.
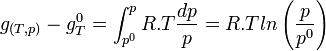
d'où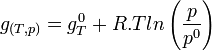
Enthalpie libre standard de réaction:
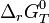
La dérivée de
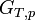 par rapport à
par rapport à 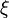 est égale à l'enthalpie libre de réaction,
est égale à l'enthalpie libre de réaction, 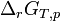 .
.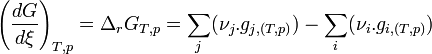
Remplaçons les enthalpies libres molaires par leur expression en fonction de P
- Pour les gaz:
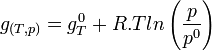
- Pour les solides ou liquides:
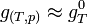
On regroupe les termes standards
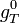 et les termes correspondant aux gaz
et les termes correspondant aux gaz 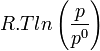 .
.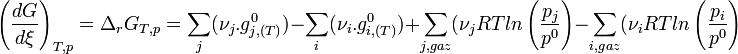
L'expression regroupant les termes standards correspond à l'enthalpie libre standard de réaction à T. C'est une constante qui est accessible à partir des tables thermodynamiques.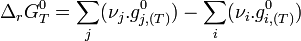
Les termes relatifs aux gaz peuvent être regroupés sous le logarithme; chaque somme devenant un produit.
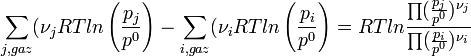
L'expression sous le logarithme regroupant les pressions partielles de chaque gaz est appelée quotient de réaction:
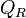 .
.- Ces pressions partielles ne sont pas les pressions de l'équilibre car le système est hors équilibre.
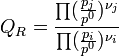
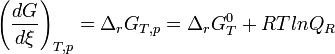
Cette relation, établie dans le cas d'un mélange de gaz parfaits formant un système idéal, peut être généralisée aux systèmes contenant des gaz réels ou des solutions. Il suffit de remplacer les pressions partielles par l'activité chimique de chaque constituant.Équilibre chimique et constante d'équilibre
Le deuxième principe de la thermodynamique implique que pour une réaction chimique effectuée à T et P constante la fonction
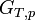 ne peut que décroître. Donc sa dérivée doit être négative:
ne peut que décroître. Donc sa dérivée doit être négative: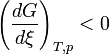
Cette propriété est le critère d'évolution de tout système chimique.
Lorsque la dérivée s'annule, la fonction
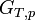 est minimale. Cela signifie que le système réactionnel est à l'équilibre:
est minimale. Cela signifie que le système réactionnel est à l'équilibre: 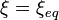 . Dans ces conditions les pressions partielles sont celles de l'équilibre. Le quotient de réaction
. Dans ces conditions les pressions partielles sont celles de l'équilibre. Le quotient de réaction 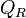 devient égal à la constante d'équilibre:
devient égal à la constante d'équilibre: 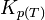 relative aux pressions partielles.
relative aux pressions partielles.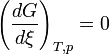
L'équilibre est atteint:On reconnait alors l'expression de la constante d'équilibre appelée aussi constante de la loi d'action des masses.
A l'équilibre:
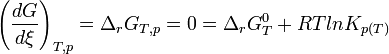
d'où
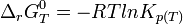
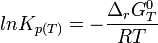
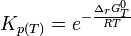
Dans le cas d'une solution idéale on peut remplacer les activités chimiques par les concentrations et on définit la constante,
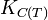 relative aux concentrations.
relative aux concentrations.L'enthalpie standard de réaction,
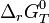 , ne permet pas de définir le sens d'une réaction car il faut connaître les conditions initiales définies par le quotient de réaction,
, ne permet pas de définir le sens d'une réaction car il faut connaître les conditions initiales définies par le quotient de réaction, 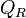 . En revanche elle permet de calculer la constante d'équilibre,
. En revanche elle permet de calculer la constante d'équilibre, 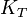 .
.Déplacement d'un équilibre chimique par ajout d'un réactif ou d'un produit
Considérons un système réactionnel à l'équilibre:
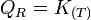 ;
; 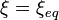 .
.- Si l'on modifie l'activité d'un constituant, le quotient de réaction varie et n'est plus égal à la constante d'équilibre:
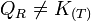
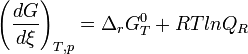
et
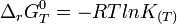
d'où
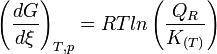
- Supposons que l'on augmente l'activité d'un réactif
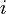
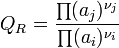 , le quotient de réaction relatif aux activités va diminuer.
, le quotient de réaction relatif aux activités va diminuer.- donc
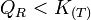 ce qui implique que
ce qui implique que 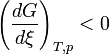 : la réaction progresse.
: la réaction progresse.- Si l'on augmente l'activité d'un produit
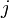 , on obtient le phénomène inverse et la réaction régresse.
, on obtient le phénomène inverse et la réaction régresse.
Article détaillé : Déplacement d'équilibre.Notes et références
- Paul Arnaud, Cours de chimie physique, Dunod (1990).
- (en) P.W. Atkins, Physical Chemistry, third ed., Oxford University Press, 1985, pp. 212–216.
Voir aussi
Articles connexes
- constante d'équilibre
- réaction chimique
- Enthalpie libre
- Enthalpie
- Deuxième principe de la thermodynamique
Liens externes
- Portail de la physique
- Portail de la chimie
Catégories : Thermodynamique | Thermochimie
Wikimedia Foundation. 2010.