- Chlorate
-
Un chlorate est un composé chimique contenant l'anion chlorate, de formule brute ClO3-. Cet anion est la base conjuguée de l'acide chlorique HClO3, et les chlorates sont les sels de cet acide.
Ce sont par exemple le chlorate de potassium KClO3, le chlorate de sodium NaClO3 et le chlorate de magnésium Mg(ClO3)2.
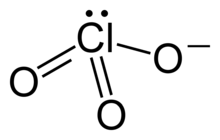
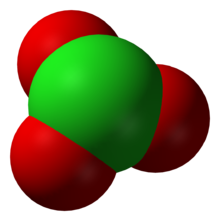
L'anion ClO3- a une configuration pyramidale à base triangulaire, l'atome de chlore étant lié à trois atomes d'oxygène.
Les chlorates sont de puissants oxydants à conserver à l'écart des matières organiques et des matériaux facilement oxydables. Les chlorates forment avec à peu près n'importe quel combustible (du sucre, de la sciure de bois, du charbon de bois, des solvants organiques, de la poudre métallique, etc.) des mélanges déflagrants, et ont été pour cette raison largement employés en pyrotechnie, bien que leur utilisation à cette fin soit aujourd'hui tombée en désuétude du fait de leur instabilité — on utilise plutôt des perchlorates ClO4-, qui sont plus stables.
Sommaire
Structure
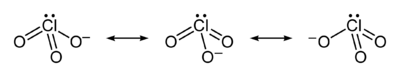
L'ion chlorate, dans lequel le chlore est hypervalent, ne peut être représenté par une unique structure de Lewis car les trois liaisons Cl–O ont la même longueur (149 pm dans le chlorate de potassium KClO3[1]). On le représente généralement comme la résultante de trois mésomères en résonance :
Préparation
Au laboratoire
Les chlorates de métaux peuvent être préparés par l'action à chaud du chlore Cl2 sur des hydroxydes métalliques tels que l'hydroxyde de potassium KOH :
Le chlore subit une dismutation au cours de cette réaction, étant à la fois oxydé en chlorate ClO3- à l'état d'oxydation +5 et réduit en chlorure Cl- à l'état d'oxydation -1.
À froid, l'oxydation est moins poussée et il se forme des hypochlorites ClO- à la place des chlorates.
Dans l'industrie
On fabrique le chlorate de sodium NaClO3 non pas à partir de chlore Cl2 gazeux, mais par électrolyse d'une saumure (solution aqueuse concentrée) de chlorure de sodium NaCl et d'hydroxyde de sodium NaOH à 50-70 °C.
Toxicité
Les chlorates sont plutôt toxiques, mais sont généralement réduits en chlorures, qui sont sans danger.
Notes et références
- J. Danielsen, A. Hazell, F. K. Larsen, « The structure of potassium chlorate at 77 and 298 K », dans Acta Cryst., vol. B37, 1981, p. 913–915 [lien DOI]
Voir aussi
Articles connexes
- Hypochlorite ClO-
- Chlorite ClO2-
- Perchlorate ClO4-
Wikimedia Foundation. 2010.