- Néon
-
Néon Fluor ← Néon → Sodium He 
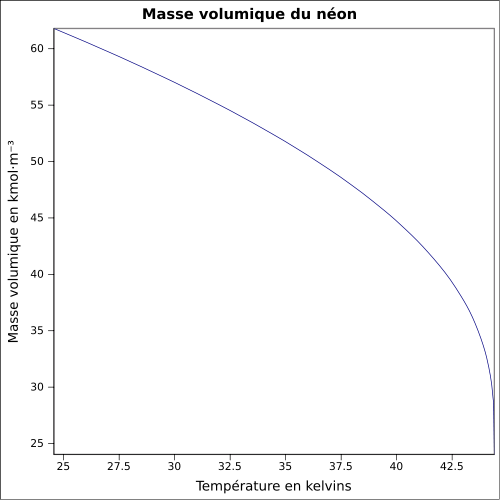
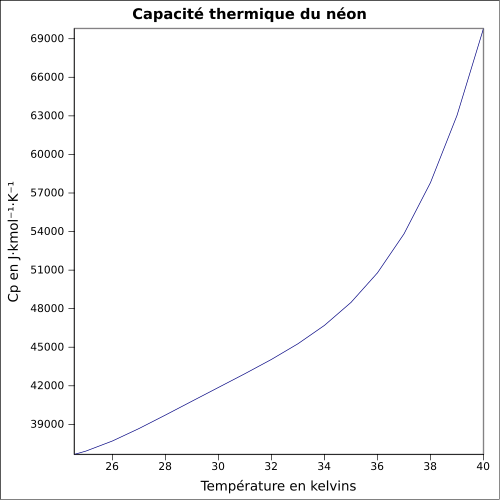
10Ne ↑ Ne ↓ Ar Table complète • Table étendue Informations générales Nom, symbole, numéro Néon, Ne, 10 Série chimique Gaz rare Groupe, période, bloc 18 (VIIIA), 2, p Masse volumique 0,89990 g·l-1 (1 atm, 0 °C)[1] Couleur incolore No CAS No EINECS Propriétés atomiques Masse atomique 20,1797 ± 0,0006 u[1] Rayon atomique (calc) (38 pm) Rayon de covalence 0,58 Å[3] Rayon de van der Waals 154 pm Configuration électronique [He] 2s2 2p6 Électrons par niveau d’énergie 2, 8 État(s) d’oxydation 0 Oxyde inconnu Structure cristalline Cubique face centrée Propriétés physiques État ordinaire Gaz (non magnétique) Point d’ébullition -246,053 °C[1] Énergie de fusion 0,3317 kJ·mol-1 Énergie de vaporisation 1,71 kJ·mol-1 (1 atm, -246,05 °C) Température critique -228,7 °C[1] Point triple -248,5939 °C[4] Volume molaire 13,23×10-3 m3·mol-1 Pression de vapeur Vitesse du son 936 m·s-1 à 20 °C Divers Chaleur massique 1 028 J·kg-1·K-1 Conductivité thermique 0,0493 W·m-1·K-1 Énergies d’ionisation[5] 1re : 21,56454 eV 2e : 40,96296 eV 3e : 63,45 eV 4e : 97,12 eV 5e : 126,21 eV 6e : 157,93 eV 7e : 207,2759 eV 8e : 239,0989 eV 9e : 1 195,8286 eV 10e : 1 362,1995 eV Isotopes les plus stables iso AN Période MD Ed PD MeV 20Ne 90,48 % stable avec 10 neutrons 21Ne 0,27 % stable avec 11 neutrons 22Ne 9,25 % stable avec 12 neutrons Précautions Directive 67/548/EEC[6] Phrases S : 38, SIMDUT[7] 
SGH[6] 
AttentionUnités du SI & CNTP, sauf indication contraire.  Cet article concerne le gaz. Pour les autres significations, voir Néon (homonymie).
Cet article concerne le gaz. Pour les autres significations, voir Néon (homonymie).Le néon est un élément chimique, de symbole Ne et de numéro atomique 10.
C’est un gaz rare presque inerte et sans couleur. Le néon donne une lueur rougeâtre distinctive lorsqu’il est utilisé dans les tubes à vide et les lampes néon.
On le trouve sous forme de traces dans l’atmosphère, où sa concentration est de 18 ppm.
Sommaire
Caractéristiques notables
Le néon est le second gaz rare, il possède 40 fois la capacité de réfrigération de l’hélium liquide et trois fois celle de l’hydrogène liquide (à volume égal). Dans la plupart des applications, c’est un réfrigérant moins cher que l’hélium.
À des tensions et des courants normaux, le néon a la décharge la plus intense de tous les gaz rares et prend une teinte rouge orangé.
Applications
La couleur orange rougeâtre que le néon émet dans les tubes néon est largement utilisée pour les signaux publicitaires. « Néon » est devenu le nom donné à ce type de lumière bien qu’en réalité de nombreux autres gaz soient utilisés. Il s’agit d’un abus de langage, en particulier pour l’éclairage domestique ; il s’agit en réalité de tubes fluorescents ou tubes luminescents (de leur nom officiel).
Autres utilisations :
- paratonnerres ;
- dans les écrans de télévision dits « plasma » en mélange avec le xénon ;
- le néon est utilisé dans certains lasers.
Le néon liquéfié est utilisé commercialement comme réfrigérant cryogénique.
Remarque
C’est par une généralisation abusive qu’on dénomme néons tous les tubes fluorescents et notamment ceux des enseignes lumineuses. Seul le rouge est en effet possible avec le néon et les autres couleurs sont, soit obtenues avec d’autres composés (hélium-jaune, CO2-blanc, argon-violet, argon/mercure-bleu), soit produites par un revêtement fluorescent excité par un rayonnement ultraviolet.
Historique
Néon vient du grec νέος (neon) qui signifie « nouveau ».
Sir William Ramsay et Morris Travers ont découvert le néon en Grande-Bretagne, dans l’air liquéfié, en 1898. Il appartient au groupe 18 du tableau périodique, il est donc dans la famille des gaz inertes, composé de 10 neutrons, 10 protons ainsi que de 10 électrons. Le néon est présent dans l’atmosphère à une concentration de 0,0018 %. On peut le trouver à l’état naturel sous trois formes isotopiques : 20Ne (le plus abondant), 21Ne et 22Ne.
Voir aussi
Notes et références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, 2009, 90e éd., Relié, 2804 p. (ISBN 978-1-420-09084-0).
- (en) Robert H. Perry et Donald W. Green, Perry’s Chemical Engineers’ Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », dans Dalton Transactions, 2008, p. 2832 - 2838 [lien DOI].
- Procès-verbaux du Comité international des poids et mesures, 78e session, 1989, p. T1-T21[PDF] (et p. T23-T42, version anglaise).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, TF-CRC, 2006, 87e éd. (ISBN 0849304873), p. 10-202.
- SIGMA-ALDRICH.
- « Néon » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
Wikimedia Foundation. 2010.