- Bicarbonate de sodium
-
Bicarbonate de sodium 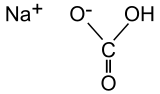
Structure du bicarbonate de sodium Général Nom IUPAC hydrogénocarbonate de sodium Synonymes Bicarbonate de soude (appellation fausse) No CAS No EINECS No E E500(ii) SMILES InChI Apparence solide blanc de formes variables[1]. Propriétés chimiques Formule brute NaHCO3 Masse molaire[2] 84,0066 ± 0,0018 g·mol-1
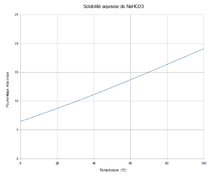
C 14,3 %, H 1,2 %, Na 27,37 %, O 57,14 %,pKa 10,3 Propriétés physiques T° fusion 50 °C (décomposition)[3] Solubilité 87 g·l-1 (eau, 20 °C)[1]
Insol. dans l'EtOH[3]Masse volumique 2,22 g·cm-3 (20 °C)[4] Thermochimie Cp 87,7 kJ·K-1·mol-1 (25 °C)[3] Précautions SIMDUT[5] Produit non contrôlé Unités du SI & CNTP, sauf indication contraire. L'hydrogénocarbonate de sodium ou bicarbonate de sodium ou carbonate monosodique ou bicarbonate de soude (appellation la plus commune, mais ne correspondant pas aux dénominations normalisées des composés chimiques) ou carbonate acide de sodium (appellation la plus employée dans la composition des pâtisseries industrielles) a pour formule NaHCO3. C'est un composé blanc, qui se présente sous forme de poudre.
Sommaire
Histoire
Les Égyptiens de l'Antiquité utilisaient déjà les propriétés du natron, un minéral composé de carbonate de sodium et de bicarbonate de sodium. Ils tiraient cette substance de l'évaporation des lacs salés et l'employaient pour se frotter le corps, comme un savon.
En 1791, un chimiste français élabore pour la première fois le bicarbonate de sodium, tel que nous le connaissons aujourd'hui, cependant le raffinage du carbonate de sodium pour donner du bicarbonate de sodium a été mis au point en 1846 par deux boulangers new-yorkais : John Dwight et Austin Church.
Production et synthèse
Le bicarbonate de sodium peut être obtenu à partir de gisements de natron.
Le procédé dit "Solvay", du nom de son inventeur, produit du carbonate de sodium (Na2CO3) à partir de sel et de craie. Puis ce carbonate de sodium donne du bicarbonate de sodium selon la réaction suivante :
- Na2CO3 + H2O + CO2 → 2 NaHCO3
Propriétés physico-chimiques
Le bicarbonate de sodium est biodégradable et n'est pas toxique pour l'environnement ni pour la santé.
Le bicarbonate de sodium ne doit pas être confondu avec la soude caustique ni avec le carbonate de sodium.
Le bicarbonate de sodium perd du dioxyde de carbone à 50 °C et est converti en carbonate de sodium à 100 °C[3].
Les utilisations
Le bicarbonate rend de nombreux services pour l'entretien du linge et de la maison, mais aussi pour l'hygiène, les soins du corps et pour la cuisine.
Pour la maison
- agent nettoyant ;
- adoucisseur d'eau ;
- désodorisant ;
- rafraîchit les tapis ;
- utilisé dans certains extincteurs à poudre ;
- Il peut être utilisé pour éteindre un incendie lorsque l'usage de l'eau est déconseillé. Par exemple pour les feux de friture.
- Il bloque le développement des allergènes d'acariens acari (Dermatophagoïdes pteronyssinus et D. farinae) - 20 g/m2 en poudre sur les tapis, moquette et matelas
- Utilisé contre les fourmis en bouchant les trous avec un peu de bicarbonate.
Pour les soins du corps (bicarbonate alimentaire)
- blanchit les dents (dentifrice confectionné en mélangeant avec de l'eau oxygénée) - attention, le bicarbonate agit par abrasion et l'eau oxygénée attaque les gencives : n'en abusez pas ;
- nettoie la peau en profondeur (gommage): confectionner une pâte avec trois volumes de bicarbonate et un volume d'eau, masser doucement la peau par cercles concentriques et rincer. La peau est prête à recevoir une crème hydratante.
- attendrit les durillons et réduit la démangeaison occasionnée par le pied d'athlète - attention, le pied d'athlète est une mycose, qu'il faut traiter : combattre les symptômes ne suffit pas, il faut consulter un médecin ;
- utilisé pour les gargarismes - attention, le mal de gorge peut être dû à une maladie : s'il persiste plus de quelques jours, consultez un médecin ;
- calme les maux d'estomac, en buvant une préparation réalisée avec une cuillerée à café de bicarbonate de sodium dans un verre d'eau froide - attention, le mal d'estomac peut être dû à une maladie : s'il persiste plus d'un jour ou deux, consultez un médecin ;
- calme l'eczéma (une demi-tasse de bicarbonate de sodium dans un bain chaud de 15 à 20 minutes) - attention, l'eczéma peut être dû à des causes graves, comme allergies, stress etc. : s'il persiste, consultez un médecin ;
- calme les coups de soleil avec des compresses trempées dans une solution réalisée avec une cuillerée à soupe de bicarbonate de sodium dans 25 cl d'eau - les coups de soleil causent des cancers de la peau et sont à éviter absolument, par ailleurs, le bicarbonate de sodium ne dispense pas d'utiliser également une crème réparatrice une fois le mal fait et un écran protecteur pour éviter de l'aggraver ;
- utilisé aussi pour les boutons de fièvre, les gencives douloureuses, les maux de gorge, les mycoses, les piqûres d'insectes et les verrues - attention, le bouton de fièvre est un symptôme de l'herpès, qui est très contagieux : le bicarbonate de sodium n'empêche pas la contagion, consultez un médecin - attention, mycoses et verrues sont des maladies qu'il faut traiter correctement, consultez un médecin.
- Nettoie les dreadlocks en profondeur, pour en éliminer toutes les poussières et autres pollutions de la vie quotidienne.
Pour la cuisine (bicarbonate alimentaire)
- mélangé à de l'acide citrique et des cristaux de gélatine vous obtenez du sucre pétillant (après avoir chauffé)
- mélangé avec de l'acide dans la levure chimique, il dégage du dioxyde de carbone, ce qui rend les plats plus aérés et plus digestes ;
- facilite la digestion des aliments ;
- jeté dans l'eau bouillante (une pincée par litre d'eau), il garde leur couleur verte aux légumes cuits à l'eau tels que les haricots verts ou les brocolis.
- dans les aliments industriels, c'est l'additif alimentaire numéro E500(ii)[6]. Il est utilisé comme agent de levuration, anti-agglomérant ou comme régulateur de pH[7].
Autres utilisations
- anodisation de l'aluminium ;
- purification des fumées et reminéralisation des eaux ;
- jardinage : Fongicide (pour lutter contre l'oïdium par exemple) et utilisé contre les fourmis en solution et en grande quantité (plus de 3 litres soit deux bouteilles classiques) à verser dans la fourmilière.
- Formation de crack à partir de cocaïne
Annexes
Au Québec, dans le langage courant, il peut être appelé parfois la « petite vache ». Cela en raison de la petite vache représentée sur les boîtes de bicarbonate de sodium vendues par la compagnie Cow Brand, il y a de cela plusieurs années.
Notes et références
- BICARBONATE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- « Sodium bicarbonate » dans la base de données Hazardous Substances Data Bank, consulté le 10 août 2010
- Entrée de « Sodium hydrogen carbonate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 10 août 2010 (JavaScript nécessaire)
- « Bicarbonate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Parlement européen et Conseil de l'Union européenne, « DIRECTIVE 95/2/CE concernant les additifs alimentaires autres que les colorants et les édulcorants du 20 février 1995 », dans Journal officiel, no L 61, 18. 3. 1995, p. 1-56 [texte intégral (page consultée le 24/04/2008.)]
- Codex Alimentarius (1989) Noms de catégorie et système international de numérotation des additifs alimentaires. CAC/GL 36-1989, p1-35.
Bibliographie
- Martina Krčmár : Le bicarbonate, saveurs et vertus, éd. Grancher.
- Clémence Lefèvre : Les merveilleux pouvoirs du bicarbonate de soude, Ed. Exclusif, ISBN 978-2-84891-083-3
- Nicolas Palangié : Bicarbonate: un concentré d'astuces pour votre maison, votre santé, votre beauté, Ed. Eyrolles, ISBN 978-2-212-55144-0
Liens externes
Articles connexes