- Nitrate de sodium
-
Nitrate de sodium 
Général Nom IUPAC Nitrate de sodium Synonymes Salpêtre du chili No CAS No EINECS No E E251 Apparence poudre blanche hygroscopique
ou cristaux incoloresPropriétés chimiques Formule brute NaNO3 Masse molaire[1] 84,9947 ± 0,0011 g·mol-1
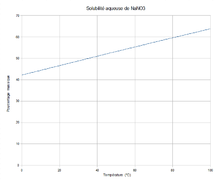
N 16,48 %, Na 27,05 %, O 56,47 %,Propriétés physiques T° fusion 308 °C[2] T° ébullition 380 °C décomposition en dioxygène, nitrite de sodium, gaz nitreux, peroxyde de sodium Solubilité dans l'eau à 25 °C : 921 g·l-1[2].
8 g·l-1 alcool
19 g·l-1 alcool chaud
0,29 g·l-1 alcool absolu
3,3 g·l-1 méthanol absoluMasse volumique 2,3 g·cm-3[2] Thermochimie S0solide 117 J/mol.K ΔfH0solide -468 kJ/mol Précautions Directive 67/548/EEC 
Xn
OPhrases R : 8, 22, Phrases S : 22, 41, Transport 50 1498 NFPA 704 SIMDUT[3] 

Écotoxicologie DL50 rats 1,955g d'anions/kg Unités du SI & CNTP, sauf indication contraire. Le nitrate de sodium ou Salpêtre du Chili (ne pas confondre avec le nitrate de potassium) est utilisé pour recycler l'or des composants électroniques ou des poussières de bijouteries. Le nitrate de sodium est connu dans le hobby comme étant un substitut en poudre de l'acide nitrique pour faire de l'eau régale.
L'eau régale est un mélange d'acide nitrique et d'acide chlorhydrique utilisé pour dissoudre l'or. Le principe est que l'acide chlorhydrique dissout une petite partie d'or qui est réduit par l'acide nitrique. Comme le nitrate de sodium est un sel de l'acide nitrique et du sodium et que l'ion sodium n'influence pas la réaction, le nitrate de sodium peut être substitué à l'acide nitrique. Cette substitution est utilisé simplement parce que le nitrate de sodium est plus simple à obtenir et à manipuler pour le hobbyiste.
La suite des réactions chimiques de l'extraction de l'or en utilisant le nitrate de sodium comprend une neutralisation de l'acide (souvent à l'aide d'urée), puis la précipitation de l'or sous forme de boue (souvent avec du meta bisulfite de sodium). Le boue est ensuite fondue et devient ainsi de l'or métallique.
Salpêtre du Chili
D'importants dépôts contenant jusqu'à 25% de nitrate de sodium furent exploités au Chili, dans le désert d'Atacama jusqu'à la Première Guerre mondiale. Ce gisement était la principale source d'engrais azoté jusqu'à la mise au point du procédé Haber par Fritz Haber et Carl Bosch pour la synthèse de l'ammoniac à partir de l'azote atmosphérique.
Références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- NITRATE DE SODIUM, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- « Nitrate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009