- Myoglobine
-
La myoglobine est une protéine des vertébrés formée chez l'homme d'une chaîne unique de 153 acides aminés, contenant un noyau porphyrique avec ion fer II au centre. Elle est le transporteur intracellulaire principal de l'oxygène dans les tissus musculaires et stocke l'oxygène dans les muscles. Elle est aussi impliquée dans la dégradation du NO, molécule très réactive et oxydante produite lors du processus de respiration oxydative.
À la différence de l'hémoglobine, à laquelle elle est apparentée structurellement, cette protéine est monomérique (formée d'une seule sous-unité). Sa couleur rouge et son abondance dans certains muscles ou chez certaines espèces expliquent la différence d'apparence entre viande blanche et viande rouge.
Sommaire
Structure
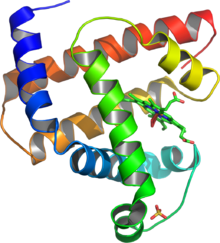
La myoglobine est une protéine de structure tertiaire composée de 8 hélices α dont 75% des acides aminés font partie de ces hélices α reliées par des boucles. Son poids moléculaire est de 17 kilodalton. Comme l'hémoglobine, la myoglobine est constituée d'une partie protéique, la globine, et d'une molécule appelée hème, qui renferme un ion Fe2+ hexavalent (4 liaisons dans le cycle porphyrique, une 5e avec une histidine de la chaîne protéique) sur lequel peut éventuellement se fixer une molécule de dioxygène ou un autre des ligands physiologiques de la myoglobine (NO en particulier) ou encore une molécule de CO (monoxyde de carbone) dont l'affinité pour la myoglobine est à l'origine 25 000 fois supérieure à celle du dioxygène. Cependant la fixation du CO2 empêche le bon positionnement spatial d'une histidine sur la chaîne E ce qui diminue son affinité d'un facteur 200. Une différence fondamentale de la myoglobine face à l'hémoglobine est que son groupement Fe2+ se situe à 0.3 Angström du plan du noyau tétrapyranolique appelé l'Hème. La fixation du dioxygène entraîne une traction sur l'ion fer qui subit une descente de 0.2 Angström ce qui le rapproche du plan de l'hème. La fixation du O2 n'est pas droite sur l'ion Fe2+ mais possède un angle de 120° qui favorise son interaction avec l'histidine ce qui entraîne une augmentation de la stabilité moléculaire. La coloration rougé de la myoglobine provient du fait que les électrons pi des doubles liaisons du groupement hème absorbent seulement les hautes longueurs d'onde et de ce fait, ne réémettent que la couleur rouge caractéristique de la protéine. L'ion fer peut s'oxyder et passer à l'état 3+ voire 4+ sous l'action de certaines molécules. Contrairement à l’hémoglobine qui se combine en hétérotétramère, elle n’est formée que d’une seule chaîne polypeptidique (structure monomérique). Cette protéine de forme globulaire est constituée, chez l’homme, d'un enchaînement de 153 acides aminés.
Découverte de la structure
En 1957, John Kendrew et ses collaborateurs déterminèrent avec succès la structure en trois dimensions de la myoglobine[1] par la cristallographie par rayons X. Pour cette découverte, il partagea en 1962, le prix Nobel de chimie avec Max Perutz.
Utilisation médicale
Sa concentration sanguine s'élève une à trois heures après un infarctus du myocarde et tend à se normaliser en moins de 24 h[2], mais son utilisation est supplantée par le dosage de la troponine, plus spécifique.
Voir aussi
Notes et références
- (en) J.C. Kendrew, G. Bodo, H.M. Dintzis, R.G. Parrish, H. Wyckoff et D.C. Phillipps, « A three-dimensional model of the myoglobin molecule obtained by x-ray analysis », dans Nature, vol. 181, 1958, p. 662-666 [lien PMID]
- Dekker MS, Mosterd A, van 't Hof AWJ, Hoes AW, [Novel biochemical markers in suspected acute coronary syndrome: systematic review and critical appraisal Marieke S Dekker, Arend Mosterd, Arnoud W J van 't Hof, Arno W Hoes Heart 2010;96:1001-1010 Novel biochemical markers in suspected acute coronary syndrome: systematic review and critical appraisal, Heart, 2010;96:1001-1010
Wikimedia Foundation. 2010.