- Chlorure de cobalt
-
Cobalt
 Pour les articles homonymes, voir Cobalt (homonymie).
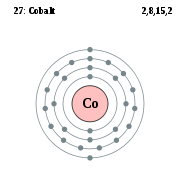
Pour les articles homonymes, voir Cobalt (homonymie).Le Cobalt est un élément chimique, de symbole Co et de numéro atomique 27 et de masse atomique 59.
Sommaire
Histoire
On connait le cobalt depuis l'antiquité grâce à ses composés qui colorent le verre d'un bleu intense. Jusqu'au XVIIIe siècle, le terme de « cobalt » (du mot kobold) désigne le minerai contenant cet élément. En 1735, le chimiste suédois Georg Brandt (1694-1768) extrait de ce minerai un « semi-métal » nouveau qu'il nomme « cobalt »[1]. En 1745, il démontre que le cobalt est la cause de la couleur bleue que le minerai de cobalt communique aux verres[2], alors que l'on attribuait précédemment celle-ci soit au bismuth, soit au fer et à l'arsenic[3].
Pendant le XIXe siècle, le bleu cobalt fut produit par la fabrique norvégienne Blaafarveværket (70-80 % de la production mondiale) dirigée par l'industriel prussien Benjamin Wegner. En 1938, John Livingood et Glenn Seaborg découvrirent le cobalt 60.
Utilisations
- Dans les alliages, tels que:
- Les super-alliages, pour certaines pièces dans les turbines à gaz.
- Les alliages résistants à la corrosion
- Les carbures
- Les aciers rapides (pour la réalisation des outils de coupe).
- Alliage prothèse dentaire (couronne par exemple)
- Les aimants et médias d'enregistrement magnétique
- Comme catalyseur dans l'industrie chimique et pétrolière
- Comme agent séchant dans les peintures et les encres
- Pour certaines électrodes de batterie d'accumulateurs (électrodes positives de nickel pour accumulateurs alcalins NiCd, NiMH et NiZn, et électrodes d'accumulateurs au lithium).
Les qualités du cobalt en font l'une des huit matières premières stratégiques considérées comme indispensables en temps de guerre comme en temps de paix[4].
Cobalt 60 (isotope radioactif)
Article principal : cobalt 60.Le cobalt 60 a de nombreuses utilisations comme source de rayons bêta, en raison de sa demi-vie relativement courte (5,27 ans), donc plus facile à éliminer en comparaison d'autres isotopes émetteurs de telles particules :
- pour la radiothérapie ;
- dans le traitement par radiation de la nourriture pour sa stérilisation ;
- dans la radiographie industrielle pour repérer les défauts des pièces.
Toutefois, le cobalt 60 de synthèse (produit par exposition de cobalt « naturel », l'isotope 59, aux rayonnements neutroniques d'un réacteur nucléaire) n'est pas totalement pur, et contient toujours d'autres isotopes radioactifs à désintégration ε (epsilon), émetteurs de rayonnement gamma dangereux[5] car ce rayonnement hautement énergétique détruit les noyaux et les contamine en éléments radioactifs persistants.
De plus l'enrichissement et la purification du cobalt 60 nécessitent des techniques de centrifugation similaires à celles utilisées pour l'enrichissement des isotopes à usage militaire, techniques hautement surveillées car stratégiques au plan international.Aussi, on préfère maintenant utiliser des accélérateurs d'électrons, semblables aux tubes cathodiques de nos moniteurs et téléviseurs mais à des niveaux d'accélération bien supérieurs, qui produisent des flux bien plus purs et bien mieux contrôlés de particules bêta. Mais cela nécessite un équipement bien plus lourd pour son utilisation qu'une simple capsule de cobalt 60, et cette méthode est surtout utilisée en milieu industriel, et maintenant aussi en milieu médical.
Toxicité, écotoxicité
A dose infime, c'est un oligoélément (présent dans la vitamine B 12, et utilisé contre l'anémie, car favorisant les globules rouges). Sa toxicité est cependant supposée depuis longtemps ; le mot cobalt provenant d'ailleurs de l'allemand kobalt ou kobold ; un esprit maléfique qui hantait les mines dans la tradition germanique. Le métal aurait été ainsi nommé par les mineurs qui en éprouvaient la toxicité (de plus, il dévalorisait ou dégradait les autres éléments minés comme le nickel).
Sa toxicité peut être double, due à ses propriétés chimiques et/ou radiotoxiques de ses isotopes radioactifs dont le cobalt 60, utilisés pour la recherche et en médecine nucléaire, par exemple sous forme d'aiguilles pour tuer des cellules cancéreuses.
Il peut agir en synergie avec d'autres métaux qui l'accompagnent souvent dans la nature (arsenic, et moindrement cuivre, nickel, manganèse).Dans les écosystèmes : Le cobalt a été peu tracé dans les environnements aquatiques. Selon Ifremer, on en trouve de 1 à 5 ng.L−1 en mer et les fleuves pollués en amènent des quantités significatives (de 200 ng.L−1 ont été mesurées à faible salinité dans la Seine et son estuaire). La chair des bivalves en contient ; par exemple de 3 à 3,5 mg.kg−1 (poids sec) en hiver et de 0,8 à 1,2 mg.kg−1 en été chez des moules du Devon en 1977 et 1978. Des huitres du lagon de Navachiste au Mexique en contenaient de 0,3 à 1,9 mg.kg−1 (p.s.) en 1991[6].
Sa toxicité varie selon les organismes, les individus, le contexte et l'espèce chimique considérée (cobalt pur, en nanoparticule, cobalt II ou cobalt III, ou encore sels organiques et/ou inorganiques). Sa toxicité et sa mobilité pour les plantes et animaux augmentent avec l'acidité du sol. Les pluies acides peuvent en accentuer la mobilité et la biodisponibilité, avec risque de bioaccumulation et bioturbation par certaines plantes, champignons et animaux.Chez l'Homme : L'exposition au cobalt peut induire des affections pulmonaires (difficultés respiratoires évoluant éventuellement en asthme, ou pneumonie chez des travailleurs ayant respiré un air chargé en cobalt). Dans les années 60, certaines brasseries ajoutaient du cobalt dans leurs bières pour en stabiliser la mousse, ce qui a provoqué chez de grands buveurs de bière des nausées, vomissements et graves affections cardiaques. On n'a toutefois pas noté d'affections cardiaques chez les anémiques et femmes enceintes ayant été médicamentés au cobalt, mais des anomalies fœtales sont provoquées chez des animaux exposés en laboratoire à des taux élevés de cobalt lors de la grossesse.
Il est classé comme "cancérogène possible" par le Centre international de recherche sur le cancer ; car il provoque un cancer lorsqu'il est introduit dans un muscle ou sous la peau, mais il ne semble pas être cancérogène lorsqu'inhalé par animaux exposés via l'air, la nourriture ou l'eau. Ce risque pourrait augmenter s'il s'agit de nanoparticules, mais il ne semble pas avoir fait l'objet de recherches.
Production
Ses principaux minerais se trouvent sous forme d'arséniures, de sulfures et d'oxydes. Actuellement, c'est l'Afrique qui détient l'essentiel des ressources en cobalt au niveau planétaire : la République démocratique du Congo concentre à elle seule la moitié des réserves connues. La Zambie en est le premier producteur au monde de cobalt, mais le minerai peut être fondu et raffiné dans diverses zones du monde. Toutefois, le Cameroun serait en possession dans son sous-sol de ce qui semble être le plus grand gisement de cobalt au monde, dans la zone forestière de l'est du pays. Ce gisement de grande importance devrait être mis en exploitation dans quelques années par le groupe Américain Géovic[7]. Le groupe UMICORE est leader mondial dans ce domaine.
Pays Tonnes % du total Finlande 7 990 18,5% Canada 6 620 15,4% Russie 4 654 10,8% République populaire de Chine 4 576 10,6% Zambie 4 570 10,6% Total 5 pays 28 410 66% Total monde 43 028 100,0 Chiffres de 2003, métal contenu dans les minerais et concentrés, source : L'état du monde 2005
Sources environnementales
Sources naturelles : (sols, érosion, volcans, eau de mer et feux de forêt. Le taux moyen dans le sol, dans le monde est de huit ppm (parties par million), mais il varie de près de zéro à 6 450 ppm voire plus à proximité de mines (En Ontario, 16 et 17 ppm de cobalt ont été mesurés respectivement dans des parcs ruraux et de vieux parcs urbains[8])
Sources anthropiques : (eau, air et sol, et écosystèmes sont pollués par les mines et l'industrie du cobalt, les fumées des incinérateurs et issues de la combustion du charbon et du pétrole qui en contiennent une faible proportion, de même que les gaz d'échappement des véhicules et avions.
Hormis pour les travailleurs ou personnes exposées à des sources industrielles ou naturelles importantes, 99 p. 100 du cobalt que nous absorbons proviendrait de la nourriture, plutôt que de l'eau ou l'air[8]).
Voir aussi
Liens externes
- Page sur toxicologie du cobalt(relativement à son usage dans les céramiques notamment).
Notes et références
- ↑ G. Brandt, Dissertatio de Semi-Metallis, Acta literaria et scientiarum Sueciae, vol. IV, 1735, pp. 1-12. Uppsla, 1742.
- ↑ G. Brandt, Cobalti nova species examinata et descripta, Acta Societatis regiae scientiarum upsaliensis, 1742, pp. 33-41. Stockholm, 1748.
- ↑ F. Delamare, Saffre, smalt, bleu d'esmail et azur, in Bleus en poudres, de l'Art à l'Industrie, Mines Paris, ParisTech, Les Presses, 2008, pp. 71-122.
- ↑ Avec le germanium (électronique avancée) ; le titane (sous-marins de chasse, alliage extrêmement résistant ; magnésium (explosifs) ; platine (contacts aussi conducteurs que l'or pour l'aviation, circuits avec contacts rapides) ; mercure (chimie nucléaire, instruments de mesure) ; molybdène (acier) ; colombium (alliages spéciaux extrêmement rares). (Christine Ockrent, comte de Marenches, Dans le secret des princes, éd. Stock, 1986, p; 193.)
- ↑ En toute rigueur ce n'est pas l'isotope qui subit la désintégration ε qui émet le rayonnement gamma, mais la fraction de l'isotope produit dans un état excité. Mais comme la désexcitation (du nouvel isotope) suit la transformation radioactive, elle y est liée.
- ↑ Ifremer, Surveillance du milieu marin, travaux du Réseau National d'Observation de la Qualité du Milieu Marin ; Le RNO : programmes actuels - L'argent, le cobalt, le nickel et le vanadium dans les mollusques du littoral français - Les carottes sédimentaires, mémoire de la contamination ; Bulletin Ifremer, 2002 Télécharger en Pdf
- ↑ Geovic Mining Corp
- ↑ a et b Page du Gvt. canadien sur le cobalt
s1 s2 g f1 f2 f3 f4 f5 f6 f7 f8 f9 f10 f11 f12 f13 f14 d1 d2 d3 d4 d5 d6 d7 d8 d9 d10 p1 p2 p3 p4 p5 p6 1 H He 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Uut Uuq Uup Uuh Uus Uuo 8 Uue Ubn * Ute Uqn Uqu Uqb Uqt Uqq Uqp Uqh Uqs Uqo Uqe Upn Upu Upb Upt Upq Upp Uph Ups Upo Upe Uhn Uhu Uhb Uht Uhq Uhp Uhh Uhs Uho ↓ g1 g2 g3 g4 g5 g6 g7 g8 g9 g10 g11 g12 g13 g14 g15 g16 g17 g18 * Ubu Ubb Ubt Ubq Ubp Ubh Ubs Ubo Ube Utn Utu Utb Utt Utq Utp Uth Uts Uto Métalloïdes Non-métaux Halogènes Gaz rares Métaux alcalins Métaux alcalino-terreux Métaux de transition Métaux pauvres Lanthanides Actinides Superactinides Éléments non classés - Portail de la chimie
Catégories : Élément chimique | Métal de transition | Minéral alimentaire - Dans les alliages, tels que:
Wikimedia Foundation. 2010.