- Fluoxétine
-

« Prozac » redirige ici. Pour la série télévisée québécoise, voir Prozac : La maladie du bonheur. Fluoxétine 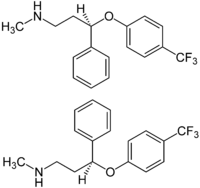
Structure de l'énantiomère R de la fluoxétine (en haut) et de la S-fluoxétine (au milieu) Général Nom IUPAC (RS)-N-méthyl-3-phényl-3-[4-(trifluorométhyl)phénoxy]-propan-1-amine No CAS (racémique)
[S(–)]
[R(+)]Code ATC N06 PubChem SMILES InChI Propriétés chimiques Formule brute C17H18F3NO [Isomères] Masse molaire[1] 309,3261 ± 0,0154 g·mol-1
C 66,01 %, H 5,87 %, F 18,43 %, N 4,53 %, O 5,17 %,pKa 10,5 Propriétés physiques Solubilité 14 g·l-1 Classe thérapeutique Antidépresseur ISRS Données pharmacocinétiques Biodisponibilité 72 % (orale) Métabolisme Hépatique (< 30 %) Demi-vie d’élim. 1 - 3 j (prise unique)
4 - 6 j (au long cours)Excrétion Urinaire (80 %)
Fécale (15 %)Considérations thérapeutiques Voie d’administration Orale Unités du SI & CNTP, sauf indication contraire. Le chlorhydrate de fluoxétine est un médicament antidépresseur utilisé dans le traitement de la dépression, des troubles obsessionnels compulsifs, de la boulimie nerveuse, des troubles dysphoriques prémenstruels, et de nombreux autres états. C'est un inhibiteur sélectif de la recapture de la sérotonine (ISRS).
La fluoxétine fut découverte et brevetée par Eli Lilly qui la commercialisa sous le nom Prozac®. Depuis l'automne 2001, le chlorhydrate de fluoxétine n'est plus protégé par son brevet et est produit par de nombreux autres laboratoires. Il a été prescrit à plus de 34 millions de personnes dans le monde de 2001 à 2009[2].
Sommaire
Description
Le Prozac est aussi nommé "pilule du bonheur"
 Gélules de fluoxétine
Gélules de fluoxétine
La fluoxétine est un dérivé du diphenhydramine, un antihistaminique avéré pour empêcher la recapture de la sérotonine.
La fluoxétine interagit avec certaines substances dont les inhibiteur des monoamine oxydases (IMAO).
Elle est principalement indiquée dans les dépressions marquées par un manque d'énergie du fait de son effet stimulant, mais elle peut être utile dans d'autres indications comme l'anxiété ou la panique.
Son élimination est très lente, sa demi-vie est de quatre jours. Le foie métabolise la fluoxétine en norfluoxétine, qui est également un inhibiteur sélectif de la recapture de la sérotonine et dont la demi-vie est encore plus longue, de 8,6 à 9,3 jours. Certains professionnels considérent que la durée de sa demi-vie est liée à son efficacité thérapeutique mais aucune étude fiable n'a été faite sur ce point. Mais il est certain que la durée de sa demi-vie est responsable des symptômes de sevrage qui surviennent en cas d'arrêt brutal.
La prise d'alcool sous fluoxétine est formellement déconseillée par les prescripteurs et ceci est bien entendu précisé sur la notice. L'effet synergique des 2 substances peut induire des troubles du comportement graves notamment un risque de passage à l'acte suicidaire.
Législation
La fluoxétine est en annexe 3 des drogues au Canada, où elle n'est donc délivrée que sur prescription. Cette molécule est aussi délivrée sous prescription en France, en Suisse, et en Espagne.
Efficacité
L'efficacité du traitement est variable selon les sujets et la justesse du diagnostic psychiatrique établi au préalable. Les résultats obtenus auprès des différentes études réalisées récemment au plan international sont variables et nécessitent des recherches ultérieures[3]. De plus, il existe un effet dose-dépendant.
Controverse
Vers la fin des années 1990, une polémique s'est développée, la firme Eli Lilly avait notamment fait d'énormes bénéfices avec le succès du Prozac®.
Il lui est notamment reproché d'augmenter les risques de passage à l'acte suicidaire (risque présent chez tous les anti-dépresseurs puisqu'ils restaurent rapidement une certaine forme d'énergie avant de soigner la tristesse pathologique) surtout quand il est utilisé sur des enfants ou des adolescents[4].
En décembre 2004, le British Medical Journal publia des documents officiels d'Eli Lilly datant des années 1980 et suggérant un lien entre la fluoxétine, le suicide et la psychose. Le magazine affirmait également que la firme avait dissimulé ces informations, point sur lequel il a dû se rétracter[5].
Biodégradabilité
Aucune étude sur la dégradabilité de la fluoxétine n'a été faite mais il est possible de penser qu’elle se biodégrade comme les autres pharmaceutiques. Une fois dans les eaux de surface, la biotransformation des pharmaceutiques par la biodégradation a lieu, mais les réactions de transformations abiotiques sont probablement plus importantes. La photodégradation est un des processus les plus important à prendre en compte[6].
Devenir environnemental
La fluoxétine qui est consommée par les êtres humains est métabolisée en norfluoxétine par les isoenzymes cytochrome P450. La voie principale d’excrétion de la fluoxétine et de la norfluoxétine étant l’urine et jusqu’à 11 % du médicament est excrété en tant que fluoxétine non métabolisée[7].
Dans les eaux de surface
Quelques études ont été faites pour déterminer la concentration de fluoxétine dans les eaux de surface de plusieurs pays. La concentration de fluoxétine est de 21,4 ± 31,2 ng/L dans la rivière Henares-Jarama-Tajo en Espagne[8]. Une concentration de 12 ng/L de fluoxétine a été mesurée dans l’eau de surface aux États-Unis[9]. À titre comparatif, en Norvège, une concentration de 0 à 3 ng/L a été mesurée dans les effluents des hôpitaux. Cela peut confirmer que les hôpitaux ne sont pas les sources majeures de fluoxétine dans les eaux de surface[10]. Finalement une concentration de 99 ng/L a été mesurée dans les effluents des usines de traitements des eaux au Canada[11].
Méthodes d'analyse
Il faut d’abord faire l’échantillonnage d’une façon adéquate puisqu’il ne faut pas détériorer l’échantillon. Ensuite une pré-concentration est faite par une extraction en phase solide (SPE). Les concentrations retrouvées dans l’eau de surface sont en quantité trace alors il est nécessaire de concentrer l’échantillon pour pouvoir détecter la fluoxétine avec un instrument analytique. Finalement l’analyse s’effectue par chromatographie liquide couplé par spectrométrie de masse en tandem (LC-MS/MS).
L’extraction de la fluoxétine est effectuée avec de l’eau de qualité HPLC et de l’eau environnementale. Des bouteilles ambrées préalablement rincées avec de l’eau ultra-pure sont utilisées pour la collection des échantillons. L’eau environnementale est filtrée au travers d’une membrane de nylon 0,45 μm. L’entreposage des échantillons se fait à -20 °C, ainsi l’activité biologique est réduite de façon considérable. Il y a 2 types de sorbants utilisés pour cette analyse : HLB et MIP. Le sorbant HLB est un copolymère macroporeux fait avec un ratio balancé de deux monomères, le divinylbenzène lipophylique et la N-vinylpyrrolidone hydrophobique. Le MIP est un polymère avec une empreinte moléculaire (Molecular Imprinted Polymer). Dans le cas présent, l’empreinte est faite pour l’analyse des drogues pharmaceutiques. Ce sont en fait des cartouches SPE fait avec de l’acide méthylacrylique provenant de MIPTechnologies (SupelMIP™).
Sorbant HLB
Pour le sorbant HLB, la méthode est la suivante; il faut prendre 100 ml d’échantillon aqueux qu’on va doper avec 0,5 μg·l-1 de fluoxétine pur. L’échantillon est passé au travers de la cartouche SPE au pH naturel du cours d’eau (qui est d’environ 8,3 pour une rivière) à un taux de 5 mL/minute. La cartouche est préalablement conditionnée avec 5 ml de méthanol et d’eau de qualité HPLC. Après avoir passé l’échantillon au travers de la cartouche, elle est rincée avec 5 ml d’eau de qualité HPLC. La cartouche est ensuite séchée sous vide pendant 15 minutes. L’élution se fait par la suite avec 2 × 4 ml de méthanol et les extraits sont évaporés avec un léger jet d’azote. 0,5 ml d’un mélange d’acétonitrile/eau (10: 90 v/v) avec 100 ng/mL d’étalon interne est ajouté à l’extrait évaporé. L’étalon interne est le fluoxétine-d5[2].
Sorbant MIP
Pour ce qui est du sorbant MIP; 25-200 ml de l’échantillon aqueux à son pH naturel est passé au travers de la cartouche MIP à un taux d’environ 1 mL/minute. Les cartouches sont pré-conditionnées avec 1 mL de méthanol suivi de 1 mL d’eau de qualité HPLC. Une fois l’échantillon passé au travers de la cartouche, elle est rincée avec 2 × 1 mL d’eau de qualité HPLC et séchée sous vide pendant 10 minutes. Pour la prochaine étape de lavage, 1mL d’acétonitrile est passé dans la cartouche et elle est séchée sous vide pour 10 minutes. Le solvant d’élution est 4 × 1 mL de méthanol (10 % d’acide acétique). Finalement les extrait sont évaporés et reconstitués comme dans la méthode HLB[2].
Chromatographie liquide à ultra performance (UPLC)
Une fois les échantillons préparés, ils sont analysés par UPLC-MS/MS avec une colonne C18. Les gradients utilisés pour l’analyse avec l’acétonitrile (A) et une solution d’acide formique 0,1 % sont :
- 10 % de A pendant 0,5 minute ;
- 30 % de A à 2,5 minutes ;
- 80 % de A à 5 minutes ;
- 100 % de A à 5,5 minutes ;
- 10 % de A à 6,5 minutes.
C’est donc une analyse rapide puisque c’est un instrument UPLC qui est utilisé. Le débit est de 400 µL/minute et la colonne est maintenue à 30 °C. Avec le sorbant MIP et HLB, il est possible d’obtenir une limite de détection de la méthode (MDL) de 0,5 ng/L[2].
Spectrométrie de masse
Pour ce qui est du spectromètre de masse en tandem, les composés sont ionisés par électronébuliseur en mode positive. Le voltage du capillaire est de 3,00 KV et les températures de la source et de la désolvatation sont de 120 et 350 °C respectivement. Les limites de détections instrumentales sont de moins de 1 pg. Des pourcentages de recouvrements de 75 ± 1 % pour MIP et 92 ± 12 % pour HLB sont obtenus. Un recouvrement plus précis est donc obtenu avec le sorbant MIP[2].
Écotoxicologie
Le fait qu’il y ait de la fluoxétine dans l’environnement est préoccupant puisque les conséquences d’une exposition prolongée à des quantités traces sont inconnues. Malgré le fait que les médicaments actifs ont des durées de demi-vie courtes à cause de processus biotiques ou non-biotiques, leur infusion continue dans l’environnement cause des expositions multi-générationnelles aux organismes marins[12]. Il se pourrait qu’il y ait des changements biologiques continus pour ces organismes et que nous ne soyons pas en mesure de les apercevoir. Par conséquent, il pourrait survenir des impacts irréversibles qui pourrait être attribués à un changement naturel ou à une adaptation[13].
Les valeurs de EC50 après 24 heures d’incubation pour Tetrahymena thermophila (protozoaire) sont de 30,5 (±0,7) mg L-1 et de 3,2 (±0,1) mg L-1 pour (–)-(R)-fluoxétine et (+)-(S)-fluoxétine respectivement alors l’isomère (+)-(S)-fluoxétine est beaucoup plus toxique pour cette espèce[14]. Pour Daphnia Magna (crustacé zooplanctonique), les deux énantiomères sont pratiquement aussi toxiques. Pour le taux de pâturage de ce crustacé zooplanctonique, la concentration minimale où il y a eu un effet observable est de 195 μg·l-1 pour l’isomère (S) pour une durée de 21 jours. La concentration où il y a eu un effet observable sur la croissance de Pimephales promelas (poisson) est de 53 μg·l-1 pour un mélange racémique de fluoxétine pour une période de 7 jours[15]. De plus, ce médicament a des propriétés anti-microbiotiques et pourrait inhiber des pompes cellulaires[16]. Les conséquences potentielles de ce pharmaceutique sur la santé des humains sont inconnues. Il est important de noter que malgré une certaine utilité des bioessais, ils ne sont pas représentatifs de ce qui se passe réellement dans les eaux de surface. Ils sont très souvent limités à quelques jours ou quelques semaines alors qu’en vérité, les organismes passent une vie complète avec ces contaminants.
 (chlorhydrate de) fluoxétine
(chlorhydrate de) fluoxétineNoms commerciaux :
- Fluoxetine Actavis® (France),
- Docfluoxetine® (Belgique),
- Fluctine® (Suisse),
- Fluesco® (Suisse),
- Fluocim® (Suisse),
- Fluox® (Belgique),
- fluox-basan® (Suisse),
- Fluoxemed® (Belgique),
- Fluoxetine Arrow® (France),
- Fluoxetine BIOGARAN® (France),
- Fluoxetine BOUCHARA RECORDATI® (France),
- Fluoxetine EG® (Belgique, France),
- Fluoxetine G GAM® (France),
- Fluoxetine GNR® (France),
- Fluoxétine Helvepharm® (Suisse),
- Fluoxetine IREX® (France),
- Fluoxetine IVAX® (France),
- Fluoxétine-Mepha® (Suisse),
- Fluoxetine MERCK® (France),
- Fluoxetine QUALIMED® (France),
- Fluoxetine RATIOPHARM® (France),
- Fluoxetine RPG® (France),
- Fluoxétine Sandoz® (Belgique, Suisse),
- Fluoxetine Teva® (Belgique, France),
- Fluoxetine ZYDUS® (France),
- Fluoxetop® (Belgique),
- Fluoxifar® (Suisse),
- Fluoxone® (Belgique),
- Flusol® (Suisse),
- Fontex® (Belgique),
- Merck-fluoxetine® (Belgique),
- Prosimed® (Belgique),
- Prozac® (Belgique, France),
Classe :
antidépresseurAutres informations :
Sous classe : 3ème groupe (ISRS)Voir aussi
Articles connexes
Liens externes
- (en) les survivants du prozac
- (en) le site du professeur david HealyCe site explore les menaces à la sécurité publique et de la liberté académique entourant les ISRS groupe de médicaments - Prozac, Zoloft (Lustral), Paxil (deroxat / Aropax).
- (en) Prozac Truth, The Untold Story
- (en) Lilly's Prozac® advertising website
- Fiche BIAM : http://www.biam2.org/www/Sub909.html
Sources
Notes et références
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- Demeestere, K., Petrović, M., Gros, M., Dewulf, J., Trace analysis of antidepressants in environmental waters by molecularly imprinted polymer-based solid-phase extraction followed by ultra-performance liquid chromatography coupled to triple quadrupole mass spectrometry, Anal Bioanal Chem, 2010, 396, 825-837
- Glartlehner G. et al., Comparative benefits and harms of second-generation antidepressants: background paper for the American College of Physicians.Ann Intern Med 2008, 18; 149(10): 734-50.
- [PDF]Le bon usage des antidépresseurs chez l’enfant et l’adolescent Guide de l'agence française de sécurité sanitaire des produits de santé
- Le Prozac n'a pas déprimé les salariés de Lilly France , Stratégies, 10/02/2005
- Fent, K.; Weston, A.A., Daniel Caminada, Ecotoxicology of human pharmaceuticals, Aquatic Toxicology, 2006, 76, 122–159
- Morando, M. B.; Medeiros, L. R.; McDonald, M.D., Fluoxetine treatment affects nitrogen waste excretion and osmoregulation in a marine teleost fish, Aquatic Toxicology, 2009, 93, 253
- Fernández, C.; González-Doncel, M.; Carbonell, J. P. G., Occurrence of pharmaceutically active compounds in surface waters of the henares-jarama-tajo river system (Madrid, Spain) and a potential risk characterization, Science of the Total Environment, 2010, 408, 543–551
- Kolpin, D.W.; Furlong, E.T.; Meyer, M.T.; Thurman, E.M.; Zaugg, S.D.; Barber, L.B.; Buxton, H.T., Pharmaceuticals, hormones, and other organic wastewater contaminants in US streams, 1999–2000: a national reconnaissance, Environ. Sci. Technol., 2002, 36, 1202–1211
- Langford, K. H.; Thomas, K. V., Determination of pharmaceutical compounds in hospital effluents and their contribution to wastewater treatment works, Environment International, 2009, 35, 769
- Metcalfe, C.D.; Miao, X.S.; Koenig, B.G.; Struger, J., Distribution of acidic and neutral drugs in surface waters near sewage treatment plants in the lower Great Lakes, Canada, Environ. Toxicol. Chem., 2003, 22, 2881–2889
- Andre, F. D.: Castan, G.; Ri’Os. N. Use of Toxicity Assays for Enantiomeric Discrimination of Pharmaceutical Substances, Chirality, 2009, 21, 751-758
- Daughton, C.G.; Ternes, T.A. Pharmaceuticals and personal care products in the environment: agents of subtle change? Environ Health Perspect, 1999,107, 907–938
- Andre, F. D.: Castan, G.; Ri’Os. N. Use of Toxicity Assays for Enantiomeric Discrimination of Pharmaceutical Substances, Chirality, 2009, 21, 751-758
- Stanley, J. K.; Ramirez, A. J.; Chambliss, K.; Brooks, B. W., Enantiospecific sublethal effects of the antidepressant fluoxetine to a model aquatic vertebrate and invertebrate, Chemosphere, 2007, 69 page 9–16
- Bellido, M.;, Criado, M., Rodrıguez, G., Antimicrobial activity of psychotropic drugs: selective serotonin reuptake inhibitors, Int J Antimicrob Agents, 2000, 14, 177–180
Catégories :- Inhibiteur sélectif de la recapture de la sérotonine
- Composé trifluorométhylé
- Amine
- Éther de phénol
Wikimedia Foundation. 2010.
