- C6H16NO5PS
-
Glyphosate
Glyphosate 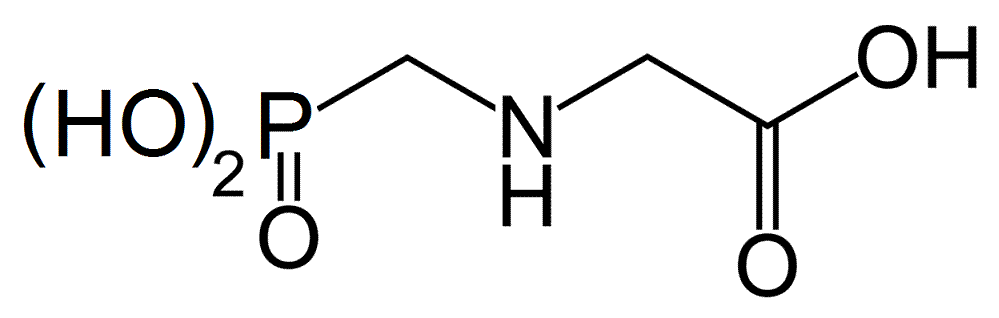
Structure chimique du GlyphosateGénéral No CAS No EINECS SMILES InChI Apparence solide blanc, inodore.[1] Propriétés chimiques Formule brute C3H8NO5P [Isomères] Masse molaire 169,0731 g∙mol-1
C 21,31 %, H 4,77 %, N 8,28 %, O 47,32 %, P 18,32 %,pKa 0.8 Propriétés physiques T° fusion (décomposition) : 230 °C[1] T° ébullition 230 °C (503,15 K) décomposition Solubilité dans l'eau à 25 °C : 1.2 g/100 ml[1]
Insoluble dans la plupart des solvants organiquesMasse volumique (eau = 1) : 1.7[1] Pression de vapeur saturante à 20 °C : négligeable[1] Précautions Directive 67/548/EEC 
Xi
NPhrases R : 41, 51/53, Phrases S : (2), 26, 39, 61, Transport 90 3077 SGH[2] 

DangerÉcotoxicologie DL50 1568 mg/kg souris oral
130 mg/kg souris i.p.
7940 mg/kg lapin peauSel d'isopropylamine de glyphosate Général Synonymes Sel d'isopropylamine de N(-phosphonométhyl)glycine No CAS SMILES InChI Apparence Solide Propriétés chimiques Formule brute C6H17N2O5P [Isomères] Masse molaire 228,1833 g∙mol-1
C 31,58 %, H 7,51 %, N 12,28 %, O 35,06 %, P 13,57 %,Propriétés physiques Solubilité très soluble dans l'eau Masse volumique 1,218 g/mL à 25 °C Précautions Directive 67/548/EEC 
XiPhrases R : 36, Phrases S : 26, Écotoxicologie DL50 10537 mg/kg rat oral
7500 mg/kg rat peauGlyphosate-trimesium Général Synonymes Triméthylsulfonium de l'ion n-(phosphonométhyl) glycine No CAS SMILES InChI Propriétés chimiques Formule brute C6H16NO5PS [Isomères]
245,235087 g∙mol-1
C12H32NO5PS3 [Isomères]
397,558731 g∙mol-1Propriétés physiques T° ébullition 110 °C à 760 mmHg Solubilité 1050 g/l dans l'eau à 20 °C;
ou 430 g/100ml eau à 25 °CMasse volumique 1,27 Précautions Directive 67/548/EEC 
Xn
NPhrases R : 22, 51/53, Phrases S : (2), 36/37, 46, 61, Unités du SI & CNTP, sauf indication contraire. Le glyphosate (N-(phosphonométhyl)glycine, C3H8NO5P) est un désherbant total, c’est-à-dire un herbicide non-sélectif, autrefois produit sous brevet, exclusivement par la société Monsanto à partir de 1974, sous la marque Roundup. Le brevet étant tombé dans le domaine public en 2000, d'autres sociétés produisent désormais du glyphosate.
Le glyphosate seul est peu efficace, car il n'adhère pas aux feuilles et les pénètre difficilement. On lui adjoint donc un tensioactif (ou surfactant) qui est soupçonné d'être une cause de toxicité des désherbants contenant du glyphosate.
Quelques espèces de plantes ont commencé à développer des résistances au glyphosate, dont par exemple l'evil pigweed (Palmer amaranth de la famille des amarantes) qui pousse à une vitesse telle qu'elle force les agriculteurs du Sud des États-Unis à abandonner leur champs[3]. L'apparition de cette espèce de plante résistante est considérée comme une véritable menace pour l'agriculture par l'Université de Georgie[4].
Sommaire
Propriétés chimiques
Le glyphosate est un acide organique faible, analogue d'un acide aminé naturel, la glycine, doté d'un groupement phosphonate.
Son nom est la contraction de glycine, phospho- et -ate.
De cette structure, il présente 4 pKa (0,7 ; 2,2 ; 5,9 ; 10,6). Zwitterionique quel que soit le pH, il est aussi très soluble dans l'eau et très polaire (logP < -3,2). Dans les sols, il est assez rapidement adsorbé, et cette adsorption (plus ou moins importante selon le pH) le rend normalement assez peu mobile.
Son principal produit de dégradation est l'AMPA ou acide aminométhylphosphonique, résultant de la perte du groupe acétate.Pour accroître sa solubilité et son passage dans la plante et la sève, les industriels le préparent souvent sous forme de sel d’isopropylamine (C6H17N2O5P, Roundup)[5]. Des additifs (tensio-actifs, tels que la polyoxyéthylène amine) lui sont ajoutés pour le fixer sur les plantes [6].
Dégradation
Des bactéries du genrepseudomonas, sont capable de dégrader le glyphosate en glycine[7].
Mécanisme d'action
Le mécanisme d'action de cet herbicide n'est pas entièrement compris à l'heure actuelle. On sait cependant que son action phytotoxique est due à l'inhibition de l'enzyme 5-enolpyruvoyl-shikimate-3-phosphate synthase (EPSPS) impliquée dans la voie métabolique de l'acide shikimique, laquelle est nécessaire pour la synthèse des acides aminés aromatiques tels que la phénylalanine, la tyrosine et le tryptophane ; ces acides aminés participent à la synthèse des vitamines et de beaucoup de métabolites secondaires comme les molécules hormonales d'intérêt sur le développement de la plante telles que les folates, l'ubiquinone et des naphthoquinones[8]. Cette voie étant absente chez les animaux, il fut supposé de faible toxicité chez eux. Cependant, de nombreuses études tendent à démontrer le contraire[9].
Présence dans l'Environnement
Dans les sols
Les taux de glyphosate y sont difficiles à mesurer en raison du fait qu'il est absorbé sur les particules du sol et difficile à extraire sans le dénaturer. Il y est probablement souvent présent, car c'est le premier désherbant et le premier pesticide vendu au monde, avec une quantité qui a plus que doublé en 4 ans, passant de 0,5 et 1 million de kilogrammes en 1986 à plus de 2 millions de kilogrammes en 1990.
Il est très utilisé en forêt (pour préparer et dégager les plants), pour le désherbage en vue de l’ensemencement de nombreuses cultures et comme défoliant pour certaines autres cultures (blé, orge, légumes, colza ou moutarde sauvage, lin, cultures fourragères, et ou dans les jardins par les particuliers et parfois pour la culture sans labour (qui peut l'éviter en semant sous paille par exemple). Les pays qui ont autorisé la culture d'OGM ont vu sa consommation augmenter car de nombreux OGM sont résistants au glyphosate.
Dans l'eau
Le glyphosate y est soluble (12 g/L à 25 °C dans l'eau douce). Il était réputé peu mobile et à faible risque de contamination des nappes, mais depuis qu'on le cherche, on en trouve dans de nombreuses eaux. Il est plus mobile et soluble dans les sols alcalins ou riches en phosphates (engrais très utilisés par certains agriculteurs)[10]. Une étude a détecté des taux de 200 à 300 µg/L de glyphosate peu après une pulvérisation directe dans de l’eau stagnante. Ce taux n'a été réduit que de moitié après trois semaines environ. Or le Roundup a pu être légalement ou non utilisé pour désherber des mares et étangs de pêche. La nature des microbes présents, la présence ou absence d'un biofilm important, la quantité d'ultraviolets, la température (saison) et le pH jouent probablement également un rôle dans la vitesse de dégradation du glyphosate dans l'eau[11]. D'autres sources citent une pulvérisation directe sur lacs et étangs de 1 kg/ha suivie d'une concentration initiale de 1 100 µg/L réduite à 149 µg/L après deux jours et à 55 µg/L après cinq jours.
En sylviculture (au Québec) après pulvérisation, on n'en a pas trouvé (seuil de détection de 1,0 µg/L) dans huit cours d’eau protégés par une zone tampon de 30 m, mais on en a trouvé[12] dans deux échantillons provenant de fossés (16,9 µg/L au max.). Dans les étangs ayant reçu une pulvérisation directe, le taux était de 2 800 µg/L dans l'eau juste après la pulvérisation, mais avait chuté à 288 µg/L 24 heures plus tard. La cinétique du glyphosate dans les sédiments semble peu étudiée.
Dans l'air
Sa faible tension de vapeur (<1×10-5 Pa à 25 °C)[13] le rend peu soluble dans l'air, mais il peut y être présent sous forme d'aérosol ou fixé sur des poussières issues de sol poudreux et sec traité. Il peut être pour partie dégradé par photodécomposition sous l'effet des ultraviolets de la lumière solaire.
Utilisations et polémiques
Le glyphosate est notamment utilisé par le gouvernement colombien, aidé par le gouvernement des États-Unis dans son Plan Colombie pour détruire les champs de coca produisant de la drogue qui finance des actions de groupes rebelles. Ces actions détruisent des milliers d'hectares de reliques de forêt tropicale, parfois classées réserves naturelles, comme la forêt du Putumayo, et des exploitations agricoles légales. Les populations de ces forêts craignent des impacts sur leur santé, comme dans le cas du Roundup pulvérisé en Palestine, ou, antérieurement, avec l'Agent Orange utilisé comme défoliant pendant la guerre du Viêt Nam. Les communautés amérindiennes sont parmi les premières touchées. L'Équateur voisin craint aussi des conséquences sanitaires et écologiques des fumigations colombiennes de glyphosate près de ses frontières, dans le Putumayo. Le refus colombien d'abandonner ces pulvérisations aériennes a provoqué en 2006-2007 une crise diplomatique entre les deux pays.[14]
La culture majoritaire de soja OGM résistant au glyphosate en Argentine a entraîné une utilisation massive de ce désherbant. Des résistances sont apparues, amenant à l'utilisation de doses de plus en plus importantes. La dévégétalisation des sols, associée au labour, est cause de perte d'humus, d'une dévitalisation et d'une dé-fertilisation des sols.
La polémique a aussi porté sur la biodégradabilité de désherbants contenant du glyphosate. Un fabricant (Monsanto) a perdu un procès parce qu'il avait présenté sur ses étiquettes et affiches le Roundup comme dégradable ou biodégradable (dans le sol comme dans l'eau). La demi-vie du glyphosate (le temps nécessaire pour que 50 % des molécules de glyphosate soient dégradées) est, en conditions de laboratoire, d'environ 32 jours dans le sol et de 3,3 jours dans l'eau, avec une efficacité variant selon la richesse du sol en bactéries, la température, la nature et l'acidité du sol, etc. Elle varierait de 20 à 100 jours selon l’état du sol d'après d'autres sources [15]. Le glyphosate se dégrade en sous-produits, eux-mêmes difficilement biodégradables, avec des délais variant selon le contexte.
Le problème est que ces chiffres semblent porter sur la matière active et non sur le surfactant, ni sur les impacts synergiques possibles des sous-produits de dégradation, notamment lorsqu'ils sont combinés avec les produits de dégradation du surfactant qui pourrait être une des causes de toxicité du produit.
Contamination des milieux (eau, air, sol)
Enfin, les analyses permettant de détecter le glyphosate dans l'eau ont longtemps été difficiles, longues et coûteuses. Elles étaient donc rares. Depuis que dans les années 2000, des progrès techniques ont amélioré leur précision et en ont diminué les coûts, on prend conscience que bien que dégradable, le glyphosate est très souvent présent dans les eaux et les sols. Une étude de l'IFEN (août 2006) a montré que le glyphosate et l'AMPA, son produit de dégradation, étaient les substances les plus retrouvées dans les eaux en France [16]. En effet, le glyphosate est maintenant l'herbicide le plus vendu en France.
On a commencé dans les années 2000 à étudier la volatilité et la cinétique du glyphosate dans l'air (où l'on retrouve d'autres pesticides qui peuvent aussi contaminer les pluies), mais les mesures (en 2006/2007) sont encore très imprécises car les résines adsorbantes chargées de piéger le glyphosate dans l'air des analyseurs le fixent mal, une partie du glyphosate étant désorbé du filtre au fur et à mesure que l'air y passe.
De plus, étant donné l’importance probable des synergies entre produits, entre produits et molécules de dégradation, et entre toutes ces molécules et celles de l'environnement ou de notre organisme, toute évaluation certaine du risque reste difficile étant donné la rareté des données et éléments toxicologiques disponibles. Les premières analyses doivent être considérées comme de premiers indices et éventuellement des éléments d'aide à la précaution/prévention.
Écotoxicologie
Quelques études[17] laissent penser que le glyphosate pourrait peut-être réagir avec les nitrites présents dans certains aliments, mais aussi dans les sols agricoles pour former le N-nitrosophosphonométhylglycine, un cancérogène possible.
Toxicologie
La DL50 du glyphosate pur se situe à environ 1 % du poids corporel[18]. Les effets toxiques immédiats sont faibles, même à hautes doses. On note cependant une réduction notable du poids corporel et du poids du foie. Plusieurs cas de suicide par ingestion de désherbant à base de glyphosate ont montré que la formulation commerciale (contenant un ou des additifs) est réellement toxique, et à des doses très inférieures aux doses de glyphosate qui seraient nécessaires pour provoquer la mort, probablement en raison de la toxicité et de l’effet synergique du surfactant, ce qui avait été démontré expérimentalement chez des poissons notamment.
Les études[19] de laboratoire, généralement faites ou financées par le fabricant, ont montré[20] que le glyphosate ingéré était absorbé pour 15 à 40 % de la dose ingérée. Quant à son premier sous-produit de dégradation (l’AMPA), il est absorbé à environ 20 % de la dose ingérée.
Une autre étude[21] a montré chez des singes que l’absorption cutanée d’une préparation de glyphosate était faible (2 % après sept jours d’application locale). Mais le passage transcutané peut varier selon les espèces, les conditions (transpiration) et l’âge (chez l'humain, la peau des enfants est par exemple beaucoup plus perméable). Une dose ingérée (ou injectée (intrapéritonéale)), unique ou répétée durant 12 jours, est éliminée en grande partie via l’urine, essentiellement sous une forme non dégradée, bien que l’on trouve aussi de petites quantités d’AMPA. L’excrétion biliaire et la circulation entéro-hépathique sont quantitativement minimes après 120 heures. Une dose unique de glyphosate était éliminée à 94 % dans les urines, chez les mâles et les femelles (0,1 % seulement d’une dose étant éliminée sous la forme de dioxyde de carbone marqué 22), en condition de laboratoire (animaux peu mobiles, non malades, non exposés aux aléas climatiques, etc.). L’ingestion quotidienne de glyphosate durant 2 semaines se traduit par des concentrations tissulaires maximales au sixième jour d’administration. Les concentrations les plus fortes étant mesurées dans les reins (<1 ppm), puis de manière décroissante dans la rate, les tissus adipeux, le foie, les ovaires, le cœur et les muscles, les résidus diminuant progressivement après que l’animal ait cessé d’ingérer le produit dans sa nourriture, les concentrations rénales étant de 0,1 ppm après 10 jours.
Il est délicat de tirer des conclusions toxicologiques des nombreuses études[22] faites chez l'animal avec du glyphosate pur car dans la réalité, c'est un mélange glyphosate-additif qui est susceptible de poser problème par contact ou ingestion.
Il est néanmoins avéré que le glyphosate demeure un toxique puissant[23] agissant notamment sur les cellules placentaires humaines[24] entraînant une multiplication des avortements spontanés tardifs[25].Il a été démontré que différents herbicides à base de glyphosate ralentissaient le cycle des divisions cellulaires chez l'embryon d'oursin, ce qui pourrait, selon les auteurs de cette étude, causer des cancers[26].
Une étude de l'université de Caen, publiée dans Chemical Research in Toxicology fin décembre 2008, met en évidence l'impact de diverses formulations et constituants de ce pesticide sur des lignées cellulaires humaines (cellules néonatales issues de sang de cordon, des cellules placentaires et de rein d'embryon). Les auteurs signalent diverses atteintes de ces cellules (nécrose, asphyxie, dégradation de l'ADN...), induites soit par le glyphosate, soit par un produit de sa dégradation (AMPA), soit par un adjuvant (POEA) qui facilite son incorporation par les plantes cibles, soit par des formulations commerciales de l'herbicide[27].
Efficacité et résistances
Le glyphosate s'est d'abord montré extrêmement efficace, puis sont peu à peu apparues des souches de mauvaises herbes résistantes. Les cultures OGM résistantes au glyphosate, surtout développées aux Etats-Unis à la fin des années 1990, ont contribué à une augmentation de l'usage du glyphosate dans les parcelles OGM (93 % des surfaces en soja aux USA en 2006). Ce sont en 2007 sept adventices qui ont produit des souches résistantes à ce pesticide, dont Ambrosia trifida (l'Ambroisie trifide ou Grande Herbe à poux) trouvée dans l'Ohio et l'Indiana, qui est une plante qui s'installe facilement dans le soja, occasionnant jusqu'à 70 % de diminution de rendement [28]. En France, l'INRA de Dijon a confirmé en 2007 un premier cas de résistance au glyphosate d'une espèce végétale : l'ivraie raide (Lolium rigidum)[29].
Certains craignent aussi que par hybridation des crucifères sauvages acquièrent le transgène de résistance au Glyphosate, et ne puissent plus être désherbés dans les champs ou bords de route par les désherbants totaux basés sur le glyphosate.
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est inscrite à l’annexe I de la directive 91/414/CEE par la directive 2001/99/CE.
- pour la France : cette substance active est autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché.
Plantes génétiquement modifiées
Certaines plantes ont été modifiées génétiquement par transgénèse pour résister au glyphosate. Le principe de cette résistance est d'utiliser une version mutée du géne de maïs codant pour la 5-enol pyruvylshikimate-3-phosphate synthase, enzyme normalement affectée par le glyphosate. La version mutante du gène code pour une version de la protéine appelée 2mEPSPS. Il existe plusieurs variétés de plantes cultivées transgéniques résistantes au glufosinate comme le soja et le cotton.
Ces plantes ont été évaluées par des tests toxicologiques et de prédiction de l'allergénicité. Aucun effet délétère de ces plantes, sur la santé humaine et d'autres animaux (ex: mammifères, poulet) n'a été observé ([30]).
Notes et références
- ↑ a , b , c , d et e GLYPHOSATE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ [1], sur France 24
- ↑ University of Georgia Weed Science Homepage
- ↑ Worthing, C.R. (dir. de publ.). The pesticide manual. A world compendium. 7e édition. The British Crop Protection Council. Lavenham Press, Lavenham, R.-U. (1983)
- ↑ Organisation mondiale de la santé (OMS). Glyphosate. Critères de la qualité sanitaire de l’environnement, Programme international de sécurité des produits chimiques (IPCS), Genève (1994)
- ↑ Degradation of glyphosate by Pseudomonas sp. PG2982 via a sarcosine intermediate. Kishore GM, Jacob GS (Monsanto Company) J Biol Chem. 1987 Sep 5;262(25):12164-8
- ↑ (en) Institute Of Sciences, consulté le 11 mars 2008
- ↑ (en) Glyphosate factsheet (part 2 of 2)
- ↑ Tortensson, L. Behaviour of glyphosate in soils and its degradation. in: The herbicide glyphosate. E. Grossbard et D. Atkinson (dir. de publ.). Butterworths, London, R.-U., p. 137 (1985)
- ↑ Monsanto Canada. Renseignements appuyant l’établissement d’une concentration maximale acceptable du glyphosate dans l’eau potable, communiqués à M.P. Toft, Bureau des dangers des produits chimiques, Direction de l’hygiène du milieu, Santé nationale et Bien-être social Canada (1985)
- ↑ Legris, J. et Couture, G. Résidus de glyphosate dans l’eau et les sédiments suite à des pulvérisations terrestres en milieu forestier en 1986. Publication 3322, Gouvernement du Québec, ministère de l’Énergie et des Ressources, Service des études environnementales, Québec (1989)
- ↑ Organisation mondiale de la santé. Glyphosate. Critères de la qualité sanitaire de l’environnement, Programme international de sécurité des produits chimiques (IPCS), Genève (1994)
- ↑ [2]
- ↑ 1) Tortensson, L. Behaviour of glyphosate in soils and its degradation. Dans : The herbicide glyphosate. E. Grossbard et D. Atkinson (dir. de publ.). Butterworths, London, R.-U., p. 137 (1985)
2)Willis, G.H. et McDowell, L.L. Pesticides in agricultural runoff and their effects on downstream water quality. Environ. Toxicol. Chem., 1 : 267 (1983) - ↑ Dossier sur la pollution des eaux en France par les pesticides
- ↑ Source : Sutherland, M. L. Metabolism of N-nitrosophosphono-methylglycine in the laboratory rat. Rapport no MSL 0242 (inédit), Monsanto Environmental Health Laboratory, St. Louis, MO (1978), cité à la référence 21, cité par le gouvernement canadien
- ↑ Maibach, H. I. Irritation, sensitive, photoirritation and photosensitization assays with a glyphosate herbicide. Contact Dermatitis, 15 : 152 (1986)
- ↑ FAO/OMS) "Résidus de pesticides dans les aliments -1986. Réunion mixte sur les résidus de pesticides" (JMPR), Rome, Italie. Document 77/2 de la FAO sur la production et la protection des plantes. p. 63 (1987)
- ↑ Colvin, L.B., Moran, S.J. et Miller, J.S. The metabolism of aminomethylphosphonic acid-14C in the laboratory rat. Rapport no 303 (inédit), Monsanto Environmental Health Laboratory, St. Louis, MO (1973), cité à la référence 21
- ↑ Maibach, H. I. Roundup formulation. Elimination and dermal penetration in monkeys. Rapport no 81/349 (inédit), University of California, soumis à Monsanto (1983), 21
- ↑ Page de Santé Canada sur le Glyphosate
- ↑ (en) Glyphosate toxic and “Roundup” worse. Mae-Wan-Ho et Joe Cummins. ISIS Press Release 07/03/2005,
- ↑ Richard S, Moslemi S, Sipahutar H, Benachour N. and Seralini GE. Differential effects of glyphosate and roundup on human placental cells and aromatase. Environ Health Perspect. 2005 Jun;113(6):716-20
- ↑ Savitz DA, Arbuckle , Kaczor D, Curtis KM. Male pesticide exposure and pregnancy outcome. Am J Epidemiol 2000, 146, 1025-36
- ↑ (en)Julie Marc, Odile Mulner-Lorillon, Robert Bellé, Biology of the Cell, 2003[pdf]
- ↑ Le désherbant le plus vendu au monde mis en accusation Le Monde.fr 9 janvier 2009
- ↑ BE Etats-Unis 78, 11/05/2007 Les scientifiques de plus en plus inquiets des résistances des adventices au glyphosate
- ↑ Viti-net.fr Glyphosate - Un premier cas de résistance détecté dans un vignoble en France (publié le 23/08/2007)
- ↑ Herouet-Guicheney, C., Rouquié, D., Freyssinet, M., Currier, T., Martone, A., Zhou, J., Bates, E.E.M., Ferullo, J-M., Hendrickx, K., Rouan, D. 2009. Safety evaluation of the double mutant 5-enol pyruvylshikimate-3-phosphate synthase (2mEPSPS) from maize that confers tolerance to glyphosate herbicide in transgenic plants. Regulatory Toxicology and Pharmacology 54: 143-153.
Voir aussi
Liens internes
Liens externes
- Article sur la pollution par les pesticides des eaux de France
- Article sur la politique anti-OGM du Venezuela, et sur le glyphosate en Colombie : Le Venezuela interdit les semences transgéniques
- Article sur le bilan inquiétant de l'utilisation des OGM en Argentine : Le soja OGM tourne au vinaigre en Argentine
- Articles sur le premier cas de résistance au glyphosate en France : Premier cas de résistance au glyphosate d'une espèce végétale en France paru sur Terre-net et Un premier cas de résistance détecté dans un vignoble en France paru sur Viti-net
- Portail de la chimie
- Portail de l’agriculture et l’agronomie
Catégories : Composé du phosphore | Produit chimique irritant | Produit chimique dangereux pour l'environnement | Produit chimique nocif | Substance active de produit phytosanitaire | Herbicide
Wikimedia Foundation. 2010.

