- Acide caféique
-
Acide caféique 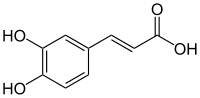
Général Nom IUPAC acide (E) 3-(3,4-dihydroxyphényl)prop-2-ènoïque Synonymes acide 3,4-dihydroxycinnamique
trans-cafféate
3,4-dihydroxy-trans-cinnamateNo CAS No EINECS DrugBank PubChem ChEBI SMILES InChI Apparence poudre cristalline jaune Propriétés chimiques Formule brute C9H8O4 [Isomères] Masse molaire[2] 180,1574 ± 0,009 g·mol-1
C 60 %, H 4,48 %, O 35,52 %,pKa 4.62[1] Propriétés physiques T° fusion 234 à 237 °C (décomposition)[3] Solubilité peu soluble dans l'eau[3] Masse volumique 1,478 g·cm-3 Précautions Directive 67/548/EEC 
XnPhrases R : 40, Phrases S : 36/37, Écotoxicologie DL50 > 721 mg·kg-1 (souris, i.p.)[4] LogP 1,15[1] Unités du SI & CNTP, sauf indication contraire. L'acide caféique ou acide (E) 3-(3,4-dihydroxyphényl)prop-2-ènoïque est un composé organique naturellement présent dans toutes les plantes car c'est un intermédiaire clé dans la biosynthèse de la lignine. C'est un dérivé de l'acide cinnamique qui a une structure très proche de l'acide férulique et, comme lui, il appartient aux grandes familles des phénylpropanoïdes et des acides-phénols.
Il n'a aucun lien avec la caféine, mais est présent naturellement en petite quantité dans le café à l'état libre et en très grande quantité à l'état estérifié.
Sommaire
Histoire
Le chimiste allemand,Runge (1795-1867), extrait du café un composé acide à l'aide d'eau chaude. Pfaff trouva dans le précipité à l'acétate plombique de Runge, une espèce particulière de tanin et un acide qu'il nomma "acide caféique".
Structure
L'acide caféique a une structure très proche de l'acide cinnamique dont il dérive. Comme lui il présente un groupe acrylique en bout de chaîne, mais s'en différencie par la présence de deux groupes hydroxy sur le phényle qui lui donne des propriétés propres aux polyphénols.
Répartition chez les plantes
Plantes alimentaires riches en acide caféique
d'après Phenol Explorer[5]Forme consommée Nom scientifique de la plante Teneur Sauge officinale, séchée Salvia officinalis 26,4 mg/100g Menthe douce, séchée Mentha spicata 25,00 mg/100g Cannelle de Ceylan Cinnamomum verum 24,20 mg/100g Thym commun, sec Thymus vulgaris 21,28 mg/100g Airelle rouge Vaccinium vitis-idaea 6,34 mg/100g Pruneau, jus à partir de concentré Prunus domestica 5,10 mg/100g Endive, crue Cichorium intybus L. var foliosum 2,61 mg/100g Datte, séchée Phoenix dactylifera 2,52 mg/100g Olive noire, crue Olea europaea 2,10 mg/100g Pomme de terre, crue Solanum tuberosum 1,62 mg/100g Pomme, compote Malus pumila 1,14 mg/100g Abricot Prunus armeniaca 0,66 mg/100g Vin rouge Vitis vinifera 1,88 mg/100ml Boisson de café, filtre Coffea sp 0,03 mg/100ml L'acide caféique et son dérivé, l'ester caféate de phénéthyle (caffeic acid phenetyl ester - CAPE, ester de l'acide caféique et du 2-phényléthanol), sont présents dans presque toutes les plantes[6],[7] et en particulier en grande quantité dans les grains de café, d'où il fut isolé pour la première fois au XIXe siècle et dont il tire son nom. En général, il est présent sous forme estérifiée[8], principalement avec l'acide quinique avec lequel il forme l'acide chlorogénique. On rencontre ce dernier particulièrement dans le café mais aussi dans la pomme. Parmi les autres formes estérifées courantes, on trouve l'acide caféoyltartrique (ou acide caftarique) formé avec l'acide tartrique présent dans le raisin, l'acide caféoylshikimique (formé avec l'acide shikimique) naturellement présent dans la datte, l'acide caféoylmalique (formé avec l'acide malique) naturellement présent dans le radis, ou encore estérifiée avec du glucose (caféoylglucose) ou sous forme d'amide avec la putrescine (caféoylputrescine).
Absorption
L'acide caféique est extrêmement bien absorbé au niveau de l'intestin. Les mesures[9] ont été faites sur des patients ayant une iléostomie, dont les matières peuvent être récupérées avant l'entrée dans le côlon. Après avoir consommé 2,8 mmol d'acide caféique, seulement 5% était retrouvé dans la poche, c'est-à-dire que 95% était absorbé dans l'intestin grêle. On retrouve ensuite 11% de cet acide caféique dans les urines. Une partie est méthylée dans le foie et une partie accessoire subit une glucuronidation et une sulfatation[10].
Biosynthèse
Il est biosynthétisé par hydroxylation de l'acide paracoumarique (sous forme ester), lui même obtenu par hydroxylation de l'acide cinnamique (éventuellement aussi obtenu via l'élimination du groupe amine de la tyrosine). C'est un précurseur de l'acide férulique, de l'alcool coniférylique et de l'alcool sinapylique, monomères de la lignine et de la lignane[11]. La transformation de l'acide caféique en acide férulique est catalysée par une enzyme spécifique l'acide caféique-O-méthyltransférase.
-
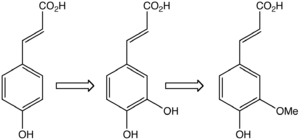 Dans les plantes, l'acide caféique (milieu) est formé par hydroxylation de l'acide paracoumarique (gauche) et transformé en acide férulique (droite).
Dans les plantes, l'acide caféique (milieu) est formé par hydroxylation de l'acide paracoumarique (gauche) et transformé en acide férulique (droite).
Activités pharmacologiques
- Activité antioxydante
L'acide caféique, comme tous les polyphénols, possèdent des groupes hydroxyles phénoliques -OH, capables de prévenir ou ralentir l'oxydation des lipides. Dans une étude comparative avec l'acide chlorogénique, l'effet de ces deux acides sur l'autoxydation du triacylglycérol a été étudié[12]. Il a été trouvé qu'à la concentration de 2,8 10-4 M, ces deux acides avaient pratiquement la même activité mais qu'à des concentrations plus élevées, l'acide caféique était plus efficace.
L'acide caféique, au même titre que le Trolox (une vitamine E hydrosoluble), est capable de protéger les cellules contre les dommages provoqués par les radicaux libres[13]. En présence de radicaux de monoxyde d'azote •NO, les cellules épithéliales (d'ouies de truites) meurent sauf si elles sont protégées par l'acide caféique ou le Trolox. Il a été montré in vitro que le traitement par l'acide caféique inhibe la voie de l'apoptose induite par •NO.
- Activité anti-inflammatoire, antimutagène
Application
Kraft Foods a breveté en 1993 l'utilisation de l'acide caféique et de ses sels (de 0,001% à 0,2%) comme masqueur de l'arrière goût amer d'édulcorant artificiels tels que l'acésulfame potassium et la saccharine[14].
Notes et références
- (en) « acide caféïque » sur ChemIDplus
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (de) Fiche Merck
- Yakugaku Zasshi. Journal of Pharmacy. Vol. 104, Pg. 793, 1984.
- Phenol Explorer INRA
- (en) Red Clover Flowers Herbal Information
- (en) Dr. Duke's Phytochemical and Ethnobotanical Databases
- Par sa fonction acide, avec les fonctions hydroxyle d'autres composés, y compris d'autres acides, hydroxylés
- Olthof MR, Hollman PC, Katan MB., « Chlorogenic Acid and Caffeic Acid are absorbed in humans », dans The Journal of Nurition, vol. 131, no 1, 2001, p. 66-71
- Mateos R, Goya L, Bravo L., « Uptake and metabolism of hydroxycinnamic acids (chlorogenic, caffeic, and ferulic acids) by HepG2 cells as a model of the human liver. », dans J Agric Food Chem., vol. 54, no 23, 2006, p. 8724-32
- Wout Boerjan, John Ralph, Marie Baucher Annual Reviews Plant Biology 2003, volume 54, 519–46. DOI:10.1146/annurev.arplant.54.031902.134938.
- Emma M.Marinova,A. Toneva, N. Yanishlieva, « Comparison of the antioxidative properties of caffeic and chlorogenic acids », dans Food Chemistry, vol. 114, 2009, p. 1498-1502
- Chung MJ, Walker PA, Hogstrand C, « Dietary phenolic antioxidants, caffeic acid and Trolox, protect rainbow trout gill cells from nitric oxide-induced apoptosis », dans Aquatic Toxicology, vol. 80, 2006, p. 321-328
- (en) JA Riemer. United States Patent 5,336,513
Voir aussi
- Portail de la chimie
- Portail des odeurs, des senteurs et du parfum
Catégories :- Produit chimique nocif
- Acide hydroxycinnamique
- Benzènediol
- Acide phénolique
- Modificateur de goût
- Cancérogène du groupe 2B du CIRC
-
Wikimedia Foundation. 2010.
