- Toluène
-
Toluène 
structure et représentations du toluène Général Nom IUPAC Toluène Synonymes Méthylbenzène
Toluol
PhénylméthaneNo CAS No EINECS PubChem SMILES InChI Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C7H8 [Isomères] Masse molaire[5] 92,1384 ± 0,0062 g·mol-1
C 91,25 %, H 8,75 %,Moment dipolaire 0,375 ± 0,010 D [2] Susceptibilité magnétique χM 66,1×10-6 cm3·mol-1[3] Diamètre moléculaire 0,568 nm [4] Propriétés physiques T° fusion -95 °C[1] T° ébullition 110,58 °C [6] Solubilité 0,53 g·l-1 dans l'eau
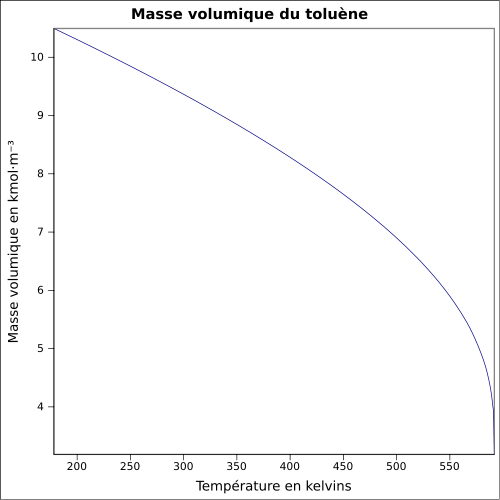
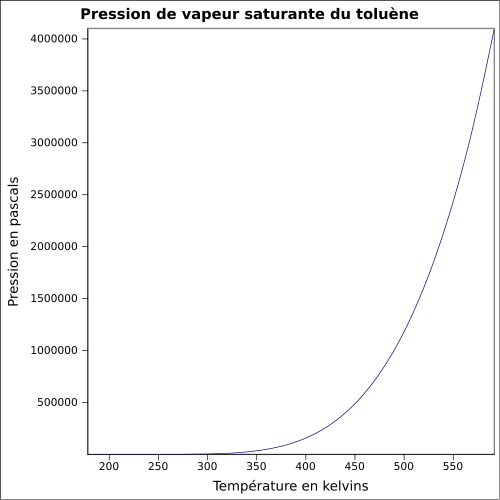
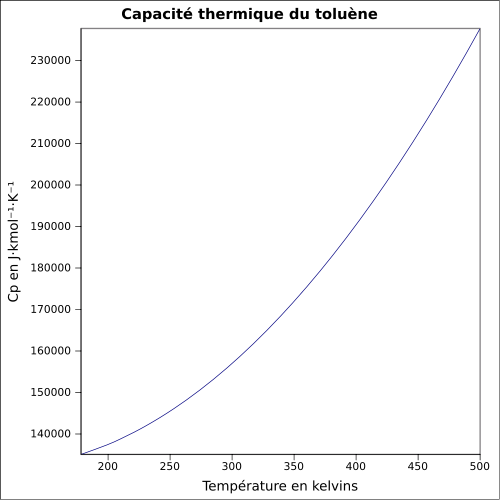
infinie dans l'éthanol, l'acétone, l'hexane, le dichlorométhaneMasse volumique 0,8670 g·cm-3 [7] T° d'auto-inflammation 480 °C[1] Point d’éclair 4 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 1,1–7,1 %vol[1] Pression de vapeur saturante 29 hPa (20 °C) Viscosité dynamique 0,59×10-3 Pa·s Viscosité cinématique 0,681 m2·s-1 Point critique 318,65 °C [6], 41,1 bar [9] Thermochimie Cp Propriétés optiques Indice de réfraction  1,4941 [4]
1,4941 [4]Précautions Directive 67/548/EEC 
Xn
FPhrases R : 11, 38, 48/20, 63, 65, 67, Phrases S : 2, 36/37, 62, [11] Transport - 1294 NFPA 704 SIMDUT[13] 

SGH[14] 

DangerClassification du CIRC Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[12] Inhalation Nausée, vomissements Écotoxicologie LogP 2,69[1] DJA 0,22 mg/kg p.c./jour[15] Seuil de l’odorat bas : 0,16 ppm
haut : 37 ppm[16]Unités du SI & CNTP, sauf indication contraire. Le toluène, également appelé méthylbenzène ou phénylméthane est un hydrocarbure aromatique sous la forme d'un liquide transparent, très répandu et utilisé comme produit de départ industriel ou comme solvant. Il dissout un grand nombre d'huiles, graisses, résines (naturelles ou de synthèse). Il a une odeur caractéristique (type dissolvant pour peinture) rappelant celle, douceâtre, du benzène apparenté.
Sommaire
Historique
Le nom de toluène dérive du nom plus ancien toluöl qui fait référence à l'extrait de tolu, un extrait aromatique de l'arbre tropical Myroxylon balsamum duquel il a été extrait pour la première fois. On doit ce nom au chimiste Suédois Jöns Jacob Berzelius. Sa synthèse fut découverte par Rudolf Fittig.
Propriétés chimiques
Le toluène réagit comme un hydrocarbure aromatique normal par substitution électrophile aromatique. Le groupe méthyle le rend approximativement 25 fois plus réactif que le benzène dans ce genre de réactions. Par sulfonation il donne l'acide paratoluènesulfonique, tandis que sa chloration par le chlore en présence de chlorure ferrique donne un mélange d'isomères ortho et para de chlorotoluène. La nitration par l'acide nitrique donne un mélange d'ortho- et de para-nitrotoluène. En chauffant, la réaction se poursuit pour donner le dinitrotoluène et finalement le trinitrotoluène (TNT) qui est explosif.
Le groupe méthyle peut également réagir dans d'autres réactions d'oxydation. Le permanganate de potassium donne l'acide benzoïque, tandis que le chlorure de chromyle donne le benzaldéhyde. Une halogénation en conditions radicalaires donne les halogénures de benzyle. Par exemple, avec la N-Bromosuccinimide en présence d'AIBN, on obtient le bromure de benzyle.
L'hydrogénation catalytique du toluène donne le méthylcyclohexane. À cause de la stabilité particulière du système aromatique, cette réaction requiert une pression élevée d'hydrogène.
Propriétés physiques
Le toluène est un liquide aux conditions normales de pression et de tempéraure . Il est quasi--insoluble dans l'eau (0,535 g·l-1 à 25 °C), mais miscible à beaucoup de solvants organiques (acétone, oxyde de diéthyle, chloroforme, éthanol…), et soluble dans l’acide acétique glacial.
Le toluène a une constante molale cryoscopique de 3,55 °C∙kg/mol et une constante molale ébullioscopique de 3,40 °C∙kg/mol. Sa vapeur est plus lourde que l'air, et forme avec ce dernier un mélange explosif.
En RMN du proton, le toluène se présente sous la forme de plusieurs pics entre 7,28 ppm et 7 ppm pour les hydrogènes du cycle benzénique et d'un singulet à 2,38 ppm pour les hydrogènes du groupement méthyle. En RMN du carbone, le toluène se présentent sous plusieurs pics, à 137,8 ppm pour le carbone en α du méthyl, à 129,09 ppm pour les carbones β , à 128,28 ppm pour les carbones γ et à 125.38 pour le carbone opposé au méthyle. Le carbone du groupement méthyl présente un pic à 25 ppm.
Fabrication et synthèse
Le toluène est présent en faible proportion dans le pétrole brut. Il est habituellement produit par reformage catalytique dans le procédé de fabrication de l'essence. On l'obtient également par craquage dans le procédé de fabrication de l'éthylène ou alors, à partir du charbon. Sa purification finale se fait par distillation ou par extraction.
Production
Durant la Seconde Guerre mondiale, sa production est essentielle à la fabrication d'explosifs puissants comme le TNT.
L'industrie chimique de l'URSS a produit 245 500 tonnes de ce produit entre 1940 et 1945 auxquelles s'ajoutent 103 000 tonnes fournit par les Alliés[17].
L'Allemagne nazie avait planifié une production de 9 600 tonnes en décembre 1939, et, en septembre 1944, comptait sur une production de 15 500 tonnes mais n'a finalement produit que 12 200 t[18].
Selon l’ECB, en 2003, l’Union européenne produit chaque année près de 16,75 millions de tonnes de toluène dont 14 millions de tonnes sous forme de mélanges incorporés à l’essence et 2,75 millions sous forme de toluène commercial[19].
Deux des principaux fabricants de ce produit sont, en 2006, Total Petrochemicals et Enichem. En France, à la même date, 163 854 tonnes de toluène ont été produites. 57 512 tonnes importées et 11 237 tonnes exportées[20].
Capacités de production annuelles en 2006 en 10³ t États-Unis 10 900 Japon 6 100 Corée du Sud 3 080 Chine 2 830 Union européenne 2 040 Canada 1 630 Utilisation
Le toluène sert :
- à élever l'indice d'octane dans les carburants, mélangé avec du benzène et des xylènes. Il est donc présent dans divers carburants pétroliers.
- de solvant d’extraction dans l’industrie cosmétique (parfum) et dans l’industrie pharmacochimique
- comme solvant ou élément de fabrication de peintures, vernis, laques, cires et encres(imprimerie..),
- de produit de départ pour divers procédés industriels : synthèse du caoutchouc, du phénol, du TNT, du diisocyanate de toluène (TDI), nécessaire pour obtenir la mousse de polyuréthane, benzène et xylènes, nitrotoluène, chlorure de benzyle, benzaldéhyde, acide p-toluènesulfonique, vinyltoluène, etc.
- pour la fabrication d'adhésifs et de colles,
- pour le tannage du cuir.
Toxicologie, écotoxicologie, précautions et métabolisme
C'est un produit nocif et écotoxique (souvent présent dans certains sols industriels pollués). Sa toxicité aiguë est faible, mais il a comme premiers organes-cibles le système nerveux central (cerveau, moelle). C'est aussi un irritant pour la peau, l'œil et le système respiratoire.
Chez l'animal de laboratoire, l'exposition à des taux significatifs de toluène induit des symptômes généraux : hyperactivité, irritation de la peau et surtout des muqueuses (écoulement nasal, larmes), irritation des voies respiratoires, avec essoufflement. À des taux d'exposition supérieurs à 2 000 ppm dans l'air, le stade suivant est celui d'une narcose (ataxie, dégradation des fonctions cognitives, troubles de l’équilibre et altérations neurochimiques. La mort est due à un arrêt respiratoire induit par une déplétion du système nerveux central).
L'irritation augmente selon la durée d'exposition et la dose ; chez le lapin, un érythème modéré puis un œdème léger apparaissent après 72 h, irréversibles à 7 jours, et - chez le lapin toujours - un rinçage de l'œil exposé après 4 et 30 secondes ne diminuent pas l’intensité de l’irritation.Sa toxicité chronique a été étudié chez l'animal de laboratoire (souris, rat) chez lequel on observe :
- une augmentation de poids de divers organes impliqués dans la détoxication (foie, rein par exemple après exposition à 1 250 ppm durant 15 jours chez le rat... à 2 500 ppm le rat grossi, avec augmentation du poids du cerveau, du cœur, des poumons et des testicules, avec des symptômes de dyspnée et d'ataxie).
- une modification du taux de neurotransmetteurs
- une neurotoxicité affectant notamment l’hippocampe et le cervelet (avec altération de l'audition[21],[22])
- une exposition longue (2 ans à 1 500 ppm) chez le rat a induit une inflammation des muqueuses nasales avec érosion de l’épithélium olfactif, métaplasie et dégénérescence de l’épithélium respiratoire, mais en dessous de 300 ppm, aucun symptôme n'a été observé (La NOAEL ou concentration sans effet toxique observé était de 625 ppm pour une exposition de 6,5 heures par jour, 5 jours par semaine durant 15 semaines ; ou de 300 ppm sur une durée d'exposition de 2 ans. Par voie orale, la NOEL était pour le rat et la souris de 625 mg·kg-1·j-1 pendant 13 semaines)[23],[24].
Le toluène ne semble pas avoir d'effets sur l'ADN in vivo, alors qu'il en a in vitro.
Via la peau ou par inhalation, il ne semble pas cancérogène[25],[26],[27],[28], mais en tant que solvant pourrait contribuer à l'entrée dans l'organisme de produits cancérigènes.
Le toluène est reprotoxique[29] (altération de la fécondité à des taux où il n'est pas toxique pour la mère, chez le rat). Il altère aussi la fertilité des mâles via une altération de la spermatogenèse et/ou peut-être du fonctionnement de l'épididyme : réduction de 20 % du nombre de spermatozoïdes sans réduction de leur mobilité sous 6 000 ppm. A delà, le nombre de spermatozoïdes diminue, ainsi que leur mobilité, mais sans modification de poids des testicules ou de la spermatogenèse testiculaire, et sans altération du taux d'hormones après un mois d’exposition[17]. La fertilité n'est pas affectée en deçà de 600 ppm.
Il passe facilement dans l'embryon, induisant au delà de 600 ppm chez l'animal (pas de donnée pour l'homme) un retard de croissance et de poids à la naissance et des troubles psychomoteurs postnataux qui traduisent la neurotoxicité du toluène pour le cerveau embryonnaire, bien que sans malformations externes[30],[31], y compris par inhalation[32]. Il n’est pas réputé tératogène in vivo ni in vitro. L’UE l’a classé toxique pour la reproduction, catégorie 3, R 63.Cinétique dans l'organisme
Même sous forme liquide il franchit mal la barrière de la peau (14 à 23 mg/cm2/h) et sous forme vapeur encore moins (4,6 μg/cm2/h pour la souris nude exposée à 1 000 ppm, alors que de la peau de rat, in vitro, en absorbe 0,78 μg/cm2/min[33].).
Il traverse cependant aisément la muqueuse pulmonaire, dans les deux sens (10-20 % du toluène ingéré et/ou inhalé est ensuite excrété sous forme de vapeur via l'expiration). Le taux de benzène exhalé augmente après ingestion d'alcool éthylique, ce dernier inhibant le métabolisme du toluène, ce qui diminue son excrétion sous urinaire.
L'inhalation de vapeurs de toluène est nocive. A hautes doses, elle induit des nausées. L'inhalation chronique de toluène de façon prolongée provoque des dommages irréversibles au cerveau. À partir des poumons, il est transporté par le sang, pour moitié fixé à l'hémoglobine et pour moitié dans le sérum (chez l'homme... Chez le rat, il est majoritairement véhiculé par le sérum). Il est détectable dans le sang 10 à 15 minutes après le début de l’exposition (à un taux d'autant plus élevé que le taux de benzène était élevé dans l'air respiré ; le degré d’absorption (50 % environ de la concentration) dépendant aussi du taux de ventilation pulmonaire. On peut donc supposer que les joggers courant à proximité d'un grand axe de circulation y sont plus exposés. Il passe rapidement dans le cerveau : des rats expérimentalement exposés montrent un pic dans le sang 53 minutes après l'exposition et 5 minutes plus tard (58 min) dans le cerveau (riche en tissus gras). On le trouve aussi dans les moelles osseuse et épinière, les tissus adipeux, le foie et les reins.
Le toluène est également très bien absorbé via le tractus gastro-intestinal ; avec (chez l’homme et le rat) un pic détectable dans le sang environ deux heures après son ingestion.
Il est à peine filtré par la barrière placentaire ; chez le rat, la concentration dans le fœtus est environ 75 % de celle du sang maternel. Le lait maternel, s'il en contient en permet aussi le transfert de la mère à l'enfant(chez l’homme et l’animal).La toxicité du toluène s'explique par son métabolisme. Comme le toluène est très faiblement soluble dans l'eau, il ne peut pas quitter l'organisme par les voies traditionnelles (urine, fèces, transpiration). Il doit être métabolisé pour être excrété. Le groupe méthyle du toluène s'oxyde plus facilement que le noyau aromatique. Cette réaction est réalisée dans le foie par les monooxygénases à cytochromes P450. Il s'ensuit que 95% du toluène est transformé en alcool benzylique. Ce sont les 5% restant qui créent les métabolites toxiques, les époxydes du noyau aromatique. La grande majorité de ces époxydes est conjuguée à la glutathione, cependant le peu qui parvient à s'échapper endommage gravement la machinerie cellulaire en allant alkyler certaines protéines, voire l'ADN.
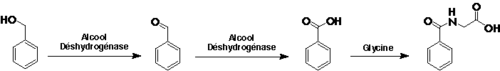
Le toluène est excrété principalement via l'urine sous forme d'acide benzoïque - obtenu par oxydation enzymatique de l'alcool benzylique - et sous forme d'acide hippurique obtenu par conjugaison de l'acide benzoïque avec la glycine.
Synergies
De nombreuses synergies sont probables, car le toluène est un puissant solvant. On sait par exemple que l'association toluène - xylène induit par compétition métabolique, une augmentation du taux (sanguin et cérébral) de toluène[33].
Valeurs limites d’exposition professionnelle contraignantes
Il en existe dans certains pays. Par exemple en France, elles sont de 50 ppm soit 192 mg·m-3 (pour 8 h) et de 100 ppm soit 384 mg·m-3 (pour une exposition de court terme, ou 15 min)[34]. Aux États-Unis,ce seuil est plus bas (50 ppm à ne pas dépasser pour 8 h d'exposition).
Notes et références
- TOLUENE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Hyp J. Dauben, Jr., James D. Wilson et John L. Laity, « Diamagnetic Susceptibility Exaltation in Hydrocarbons », dans Journal of the American Chemical Society, vol. 91, no 8, 9 avril 1968, p. 1991-1998
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1), p. 85
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part II. Aromatic and Cyclic Hydrocarbons », dans J. Phys. Chem. Ref. Data, vol. 33, no 2, 30 avril 2004, p. 541 [lien DOI]
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0071432205), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Properties of Various Gases sur flexwareinc.com. Consulté le 12 avril 2010
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-858-6)
- ESIS. Consulté le 6 décembre 2008
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme » sur http://monographs.iarc.fr, CIRC, 16 janvier 2009. Consulté le 22 août 2009
- « Toluène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- Toluene sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- The USSR's economy in 1941-1945
- (en)Appendix D. Strategic Air Attack on the Powder and Explosives Industries : Table D6 Plants for Production of Raw Materials for Powders and Explosives
- (fr)[PDF] I N E R I S - Données technico-économiques sur les subs tances chimiques en France : Toluène
- (fr) Hydrocarbures aromatiques, Société Française de Chimie
- Campo P et al. Toluene-induced hearing loss: A mid-frequency location of the cochlear lesions. Neurotoxicology and Teratology, 1997; 19: 129-40.
- Campo P et al. Combined effects of simultaneous exposure to toluene and ethanol on auditory function in rats. Neurotoxicology and Teratology, 1998; 20: 321-332.
- Guillot J-P et al. Evaluation of the cutaneous-irritation potential of 56 compounds. Food and Chemical Toxicology, 1982; 20: 563-572.
- Guillot J-P et al. Evaluation of the ocular-irritation potential of 56 compounds. Food and Chemical Toxicology, 1982; 20: 573-582.
- Toxicity summary for toluene. Toxicity profiles, Risk Assessment Information System; 1994. Consultable sur le site http://risk.lsd.ornl.gov/tox/rap_toxp.shtml
- Toxicology and carcinogenesis studies of toluene (Cas n° 108-88-3) in F344/N Rats and B6C3F1 Mice (Inhalation Studies). Toxicity Review TR- 371, NTP; 1990. lien NIEHS
- Toluene. ln: IARC monographs on the evaluation of carcinogenic risks to humans. Lyon: IARC, 1999; 71 (2); 829-864.
- Toxicology and carcinogenesis studies of toluene (Cas n° 108-88-3) in F344/N Rats and B6C3F1 Mice (Inhalation Studies). Toxicity Review TR-371, NTP; 1990. tr371.html Site NIEHS
- Toluène. Fiche toluène de DEMETER. Documents pour l’évaluation médicale des produits toxiques vis-à-vis de la reproduction, INRS, 2006
- Dalgaard M et al. – Developmental toxicity of toluene in male rats : effects on semen quality, testis morphology, and apoptotic neurodegeneration. Archives of Toxicology, 2001; 75 (2): 103-109.
- Wilkins-Haug L – Teratogen update: toluene. Teratology, 1997; 55: 145-151.
- Ono A et al. – Toluene inhalation induced epididymal sperm dysfunction in rats. Toxicology, 1999, 139 (3): 193-205.
- Fiche toxicologique INRS, accessible via les liens externes de cette page
- Art. R. 231-58 du Code du travail français
Voir aussi
- Xylène, benzène avec deux groupement méthyle
- Nitrotoluène, toluène substitué par un groupement nitro
- Dinitrotoluène, toluène substitué par deux groupements nitro
- Trinitrotoluène toluène substitué par trois groupements nitro
- Toluidine, toluène substitué par un groupement amine
Liens externes
- (fr) Fiche toxicologique de l'INRS
- (fr) Base de données BIOTOX (INRS)
- (fr)Fiche internationale de sécurité
Catégories :- Produit chimique nocif
- Produit chimique facilement inflammable
- Méthylbenzène
- Solvant
- Hydrocarbure aromatique
Wikimedia Foundation. 2010.