- Dichloromethane
-
Dichlorométhane
Dichlorométhane 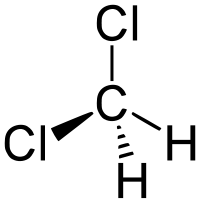
Général Nom IUPAC dichlorométhane Synonymes chlorure de méthylène
DCMNo CAS No EINECS SMILES Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute CH2Cl2 [Isomères] Masse molaire 84,933 g∙mol-1
C 14,14 %, H 2,37 %, Cl 83,48 %,Propriétés physiques T° fusion -95,1 °C[1] T° ébullition 40 °C[1] Solubilité dans l'eau à 20 °C : 1.3 g/100 ml[1];
10 g/100 ml dans l'acétone,
l'éthanol, l'éther diéthyliqueMasse volumique (eau = 1) : 1.3[1] T° d’auto-inflammation 556 °C[1] Limites d’explosivité dans l’air en volume % dans l'air : 12-25[1] Pression de vapeur saturante à 20 °C : 47.4 kPa[1] Viscosité dynamique 0,44 cP à 20 °C Propriétés optiques Indice de réfraction nd 1,4240 Précautions Directive 67/548/EEC 
XnPhrases R : 40, Phrases S : 2, 23, 24/25, 36/37, [2] Transport - 1593 NFPA 704 SIMDUT[4] 
SGH[5] 
AttentionClassification du CIRC Groupe 2B : Peut-être cancérogène pour l'homme[3] Écotoxicologie LogP 1.25[1] DJA 0,05 mg/kg p.c./jour[6] Composés apparentés Autres composés - Haloformes apparentés :
- Chlorométhanes apparentés :
- Chlorométhane
Chloroforme
Tétrachlorométhane
Unités du SI & CNTP, sauf indication contraire. Le dichlorométhane ou chlorure de méthylène ou R30 selon la liste des gaz fluorés et frigorigènes, est un composé chimique utilisé principalement comme solvant pour les composés organiques. C'est un liquide incolore et volatil émettant une odeur douceâtre relativement forte mais qui rend certaines personnes mal à l'aise.
Le chlorure de méthylène a été obtenu pour la première fois en 1840 par le chimiste français Henri Victor Regnault, qui l'a isolé d'un mélange de chlorométhane et de chlore précédemment exposé à la lumière.
Sommaire
Production
Dans l'industrie, le dichlorométhane est produit par réaction du chlorométhane ou du méthane avec le chlore gazeux entre 400 °C et 500 °C. À ces températures, aussi bien le méthane que le chlorométhane subissent une série de réactions qui forment progressivement des produits de plus en plus chlorés.
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
Le résultat de cette série de réaction est un mélange de chlorométhane, dichlorométhane, chloroforme et tétrachlorométhane. Ces composés sont ensuite séparés par distillation.
Usages
Son caractère volatil et sa capacité à dissoudre une grande panoplie de composés organiques font du dichlorométhane un solvant idéal pour de nombreux procédés chimiques. On s'en sert principalement comme décapant pour la peinture ou comme dégraissant. Dans l'industrie alimentaire, on s'en sert pour décaféiner le café et pour préparer des extraits de divers arômes tels que le houblon. Comme il est volatil, on s'en sert aussi comme propulseur pour les aérosols et comme agent moussant pour obtenir la mousse de polyuréthane. On s'en sert aussi comme pesticide pour stocker les fraises et les céréales. Comme il n'est pas complètement inoffensif pour la santé, on a toutefois cherché des alternatives à la plupart de ses applications.
Dangers
Le dichlorométhane est le moins toxique des chlorohydrocarbones simples mais il n'est quand-même pas sans risques. Le contact prolongé avec la peau peut provoquer des irritations ou des brûlures par dissolution des tissus graisseux.
Le dichlorométhane est classé en France Cancérigène classe 3, c'est-à-dire substance suspectée d'être cancérigène mais pour laquelle aucun lien direct de cause à effet entre l'exposition et des cancers survenus n'a été démontré. En effet, il est bien cancérigène chez la souris, mais grâce à un mécanisme spécifique à la souris, nécessitant une protéine absente chez l'homme[7]. A ce jour, aucune étude n'a pu montrer un caractère cancérigène effectif chez l'homme.
Dans beaucoup de pays, les produits contenant du dichlorométhane doivent porter des étiquettes avertissant de ses dangers pour la santé. Toutefois, on le confond souvent avec l'essence de térébenthine ou le white spirit, qui présente moins de risques notamment pour la peau.
Notes et références
- ↑ a , b , c , d , e , f , g , h et i DICHLOROMETHANE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « dichlorométhane » sur ESIS, consulté le 22 février 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2B : Peut-être cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Chlorure de méthylène » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ Concentrations/doses journalières admissibles et concentrations/doses tumorigènes des substances d'intérêt prioritaire calculées en fonction de critères sanitaires, publié par Santé Canada
- ↑ Pharmaceutical Technology europe, 1996, 8 (10), 30-31
Liens externes
- Portail de la chimie
Catégories : Produit chimique nocif | Halogénométhane | Chloroalcane | Solvant
Wikimedia Foundation. 2010.

