- Syndet
-
Savon
On appelle savon, d'un mot gaulois préservé par le latin sapo, toute une classe de molécules amphiphiles composées de sels métalliques, spécifiquement de soude (hydroxyde de sodium) ou de potasse (hydroxyde de potassium) et d'acides gras. Leur caractère amphiphile leur donne leurs propriétés caractéristiques, notamment la formation de mousse et d'émulsions utiles pour le lavage.
Sommaire
Savons commerciaux décrits par un physico-chimiste
Les savons commerciaux sont fabriqués par réaction de saponification à partir de mélange de corps gras, triester de glycérol et d'acides gras, appelé couramment triglycérides d'acides gras et d'une base forte. Les molécules des savons communs comportent une chaîne de 8 à 19 atomes de carbone, selon les variétés, associée à une tête polaire.
Depuis 1950, les savons tendent à être distingués des autres molécules détergentes. Toutefois, le langage familier des laboratoires et usines assimile par commodité savon (soap), détergent (detergent) ou tensio-actif (surfactant). Ces derniers produits souvent pétrochimiques diffèrent plus par leurs compositions, conformations caractéristiques et propriétés d'usage que par les mécanismes évoqués ci-dessous.
Les savons se présentent sous des formes variées, selon leur teneur en eau, la présence de corps gras ou d'autres impuretés. Secs, ils forment des solides cassants. Humides ou gorgés d'eau, ces solides encore fermes glissent sur les surfaces, deviennent mous, voire perdent toute tenue dimensionnelle en déliquescence finale. Ces observations communes attestent leur nature de colloïdes, ainsi que leurs autres formes de mousses, de gels...
Les savons, précisément les sels d'acides gras, ne sont en réalité pas solubles dans l'eau et dans l'huile, mais amphiphiles, c'est-à-dire qu'ils se placent à l'interface des phases eau et huile non miscibles. En absence d'une des phases, ils forment des structures moléculaires singulières, appelées micelles dans l'eau et micelles inverses dans l'huile. Si la proportion des phases change jusqu'à une teneur volumique équivalente, des structures de phases, appelées états mésomorphes, s'organisent, caractérisées par une morphologie topologique en gouttelettes, puis en cylindres et enfin en planches parallèles. Au-delà de l'inversion de phase, on retrouve des organisations similaires.
Dans un récipient ou bassin rempli d'eau savonneuse, les molécules de savon s'arrangent en couches monomoléculaires couvrant en premier lieu des surfaces considérables à l'interface eau/air, comme le prouvent les travaux des devanciers d'Irving Langmuir. L'air est analogue à une matière lipophile et permet la création de bulles et figures légères respectant le principe de moindre énergie de structures, à partir de très fins films liquides d'eau savonneuse.
Piégées dans l'eau, elles forment des micelles qui peuvent solubiliser les graisses, c'est-à-dire stabiliser les gouttelettes d'huiles, enrober les matières grasses en formant des émulsions ou et des suspensions stables. Ces extraordinaires propriétés de surface, la mouillabilité macroscopique du fait de l'abaissement de tension d'interface et surtout la stabilisation microscopique des poussières ou salissures grasses, facilement enlevées au cours du rinçage avec la phase aqueuse englobante et prépondérante expliquent l'emploi de savons depuis l'Antiquité pour le lavage ou le nettoyage des surfaces.
Propriétés physiques et chimiques
Les savons commerciaux sont des mélanges de sels de sodium ou de potassium d'acides gras. La longueur de la chaîne carbonée et surtout la présence d'insaturation, c'est-à-dire d'une double liaison induisant une conformation spatiale, une rigidité ou une mobilité spécifiques, affectent les propriétés.
Fusion, mélange et dispersion dans les solvants usuels
Le point de fusion des savons, même lorsque le sel d'acide gras est unique et purifié, reste assez mal défini, entre 200 °C et 250 °C, par mesure sur le banc Koffler. Le liquide obtenu est transparent, non laiteux.
A basses températures dans l'eau liquide, la dispersion du savon est difficile par agitation, sauf pour le laurate de sodium avec sa petite chaîne en C 11. Plus la température est élevée, plus la dispersion est facile, donnant des eaux savonneuses claires et opalescentes. En milieu basique, optimum de pH entre 10 à 12, est constatée une hydrolyse partielle en acides gras et en ions alcalins libres.
La dispersion est très faible dans le benzène, le toluène et la plupart des solvants organiques. La formation de micelles inverses est énergétiquement moins favorisée.
Une molécule amphiphile pour le lavage
Le principe d'action des molécules de carboxylates (R-CO2-) d'alcalin (Na+, K+) est du à leur amphiphilie : elles présentent une longue chaîne carbonée qui n'est pas polaire et à son extrémité, un groupe carboxylate.
La première partie longue est apolaire donc hydrophobe et lipophile. C'est la queue de l'acide gras d'origine qui se mêle facilement aux graisses. La seconde partie (la "tête") est polaire donc lipophobe et hydrophile, minimise son énergie en étant en contact avec la solution aqueuse.
Par la présence d'un nuage de solvatation ionique en double couche, au-dessus de la surface hydrophile, la micelle est stabilisée.
Les propriétés détergentes de l'eau savonneuse, agitée ou brassée, s'expliquent : les savons par leurs queues lipophiles se fixent à la salissure graisseuse ou à la tâche d'huile, et l'extraient du tissu ou support en l'enveloppant dans des colloïdes ou gouttelettes sphériques qui se séparent et coalescent avec des myriades de micelles. Au cours de l'agitation, les gouttelettes ou les micelles peuvent éclater à l'instar de bulles de savon dans l'air, mais la séparation est éphémère. Elles reforment aussitôt des gouttelettes ou micelles dans ces phases liquides et condensées. On remarque que la présence de savon abaisse notablement la tension superficielle de l'eau et facilite le déplacement des molécules et corps dans la phase eau, donc le recouvrement par le savon des micelles éclatées. Le savon tensio-actif accroît le pouvoir mouillant.
Mises en suspension et stabilisées dans l'eau malgré les chocs incessants, les gouttelettes huileuses et les poussières graisseuses qui ne peuvent plus s'agglutiner finissent par être entraînées par l'eau de rinçage. Le savon montre une autre facette de son pouvoir émulsifiant.
Art de la toilette corporelle
Lors de la toilette, le savon dissout la graisse constituant le film hydrolipidique qui recouvre la peau. La graisse est entraînée dans l'eau avec les saletés qu'elle contient. L'inconvénient est que le film hydrolipidique sert à protéger la peau et à retenir son eau. Le savonnage — ou tout lavage à l'aide de produits comportant des tensio-actifs, par exemple les gels pour la douche ou les lessives — fragilise donc la peau, jusqu'à ce que le film hydrolipidique se reconstitue, au bout de plusieurs heures.
Le savon est basique. Comme son pH est proche de 10 en solution très chaude et concentrée. Lors de la toilette, il perturbe l'acidité de la peau dont le pH est proche de 5.
Savons industriels et dureté de l'eau
Les autres sels de carboxylates d'acide gras, en particulier alcalino-terreux, calcium, strontium et baryum, les sels d'aluminium ou de métaux lourds, sont très difficilement solubles dans l'eau. A contrario, ils sont plus solubles dans les graisses et les huiles minérales, à l'instar des sels d'acide carboxylique à très longues chaînes ou contenant des cycles, comme celui du naphtalène. Ils sont utilisés dans l'industrie des colorants, et stabilisent les structures moléculaires des laques.
L'industrie des lubrifiants utilise, pour la fabrication des graisses, des carboxylates de lithium, de calcium, de magnésium ou encore d'aluminium. Les savons d'aluminium imperméabilisent les étoffes industrielles. Les médecins utilisaient les savons de plomb comme emplâtre simple.
Dans une eau dure, les molécules du savon réagissent avec les ions calcium et forment des dépôts de sels de calcium. Comme le savon est piégé, il faut une plus grande quantité de savon pour nettoyer à efficacité égale. Pour éviter ces inconvénients, on ajoute aujourd'hui aux savons des agents anticalcaires comme le très commun complexant EDTA.
Une eau dure, c'est-à-dire riche en cations calcium (Ca2+) ou magnésium (Mg2+), a pour effet de faire disparaître le savon, c'est-à-dire de substituer les carboxylates de sodium ou potassium en carboxylates de calcium ou magnésium insolubles dans l'eau, formant la « crasse de savon ». Les détergents synthétiques sont conçus pour être moins sensibles à la dureté de l'eau.
Autres savons biologiques
Les organismes vivants, comme les plantes à racines, utilisent des analogues de savons pour contrôler ou entraver la migration des ions métalliques. S'ils sont indésirables, les ions ne sont pas seulement précipités ou complexés, c'est la source métallique proche qui est souvent revêtue d'une couche protectrice. Ainsi les objets en cuivre sont préservées dans la terre humide entre les racines d'un arbre.
Histoire du savon
Le savon date de 3000 ans en Syrie. Il a été importé en France par les premiers templiers rentrés de guerre en Terre Sainte.
Le savon est, selon Pline, une invention gauloise qui décrit savons durs et savons mous. Le latin sapo, laisse un génitif saponis. Sous forme de l'accusatif saponem, il a donné le français savon. Le vieux-germanique Seipu a laissé Seife en allemand.
Substance lavante et nettoyante connue en Europe occidentale depuis l'époque gauloise, il est fabriqué en quantité à partir de cendres alcalines ou potassiques, de suif, de saindoux de sanglier ou d'huiles excédentaires non comestibles. Il sert surtout, appliqué sur les chevelures d'après la littérature latine, de shampooing ou de gel colorant à l'usage les longs cheveux en rouge. A côté de la toilette des mains et du visage, il faut retenir l'emploi de substances de toilettes complexes à base de plantes, de savons mêlés de substances adoucissantes ou grasses, tel le beurre ou la glycérine, mélange de moins en moins agressif ou de plus en plus protecteur appliqué de la pointe à la racine des cheveux.
L'odeur d'eau savonnée et d'acide butyrique, lorsque le beurre a ranci, était barbare aux nez romanisés du Haut-Empire et même du Bas-Empire. Grecs et Romains se débarrassent des poussières du stade ou des tâches en raclant une strille sur leur corps huilé, avant la régénération par les massages et l'eau des thermes, aux bains successifs chaud, tiède et froid.
Nihil novi sub sole, l'archéologue désavoue Pline l'Ancien, en affirmant que les savons sont les substances lavantes les plus anciennes. Les Sumériens semblent le connaître trois millénaires avant notre ère. Un millénaire plus tard, des textes décrivent la saponification. Un millénaire avant notre ère, les Phéniciens exportent le savon et le fabriquent à partir d'huile d'olive et de la soude végétale, comme deux millénaires plus tard en Syrie, en Grèce ou à Marseille. Ce savon est particulièrement réputé pour ses propriétés désinfectantes, dues principalement à l'usage de cendres de laurier dans sa fabrication.
Gallipoli, ville portuaire sur la mer Ionienne dans le sud de l'Italie, a probablement été l'origine du savon de Marseille[1]. Grâce à ses nombreuses oliveraies et à ses multiples pressoirs souterrains (frantoi ipogei), le Salento commercialise dans toute l'Europe une huile d'excellente qualité, destinée principalement à l'éclairage des villes et des fabriques textiles, mais aussi à un usage alimentaire. L'idée d'ajouter de la soude aux restes des olives qui venaient d'être pressées une première fois permit aux habitants de Gallipoli de fabriquer des savons blancs et de diversifier durablement leurs activités.
Au IXe siècle de notre ère, Marseille saponifie déjà son huile d'olive et produit de façon saisonnière son savon. Au XVe siècle, la région phocéenne semble un centre de production limité à la ressource locale. La soude marine qui désigne un carbonate de sodium plus ou moins pur provient des cendres obtenues par la combustion de plantes comme la salicorne. Après 1750, la fabrication devient industrielle, tant par les volumes que par les procédés normalisés. En 1791, le procédé proposé à l'Académie des Sciences par Nicolas Leblanc permet d'obtenir de la soude à partir du sel d'eau de mer, de chaux et de charbon.
En 1823, le chimiste français Eugène Chevreul explique la réaction de saponification. Ses expériences menées dès la Restauration lui ont permis de démontrer la structure générique des corps gras, combinaison chimique entre le glycérol, déjà reconnu par Scheele, et trois acides gras. Il est le premier à découvrir et affirmer que les savons sont des sels métalliques d'acides gras, et non pas des acides gras comme le croient alors les chimistes . Au XIXe siècle, des huiles de coprah et de palme importées à moindre coût d'outre-mer servent à la fabrication des savons. Le procédé d'Ernest Solvay réalise la synthèse industrielle du carbonate de sodium dès 1865, qui évince rapidement l'ancien procédé Leblanc, trop onéreux. Le savon devient un produit de consommation courante, apparaît dans les maisons bourgeoises et complète la panoplie des femmes de ménage, s'activant en semaine dans les nombreux et récents lavoirs communaux. Sans rival avant 1907, il sert au blanchissage du linge, au dégraissage de draps et des laines.
Début XXe siècle, l'hydrogénation des corps gras accroît le nombre et la variété des savons. Entre 1920 et 1930, alors que Marseille reste le principal centre de fabrication du savon en France, la concurrence survient avec les détergents synthétiques ou agents tensioactifs. Ces agents lavants sont utilisés encore aujourd'hui dans les shampooings, les gels douches et les « savons sans savon ».
Les multiples débouchés commerciaux des savons que représentent l'usage souvent quotidien ou hebdomadaire du shampooing, de la mousse à raser, de la toilette corporelle à la lessive, de la vaisselle à l'entretien des sols et des sanitaires… jusqu'à la lutte contre les pucerons sont la cible de produits « modernes » spécialisés. Peut-être par leurs grandes variétés et en conséquence notre méconnaissance toxicologique et écologique, ces produits sont discutables. L'impact écologique à long terme est accru par les productions gigantesques, les emballages et la pollution des eaux usées. Leur innocuité n'est pas nulle : risques de sensibilisation à de multiples allergies ou allergies dues à la multitude de composants nouveaux. Leur efficacité peut être mise en doute. Ainsi, pour la toilette corporelle, les produits « sans savon » se sont installés sur la croyance en l'effet déshydratant du savon alors que des savons, par exemple à la glycérine, respectent particulièrement bien l'épiderme.
Il est remarquable que dans ces produits standardisés et inévitables par le commerce de masse, le savon soit remplacé par le Laureth sulfate de sodium nommé sodium laureth sulfate dans les compositions, qui n'est pas sans inconvénients comme la rubrique de ce produit le mentionne.
Fabrication du savon
Les corps gras ou triester du glycérol, employés, se caractérisent en général par des chaînes aliphatiques de 8 à 19 atomes de carbones, après hydrogénation.
Principales matières grasses utilisées
Le tableau suivant liste les matières grasses qui sont le plus souvent utilisées lors de la fabrication des savons.
- par les différents acides gras attachés chimiquement aux trois fonctions alcool du glycérol
Molécules de savon selon l’acide gras
Acide gras nom IUPAC Dénomination Savon C12:0 Acide dodécanoïque Acide laurique Laurate de sodium / potassium C14:0 Acide tétradécanoïque Acide myristique Myristate de sodium / potassium C16:0 Acide hexadécanoïque Acide palmitique Palmitate de sodium / potassium C18:0 Acide octadécanoïque Acide stéarique Stéarate de sodium / potassium C18:1ω9 Acide cis-9-octadécénoïque Acide oléique Oléate de sodium / potassium - par type d'huile ou graisse :
matière grasse
(huile ou graisse)nom INCI
de la matière grassenom INCI
(valables pour l'Amérique du Nord)
du savon obtenu (1)acide gras dominant suif (graisse de bœuf) Adeps Bovis Sodium Tallowate acide cis-9-octadécénoïque saindoux (graisse de porc) Adeps Suillus Sodium Lardate acide cis-9-octadécénoïque huile d'arachide Arachis hypogaea Sodium Peanutate acide cis-9-octadécénoïque huile d'olive Olea europaea Sodium Olivate acide cis-9-octadécénoïque huile de coprah (noix de coco) Cocos nucifera Sodium Cocoate acide dodécanoïque huile de palme Elaeis guineensis Sodium Palmate acide hexadécanoïque huile de palmiste Elaeis guineensis Sodium Palm Kernelate (1) si le savon est un savon liquide fabriqué à base de potasse, il faut remplacer « sodium » par « potassium » dans les noms INCI.
Saponification des corps gras
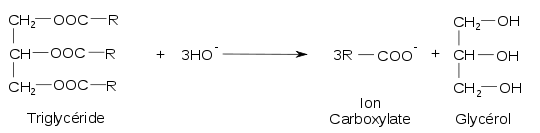
Le savon traditionnel ou industriel en cuve des maîtres savonniers est le produit d’une réaction chimique nommée saponification des corps gras. Cette transformation non inversable et lente est une des plus anciennes réactions chimiques connues et maîtrisées par l'humanité. C'est une simple hydrolyse alcaline au cours de laquelle un mélange de corps gras — graisses animales ou huiles végétales— est hydrolysé en milieu alcalin par une base forte, soit la potasse ou hydroxyde de potassium KOH soit la soude ou hydroxyde de sodium NaOH, à une température comprise entre 80 °C et 100 °C.
Article détaillé : Saponification.L’hydrolyse des corps gras produit du glycérol et surtout un mélange de carboxylates de sodium ou de potassium qui constituent les molécules du savon. Les savons fabriqués à partir de soude sont durs. Les savons fabriqués à partir de potasse sont mous ou liquides.
Fabrications industrielles
Fabrications et procédés industriels ont varié depuis les premières mises au point vers 1750. La fabrication en cuve est autrefois caractérisée par l'empâtage, le relargage, l'épinage, le lavage et séchage. Voici les étapes-types de la Belle Époque.
- l'empâtage consiste à mélanger les corps gras à la lessive de soude. Ici une solution de soude, faiblement alcaline, est chauffée à ébullition. Le corps gras végétal, c'est-à-dire l'huile d'olive, d'arachide, de coton, de palme, de noix de coco, de sésame ou le corps gras animal, suif ou huile de poisson, est ajouté par petites doses et souvent sous forme de mélange complexe selon le savon à obtenir. Notons qu'il reste dans la lessive de soude une quantité définie de vieilles solutions savonneuses, ou solutions mères soutirées d'une précédente saponification. Pour obtenir du savon mou on utiliera des huiles de colza, d'œillette ou de chenevis et de la potasse caustique (KOH).
- le relargage utilise des lessives concentrées puis des lessives salées qui permettent une meilleure séparation des sels alcalins d'acide gras, c'est-à-dire du savon formé qui est relargé et surnage en grumeaux.
- l'épinage, qui prend son nom de l'épine, robinet du bas de la cuve, consiste à soutirer l'eau salée et le glycérol, appelé glycérine.
- le lavage consiste à répéter l'ajout de solutions salines, pour emporter glycérol et lessives résiduelles. Le séchage permet d'obtenir des pains de savons secs et consistants.
Les deux étapes médianes ont parfois disparu au cours des années 1920 pour favoriser une épuration rapide et permettre une coulée à l'état liquide dans des bassins peu profonds, appelés mises où le savon se solidifie avant d'être débité en bandes, puis après séchage, marqué et débité en cubes.
Le nettoyage des matières grasses est souvent suivi au milieu du vingtième siècle d'hygrogénation des acides gras polyinsaturés, afin d'augmenter la compacité du savon produit. La saponification est conduite à haute pression et à 130 °C, par introduction d'une lessive de soude à 7% dans le corps gras fondu en présence de solution-mère de savon. Le savon formé est séparé avec une solution saline, qui emmène le glycérol et sur laquelle il surnage.
Depuis les années 1970, l'hydrolyse des graisses par de l'eau sous pression et à haute température, en présence de savon de zinc faisant office de catalyseur, donne en continu acide gras et glycérol, immédiatement séparés par distillation. L'acide gras est neutralisé par la soude et donne le savon.
L'acide gras, produit intermédiaire, est la base d'une chimie, bien plus diversifiée que dans les anciennes savonneries. Il peut être converti en sels d'ammonium quaternaire, savons cationiques utilisés comme liquide antiseptiques. Ainsi le chlorure de N,N,N triméthyl-octadécyl-ammonium.
Composition des savons commerciaux
Les matières premières pour fabriquer du savon sont les matières grasses et la soude, éventuellement la potasse. Un savon bien fini ne contient ni soude ni huile. Les savons sont principalement différents carboxylates de sodium, molécules de savon. Ils contiennent aussi de l'eau et des addititifs variés.
La glycérine ou glycérol est un sous-produit de la saponification que l'on peut éliminer. Mais elle est laissée ou rajoutée parfois au savon car elle apporte des propriétés hydratantes.
Additifs
À la recette de base, on peut ajouter différents additifs selon l'effet recherché :
- des agents anticalcaires, pour réduire la sensibilité des savons à précipiter en eau dure, c'est-à-dire chargée en sels d'alcalino-terreux ;
- des conservateurs ;
- des colorants ;
- des parfums ;
- des agents surgraissants (huiles) pour fabriquer un savon surgras ;
- des agents hydratants comme le miel ;
- des abrasifs pour fabriquer un savon exfoliant ;
- des huiles essentielles extraites de plantes ;
- des substances aux propriétés antiseptiques , notammentantibactériennes , ou antifongiques ;
Sous sa forme la plus simple, le savon est un produit détergent totalement biodégradable. Les additifs peuvent être polluants pour l'environnement.
Types de savon
Un savon d'Alep.
Le savon commercial se présente sous forme de bloc (pain, cube, formes ovalisées...), de poudre, de paillettes fines (lessives), de mousses, de gels ou de solutions, comme le savon liquide.
L'art savonnier distingue, plus ou moins indifféremment :
- suivant la provenance géographique d'origine ou la couleur :
- le savon Azul e Branco est fabriqué au Portugal ; il est bleu et blanc-jaunâtre ;
- le savon d'Alep, le plus ancien savon syrien, est à base d'huile d'olive et d'huile de baies de laurier ;
- le savon de Marseille traditionnel est préparé avec de l'huile d'olive et de la soude, il contient aussi de l'huile de coprah et de l'huile de palme. Il comporte au moins l'équivalent de 61-63 % d'acides gras ;
- le savon blanc, comme le banal savon de Marseille ou un savon de toilette ;
- le savon marbré comporte des lignes de savons ferreux non déposées, c'est-à-dire des carboxylates de fer précipités dans la masse du savon formé. Les fines marbrures sont vertes.
- suivant l'usage :
- une savonnette ou savon de toilette est un petit pain dur de savon d'aspect agréable, parfumé, coloré et neutralisée. A l'instar des savons ou mousses à raser, les savons de toilettes sont préparés à partir de suif et de noix de coco et contiennent les plus hautes teneurs en sel d'acides gras, supérieures à 76 ou 78 %. Cette composition élaborée — lavage soigné éliminant toutes traces d'alcali, présence de colorant, parfum, bactéricide, fongicide ou autres additifs pour une action au contact de la peau... — le destine en premier lieu à la toilette ou l'hygiène du corps ;
- le savon de ménage, autrefois pour le nettoyage domestique.
- le savon ponce est un savon à décrasser dans lequel il entre une charge minérale, sous forme de pierre ponce pulvérisée ;
- un savon surgras est enrichi en agents (sur)graissants, par exemple des huiles végétales ; la présence d'huiles limite le dessèchement dû au savon qui enlève le film gras (film hydrolipidique) recouvrant naturellement la peau ;
- un savon médical était autrefois un savon de Marseille surgras, avec apports antiseptiques tels que le soufre, le phénol, l'ichtyol, le formaldéhyde, le sublimé de naphtol ou de salol, des goudrons ou du bois de Panama ;
- un savon médicinal est un mélange de lessives de savonniers, avec des huiles d'amandes douces. Il était employé comme excipient dans la fabrication de pilules, ou prescrit comme laxatif ;
- le savon dentifrice est un savon additionné de glycérol (glycérine) et de substances aromatiques, pour les soins de la bouche ;
- suivant l'aspect ou la composition :
- le savon liquide à la potasse était préparé à partir d'huile de ricin et de noix de palmier. Il a la plus faible teneur équivalente en acides gras : 15 à 20 % en masse ;
- le savon noir ou savon mou est un savon plus ou moins mou. La saponification est faite traditionnellemnt avec de l'huile de lin. Sa couleur est naturellement ambré sombre. On n'y ajoute pas de colorant. Il affiche une teneur équivalente en acides gras de l'ordre de 38 % en masse. Il était recommandé pour le nettoyage des carrelages ; il existe aussi du savon noir pour le corps ;
- le savon animal est obtenu avec la lessive des savonniers et des graisses animales, souvent du suif de bœuf ;
- le savon transparent est obtenu par dissolution d'un savon de suif dans de l'alcool à chaud, puis refroidissement lent et coulage. Il s'appelle savon de glycérine lorsque l'alcool est le glycérol, nom actuel de la glycérine ;
- le savon à raser ou mousse à raser, décrit ci-dessus avec le savon de toilette.
Mythes et réalités du savon humain
- Tyler Durden, dans le livre et le film Fight Club utilise de la graisse humaine pour fabriquer des savons de haute qualité.
- Après la Seconde Guerre mondiale, une rumeur prétendait que les Nazis fabriquaient du savon à partir de graisse humaine provenant des camps de concentration. Le tribunal de Nuremberg a permis d'éclaircir cette légende qui reste tenace : les cendres des victimes furent l'objet de diverses expérimentations dont des tentatives pour fabriquer du savon de manière industrielle (à Danzig en 1944). Mais rien n'a corroboré la thèse d'une production massive de savon par un tel procédé[2].
Autres savons dénommés par analogie
La pratique que des puristes peuvent stigmatiser en abus de langage dénomme pourtant d'autres savons depuis des temps fort anciens ou récents, recourant à l'analogie d'emploi, de fonction ou d'action sur la matière et les surfaces.
- un savon sans savon, comme son nom l'indique, ne contient pas de molécules de savon. Appelé aussi pain dermatologique ou syndet (pour synthetic detergent), il est à base de tensioactifs synthétiques. Son pH est proche du pH de la peau ;
- les savons antiseptiques, à base d'iode par exemple, ou antifongiques sont utilisés pour des soins particuliers de dermatologie. Ceux-ci ne contiennent pas de molécules de savon et sont pour la plupart des détergents cationiques ;
- le savon blanc de montagne ou oropion est une variété d'argiles déposées dans les eaux thermales ;
- le savon des verriers désigne le dioxyde de manganèse MnO2 employé pour décolorer le verre dans les creusets de fusion.
Notes et références
- ↑ Etymologiquement, il semble que ce soit la cité des gaulois, autre nom des Phocéens en Méditerranée orientale.
- ↑ Le savon humain : rumeur, réalité et histoire
- Portail de la chimie
Catégories : Sel | Produit chimique domestique | Cosmétique | Tensioactif | Soin du corps
Wikimedia Foundation. 2010.