- HCHO
-
Méthanal
Méthanal 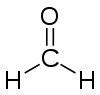
Représentation du méthanal Général Nom IUPAC Méthanal Synonymes formaldéhyde
aldéhyde formique
formolNo CAS No EINECS PubChem No E E240 SMILES InChI Apparence gaz, d'odeur caractéristique.
ou liquide incolore. (solution)[1]Propriétés chimiques Formule brute CH2O [Isomères] Masse molaire 30,026 g∙mol-1
C 40 %, H 6,71 %, O 53,29 %,pKa 13.27 à 25°C[2] Propriétés physiques T° fusion -92 °C[1] T° ébullition -19,5 °C[2];
98 °C (solution à 37%)[1]Solubilité 4,00.105 mg/L (eau, 20°C);
Sol. dans l'alcool, l'éther, l'acétone, le benzène[2]Masse volumique (eau = 1) : 0.8[1] T° d’auto-inflammation 430 °C[1] Point d’éclair 53 °C Limites d’explosivité dans l’air en volume % dans l'air : 7-73[1] Pression de vapeur saturante 52 mmHg ( 37 °C) Point critique 137,2 à 141,2 °C
6,784-6,637 MPa[2]Thermochimie S0gaz, 1 bar 218,8 J/mol·K ΔfH0gaz -108,6 kJ/mol Cp 35,4 J/mol.K Propriétés optiques Indice de réfraction 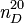 1,3746 (en solution)[2]
1,3746 (en solution)[2]Spectre d’absorption absorption max (gaz):
155.5nm (LOG E=4.37);
175nm (LOG E=4.26)[2]Précautions Directive 67/548/EEC[4] 
T
CPhrases R : 23/24/25, 34, 40, 43, Phrases S : 1/2, 26, 36/37/39, 45, 51, Transport[5] 80 2209
38 1198 SIMDUT[6] 


SGH[7] 


DangerClassification du CIRC Groupe 1 : Cancérogène pour l'homme[3] Inhalation Potentiellement létal Yeux Irritant Écotoxicologie DL50 100 mg/kg (rats, oral)
220,1 mg/kg (lapins, dermal)Valeur d'exposition 0,3 ml/m³; 0,37 mg/m³ LogP 0,35 [2] Unités du SI & CNTP, sauf indication contraire. Le méthanal ou formaldéhyde ou aldéhyde formique ou formol est un composé organique de la famille des aldéhydes, de formule chimique CH2O. C'est d'ailleurs le plus simple des composés de cette famille. À température ambiante, c'est un gaz inflammable. Il fut synthétisé pour la première fois par le Russe Aleksandr Butlerov en 1859 mais fut formellement identifié par August Wilhelm von Hofmann en 1867. Le terme formol est généralement réservé à ses solutions aqueuses.
On trouve du méthanal dans les produits d'une combustion incomplète de substances contenant du carbone. Il y en a dans la fumée des feux de forêt, dans les rejets des automobiles, et dans la fumée du tabac. Le méthanal est aussi produit dans l'atmosphère sous l'action des rayons solaires et du dioxygène sur le méthane atmosphérique ainsi que sur d'autres hydrocarbures. De petites quantités de méthanal sont produites par le métabolisme de la plupart des organismes, dont l'organisme humain.
Sommaire
Propriétés
Bien que le méthanal soit un gaz à température ambiante, il est très soluble dans l'eau, dans laquelle il forme une solution de formol. Le méthanal polymérise dans l'eau, ce qui fait que le formol contient peu de méthanal sous forme de monomères. Le méthanal polymérise sous forme de polyoxométhylène (appelé paraformaldéhyde ; succession de groupements -O-CH2-) ou de trioxane (trimère cyclique). La dépolymérisation est possible par distillation en présence de traces acides. Généralement, le formol vendu dans le commerce contient aussi du méthanol pour limiter la polymérisation du méthanal.
Le méthanal possède la plupart des propriétés chimiques des aldéhydes, mis à part le fait qu'il soit plus réactif. De plus, il est remarquablement électrophile, et peut réagir par substitution électrophile aromatique avec les composés aromatiques ou par addition électrophile sur les alcènes. En présence d'un catalyseur basique, le méthanal subit une réaction de Cannizzaro et se transforme en acide formique et en méthanol.
Enfin, le méthanal est facilement oxydé par le dioxygène de l'air pour former de l'acide formique. C'est pourquoi il faut conserver le méthanal dans des récipients bien étanches.
Production
Le méthanal est produit industriellement par l'oxydation catalytique du méthanol. Les catalyseurs les plus employés sont l'argent métallique, ou un mélange d'oxyde de fer, de molybdène et de vanadium. Dans ce cas, le méthanol et le dioxygène réagissent à 400 °C selon l'équation :
CH3OH + ½ O2 → H2CO + H2O
La catalyse à base d'argent réagit à des températures plus hautes, de l'ordre de 650 °C. Deux réactions produisent alors simultanément du méthanal : l'équation ci-dessus, et l'équation de déshydrogénation ci-dessous.
CH3OH → H2CO + H2
L'oxydation prolongée du méthanal conduit à la formation d'acide formique, que l'on trouve en faible concentration dans les solutions industrielles de méthanal. À une échelle réduite, le formol peut être produit grâce à diverses réactions comme la conversion de l'éthanol.
Le méthanal peut également être produit lors de l'ozonolyse d'un alcène terminal.
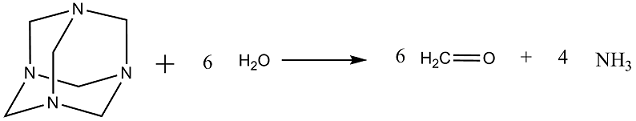
On peut également produire le formaldéhyde en ajoutant de l'hexaméthylènetétramine au milieu réactionnel suivant la réaction :
Utilisation
Le méthanal tue la plupart des bactéries, c'est pourquoi on utilise le formol comme désinfectant, notamment en médecine vétérinaire (pédiluves de désinfection), ou pour conserver des cadavres d'animaux ou d'humains. Il est aussi utilisé comme conservateur dans les vaccins. En médecine, on l'emploie localement pour assécher la peau, comme dans le traitement des verrues. Les solutions de méthanal sont aussi employées pour embaumer les corps en attente d'un enterrement.
La plus importante quantité de méthanal est cependant employée pour la production de polymères et de produits chimiques. Combiné au phénol, à l'urée ou à la mélamine, le méthanal forme une résine thermodurcissante. Ces résines sont souvent utilisées dans les colles permanentes, comme celles utilisées dans la fabrication d'aggloméré, de contreplaqué ou de tapis, ou bien pour former des mousses synthétiques. La production de résines à base de méthanal représente plus de la moitié de la consommation de celui-ci.
On emploie le méthanal pour produire de nombreux autres produits chimiques, dont la plupart sont des polyols comme le pentaerythritol, utilisé dans la fabrication de peintures et d'explosifs. On compte aussi d'autres dérivés du méthanal comme le méthylène diphényle diisocyanate, un constituant important des peintures et des mousses de polyuréthane, ainsi que l'hexaméthylène tétramine, utilisé dans les résines phénol-méthanal et pour fabriquer du RDX (un explosif).
Le formol est aussi utilisé en biologie pour la conservation d'échantillons ou de prélèvements dans la cadre d'analyses IBGN, IBMR ou IOBS.
En dentisterie, le formol est incorporé sous forme directe (formaldéhyde) ou dérivée (paraformaldéhyde, polyoxyméthylène) dans un grand nombre de spécialités destinées à obturer les canaux des dents dévitalisées. Contrairement aux médicaments, les produits et matériaux employés en art dentaire ne sont pas soumis à une autorisation de mise sur le marché, ce qui explique qu'ils échappent à la réglementation ci-dessous.
Sur le plan de la réglementation des produits phytopharmaceutiques, sous le nom de formaldéhyde :
- pour l’Union européenne : cette substance active est interdite par la décision 2007/442/CE à la suite de l'examen relatif à l'inscription à l’annexe I de la directive 91/414/CEE[8].
- pour la France : cette substance active n'est pas autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché. Les produits contenant du formaldéhyde ont un délai à la distribution fixé au 30 juin 2008, et un délai à l'utilisation fixé au 20 décembre 2008, par l'avis paru au Journal officiel du 31 octobre 2007.
Production artisanale
Le méthanal est obtenu à partir de la formaline, solution aqueuse dans lequel le méthanal est dissous à 37 % en masse. Le méthanal se dégage avec l'ajout de permanganate de potassium (KMnO4) dans les proportions de 1 g de permanganate pour 2 ml de formaline. La chaleur générée par ce mélange est importante.
Cette méthode est utilisée par les aviculteurs pour les fumigations d'œufs.
Santé
Le formaldéhyde a été classé comme « cancérogène certain » par le Centre international de recherche sur le cancer (CIRC), qui dépend de l'Organisation mondiale de la santé (OMS). Jusqu'alors, il n'était considéré que comme « cancérogène probable ». Il est à l'origine de cancers du nasopharynx. Son implication dans les cancer des fosses nasales et des sinus est envisagée mais des biais de confusion présents dans les études en milieu professionnel ne permettent pas de pouvoir conclure[9]. En effet, les travailleurs exposés étaient en général exposés à un grand nombre de polluants potentiellement cancérogènes (poussières de bois dans l'industrie du bois – responsable de cancer des fosses nasales –, benzène – responsable de leucémies –, et d'autres aldéhydes comme l'acétaldéhyde) ; le rôle propre du formaldéhyde dans ces cancers est donc difficilement mis en évidence[10]. Enfin son implication dans la survenue de leucémies est fortement suspectée[10].
Le formaldéhyde est employé dans nombre de matériaux synthétiques ; or ceux-ci relarguent au cours du temps des quantités non négligeables de formaldéhyde. Il s'agit d'un des polluants les plus répandus de l'air intérieur des habitations. Au-dessus d'une concentration de 0,1 mg/kg dans l'air, il peut irriter les yeux et les muqueuses, causant des conjonctivites, des maux de tête et des difficultés à respirer accompagnées de douleurs dans la gorge.
Des expositions importantes au méthanal, comme l'absorption de formol sont mortelles. Le méthanal se transforme en acide formique dans le corps, augmentant ainsi l'acidité sanguine, provoquant une respiration saccadée, de l'hypothermie, puis le coma, voire la mort. En cas d'ingestion de méthanal, il faut aller consulter aussitôt un médecin[réf. nécessaire].
Les animaux de laboratoire soumis à d'importantes doses de méthanal durant leur vie voient le risque de cancer du nez et de la gorge augmenter. Toutefois, certaines études suggèrent que les concentrations de méthanal dans les bâtiments n'ont pas d'effet cancérogène : en effet, le potentiel cancérogène du formaldéhyde, à seuil, ne s'exprime que pour de très importantes concentrations (supérieures à 5 mg/m3), concentrations qui ne sont retrouvées qu'en milieu professionnel[11]. Dans l'habitat, les concentrations sont nettement plus faibles, avec, en France par exemple une moyenne proche des 20 µg/m3 soit 250 fois plus faible[12],[13]
En dentisterie, les quantités faibles incorporées aux pâtes canalaires peuvent néanmoins provoquer des réactions allergiques. Des cas d'urticaire et de réactions allergiques fortes allant jusqu'à l'œdème de Quincke, survenant dans les heures suivant l'introduction de la pâte dans les canaux dentaires, sont rapportées dans la littérature[14].
Santé au travail
Le formaldéhyde est principalement utilisé dans la production de colles qui entrent dans la fabrication de panneaux agglomérés, de contreplaqués, de meubles et d’autres produits du bois. On emploie également le formaldéhyde dans la fabrication de diverses matières plastiques, de certains fertilisants, de résines utilisées dans les moules de fonderie en sable, ainsi que de certaines peintures et vernis. L’industrie du textile fait appel à ces résines comme apprêts pour rendre les tissus infroissables. Il sert également à la synthèse d’autres produits chimiques. Enfin, on a recours au formaldéhyde pour ses propriétés bactéricides dans de nombreuses formulations de produits désinfectants, de cosmétiques, de liquides d’embaumement et de solutions de conservation de tissus biologiques.
L’exposition professionnelle au formaldéhyde par inhalation provient principalement de trois types de sources : la décomposition thermique ou chimique des résines à base de formaldéhyde, l’émission de formaldéhyde attribuable aux solutions aqueuses (par exemple, les liquides d’embaumement), ou la formation de formaldéhyde résultant de la combustion d’une variété de composés organiques (par exemple, les gaz d’échappement). En milieu de travail, l’exposition au formaldéhyde se produit par différentes voies. Le formaldéhyde gazeux est absorbé par les voies respiratoires et lorsqu’en solution aqueuse, par contact cutané. Les effets sur la santé associés à une exposition à cette substance varient selon la voie d’exposition et la concentration ou dose absorbée.
Dans des situations extrêmes comme des accidents, il est possible que le formaldéhyde soit présent dans l’air en fortes concentrations, ce qui représente un danger immédiat considérable. Des concentrations égales ou supérieures à 20 ppm peuvent induire des œdèmes pulmonaires graves et éventuellement causer la mort. Dans le cas d’un contact direct avec la peau, le formaldéhyde peut entraîner des lésions cutanées telles que des irritations, des dermites de contact irritatives et des dermites de contact allergiques. Les symptômes se traduisent par des démangeaisons, des picotements et des rougeurs. Une sensibilisation cutanée est susceptible d’apparaître après un contact avec des solutions aqueuses de formaldéhyde de concentration égale ou supérieure à 2 %, ou encore, des solides ou des résines contenant du formaldéhyde libre. Lorsqu’une personne est sensibilisée, les manifestations de l’allergie cutanée (érythème) risquent de se produire à chaque contact avec des solutions de concentrations de plus en plus faibles (à partir de 0,5 % de formaldéhyde). Ces effets sont facilement évitables en protégeant les régions de la peau exposées, par exemple, en portant des gants.
Alimentation
Le formaldéhyde est aussi repris dans l'alimentation humaine, sous E240.
Liens externes
- INRS : (fr) [pdf]} Dossier | Fiche toxicologique.
- Fiche internationale de sécurité (solution à 37%)
- Quelques guides et rapports sur le site www.irsst.qc.ca: [1], [2], [3], [4] et [5].
- Réactions allergiques au formaldéhyde en dentisterie
- ChemSub Online : Formaldéhyde
Notes et références
- ↑ a , b , c , d , e et f FORMALDEHYDE et FORMALDEHYDE (SOLUTION A 37%, sans méthanol), fiches de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultées le 9 mai 2009
- ↑ a , b , c , d , e , f et g Hazardous Substances Data Bank sur http://toxnet.nlm.nih.gov. Consulté le 17 septembre 2009
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme » sur http://monographs.iarc.fr, 16 janvier 2009, CIRC. Consulté le 22 août 2009
- ↑ « Formaldéhyde » sur ESIS, consulté le 17 février 2009
- ↑ Entrée de « Formaldehyde solution » dans la base de données de produits chimiques GESTIS de la BGIA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 septembre 2009 (JavaScript nécessaire)
- ↑ « Formaldéhyde » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- ↑ 2007/442/CE: Décision de la Commission du 21 juin 2007 concernant la non-inscription de certaines substances actives à l’annexe I de la directive 91/414/CEE du Conseil et le retrait des autorisations de produits phytopharmaceutiques contenant ces substances [notifiée sous le numéro C(2007) 2576], Journal officiel n° L 166 du 28/06/2007 p. 0016 - 0023.
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. « Formaldehyde, 2-butoxyethanol and 1-tert-butoxypropan-2-ol », IARC Monogr Eval Carcinog Risks Hum. 2006;88:1-478.
- ↑ a et b Cogliano VJ, Grosse Y, Baan RA, Straif K, Secretan MB, El Ghissassi F; Working Group for Volume 88. « Meeting report: summary of IARC monographs on formaldehyde, 2-butoxyethanol, and 1-tert-butoxy-2-propanol », Environ Health Perspect, 2005 Sep;113(9):1205-8.
- ↑ [pdf] « Toxicological Assessment of Formaldehyde », Opinion of BfR No. 023/2006, 30 mars 2006
- ↑ Dassonville C, Demattei C, Laurent AM, Le Moullec Y, Seta N, Momas I. « Assessment and predictor determination of indoor aldehyde levels in Paris newborn babies' homes », Indoor Air. 2009 Aug;19(4):314-23. Epub 2009 Jan 19.
- ↑ [pdf] Rapport final de l'Observatoire de la qualité de l'air intérieur, novembre 2006.
- ↑ Bibliographie : pâtes d'obturation canalaire contenant du formaldéhyde - 1
- Portail de la chimie
Catégories : Produit chimique toxique | Produit chimique corrosif | Aldéhyde | Cancérogène chimique
Wikimedia Foundation. 2010.