- E300
-
Acide ascorbique
Acide ascorbique 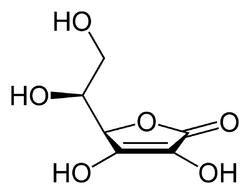
Structure de l’acide ascorbique Général Nom IUPAC (5R)-5-[(1S)-1,2-dihydroxyéthyl]
3,4-dihydroxyfuran-2(5H)-oneSynonymes Vitamine C
Acide L-xyloascorbique.No CAS (R,S) ou L(+) No EINECS Code ATC A11 DrugBank PubChem No E E300 FEMA SMILES InChI Apparence cristaux sans odeur blancs à légèrement jaunes ou poudre.[1] Propriétés chimiques Formule brute C6H8O6 [Isomères] Masse molaire 176,1241 g∙mol-1
C 40,92 %, H 4,58 %, O 54,5 %,Propriétés physiques T° fusion 190 à 192 °C (décomposition)[1] Solubilité dans l'eau : 33 g/100 ml[1],
40 g/100 ml (45 °C),
Insoluble dans éther, chloroforme, benzene, éther de pétrole, huiles, gras, solvents gras[2]
80 g/100 ml (100 °C);
1g se dissout dans
30 ml alcool,
50 ml alcool absolu,
100 ml glycérol,
20 ml propylène glycol;Masse volumique 1,65[1] Propriétés optiques Pouvoir rotatoire 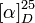 +20,5 à +21,5° (c = 1 dans H2O)[2];
+20,5 à +21,5° (c = 1 dans H2O)[2];
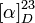 +48° (c = 1 dans méthanol)[2].
+48° (c = 1 dans méthanol)[2].Précautions Directive 67/548/EEC Phrases S : 24/25, SIMDUT[3] Produit non contrôlé Inhalation Toux. Mal de gorge. Peau Rougeur. Yeux Rougeur. Douleur. Écotoxicologie DL50 3367 mg/kg (souris, oral)
518 mg/kg (souris, i.v.)
> 10000 mg/kg (rat, s.c.)
643 mg/kg (souris, i.p.)[4]LogP -2.15[1] DJA 1050 mg pour une personne de 70kg[5] Données pharmacocinétiques Demi-vie d’élim. 13 - 40 jours (humains),
3 jours (cochons d'inde)[5]Unités du SI & CNTP, sauf indication contraire. L’acide ascorbique est un acide organique ayant des propriétés antioxydantes. On le trouve dans les citrons, les jus de fruits et les légumes frais.
Du fait de son activité antioxydante, il est utilisé comme conservateur alimentaire sous le code européen E300 de la liste des additifs alimentaires. C’est un additif pour adapter la pâte à pain au pétrissage intensif.
Il existe deux acides ascorbiques ayant la même formule chimique mais une disposition spatiale différente. Le composé lévogyre est naturel et appelé vitamine C, ou acide oxo-3 L-gulofuranolactone. L’autre composé est qualifié de dextrogyre.
Les sels, appelés ascorbates, possèdent les mêmes propriétés physiologiques et sont donc inclus dans la dénomination Vitamine C.
Le nom ascorbique vient du préfixe grec a (privatif) et scorbut, signifiant littéralement anti-scorbut.
Il se présente sous la forme d’une poudre cristalline blanche ou incolore, se colorant par exposition à l’air et à l’humidité, facilement soluble dans l’eau et dans l’alcool. La poudre sèche est stable à l’air.
Sommaire
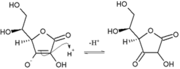
Tautomérisme
L’acide ascorbique est la plupart du temps sous sa forme stable "énolique". Néanmoins il peut se convertir rapidement en une hydroxy-cétone par transfert de proton. Il y a deux formes possibles d'hydroxycétone
Acide ascorbique et vin
On utilise l’acide ascorbique dans le vin pour son pouvoir réducteur ; en effet, en milieu acide, il fixe l’oxygène dissous, à la température ordinaire, en formant l’acide déhydro-ascorbique. Il permet d’une part d’économiser une petite quantité d’anhydrides sulfureux libre pour éviter l’oxydation des vins et de plus, il a des applications pratiques intéressantes en protégeant le vin de la casse ferrique lors du dernier stade, la mise en bouteille.
Liens externes
- (fr)+(de) Études de l’oxydation et la réduction de l’acide ascorbique et de l’acide déhydroascorbique (système rédox) ainsi que la saponification hydrolytique de l’acide déhydroascorbique à l’acide diketogulonique Dissertation inaugurale Giessen 1992
- (fr) Fiche sur reptox
- (fr) Fiches Internationales de Sécurité Chimique ICSC: 0379 ACIDE ASCORBIQUE NIOSH
Références
- ↑ a , b , c , d et e ACIDE ASCORBIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ a , b et c Merck Index, Thirteenth Edition, 837
- ↑ « Acide ascorbique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ (en) « Ascorbic acid » sur ChemIDplus, consulté le 9 août 2009
- ↑ a et b (en) Volker Kuellmer, Kirk-Othmer encyclopedia of chemical technology 4th ed. : Ascorbic acid, vol. 25, John Wiley & Sons., 1991
- Portail de la médecine
- Portail de la chimie
Catégories : Vitamine | Antioxydant alimentaire | Ose acide | Polyol
Wikimedia Foundation. 2010.