- Acétate d'éthyle
-
Acétate d'éthyle 
Représentations plane et 3D de l'acétate d'éthyle Général Nom IUPAC Acétate d'éthyle Synonymes acétate éthylique
éthanoate d'éthyle
éther acétiqueNo CAS No EINECS PubChem No E E1504 FEMA SMILES InChI Apparence liquide incolore, d'odeur caractéristique[1]. Propriétés chimiques Formule brute C4H8O2 [Isomères] Masse molaire[4] 88,1051 ± 0,0044 g·mol-1
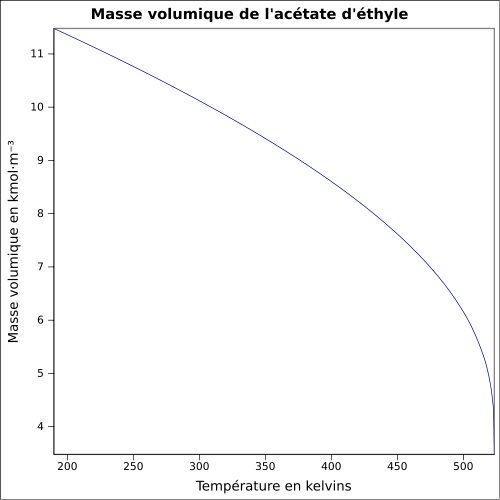
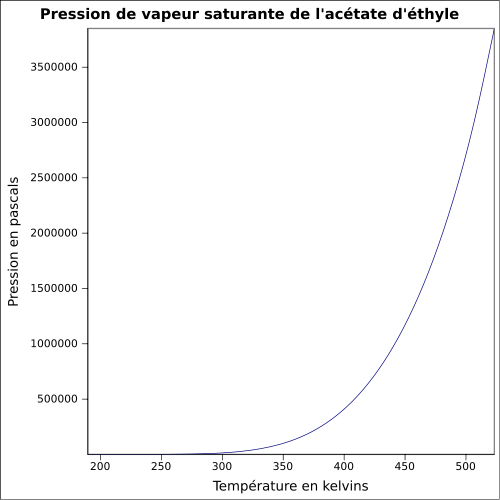
C 54,53 %, H 9,15 %, O 36,32 %,pKa 0,3 Moment dipolaire 1,78 ± 0,09 D [2] Diamètre moléculaire 0,539 nm [3] Propriétés physiques T° fusion -83,6 °C (189,55 K)[5] T° ébullition 77,1 °C (350,25 K)[5] Solubilité 83 g·l-1 (eau, 20 °C), bonne dans l'acétone, les alcools et l'éther Masse volumique 0,9245 g·cm-3 [6] T° d'auto-inflammation 427 °C[1] Point d’éclair -4 °C (coupelle fermée)[1] Limites d’explosivité dans l’air 2,2–11,5 %vol[1] Pression de vapeur saturante à 20 °C : 10 kPa[1] Viscosité dynamique 0,421 mPa·s à 25 °C [8] Point critique 250,15 °C, 3,88 MPa, 0,286 l·mol-1[9] Thermochimie Cp Propriétés électroniques 1re énergie d'ionisation 10,01 ± 0,05 eV (gaz)[11] Propriétés optiques Indice de réfraction  1,3698 [3]
1,3698 [3]Précautions Directive 67/548/EEC 
Xi
FPhrases R : 11, 36, 66, 67, Phrases S : (2), 16, 26, 33, Transport 33 1173 NFPA 704 SIMDUT[12] 
SGH[13] 

DangerÉcotoxicologie DL50 5,62 g·kg-1 (rats, oral)[5]
5,62 g·kg-1 (rats, oral)[5]
4,1 g·kg-1 (souris, oral)[5]CL50 200 g·m-3 (rats, inhalation)[5] LogP 0,73[1] Seuil de l’odorat bas : 6,4 ppm
haut : 50 ppm[14]Composés apparentés Isomère(s) acide butanoïque, 3-hydroxybutanone Autres composés CH3COOH Unités du SI & CNTP, sauf indication contraire. L'acétate d'éthyle (éthanoate d'éthyle) est un liquide, à l'odeur caractéristique du dissolvant de vernis à ongles. C'est un ester résultant de l'éthanol et de l'acide acétique utilisé principalement comme solvant. On le trouve, à l'état naturel, en faibles quantités dans le rhum et dans les raisins endommagés par la grêle.
Sommaire
Propriétés chimiques
Généralités
L'acétate d'éthyle est un solvant de polarité moyenne, peu toxique[15] et non hygroscopique, qui possède une grande volatilité. C'est un accepteur faible en raison de liaisons hydrogène. Il peut dissoudre jusqu'à 3% d'eau et possède une solubilité dans l'eau de 8% à température normale. Cette solubilité augmente avec la température. Il est instable au contact de bases et d'acides forts en présence desquels il est hydrolysé en acide acétique (acide éthanoïque) et éthanol.
Il est rarement utilisé comme solvant pour une réaction chimique en raison de sa réactivité avec les bases et les acides.
Tautomérie
Comme tous les composés comportant un carbonyle, l'acétate d'éthyle présente une mobilité du proton (H+) situé sur le carbone voisin du carbonyle. Cependant, celle-ci est bien plus faible que dans le cas des aldéhydes ou des cétones. Aussi la forme énolique est-elle indétectable.
Cependant, en présence d'une base très forte comme l'ion éthanolate, l'énolate (base conjuguée de l'énol) existe à l'équilibre et donne lieu à la condensation de Claisen :
2 CH3 - CO - O - C2H5 → CH3 - CO - CH2 - CO -O - C2H5 + C2H5 - OH
Le composé obtenu est l'acétylacétate d'éthyle dont le nom officiel est le 3-oxobutanoate d'éthyle.
Saponification
La réaction de saponification de l’acétate d’éthyle est une réaction dont la vitesse suit une loi du deuxième ordre :
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
L’additon d’un des constituants engendre un déplacement d’équilibre dans le sens qui correspond à la disparition de ce constituant (loi de Le Chatelier). L’élimination d’un des constituants déplace l’équilibre dans le sens qui correspond à l’apparition de ce constituant. L’élimination de l’eau déplace l’équilibre dans le sens de formation de celle-ci, c’est-à-dire dans le sens de la formation d’acétate d’éthyle. En éliminant l’eau au fur et à mesure de sa formation, on peut rendre la réaction d’estérification totale.
Aigreur des vins
L'acétate d'éthyle est présent dans le vin. Le piquage des vins ne doit pas être attribué à l'acide acétique mais à la présence d’un excès d’acétate d’éthyle. Cet ester est formé par les levures et surtout par les bactéries acétiques, dans des proportions très variables qui dépendent des espèces et des conditions de milieu et de température. L’addition d’acide acétique au vin ne reproduit pas vraiment l’acescence, bien qu’à dose suffisante il donne une odeur et surtout un goût aigre.
Utilisations
L'acétate d'éthyle est employé dans les domaines suivants:
- solvant pour enlever le vernis à ongles.
- solvant pour colles dangereux à 'sniffer' car il entraîne une sensation d'enivrement qui peut endommager le cerveau.
- solvant de la nitrocellulose.
- produit pour décaféiner les grains de café et les feuilles de thé.
- solvant pour chromatographie en mélange avec un solvant non polaire comme l'hexane.
- solvant pour extractions (antibiotiques).
- parfums et essences à odeurs fruitées (en raison de sa grande vitesse d'évaporation laissant la trace du parfum sur la peau).
- composant d'arôme fruité (fraise).
- agent de saveur pour pâtisserie, crèmes glacées et gâteaux, limonade.
- accélérateur de prise pour peintures et vernis.
- entomologie: conservation des insectes.
Synthèse
L'acétate d'éthyle est synthétisé par le procédé d'estérification de Fischer, résultant d'une réaction entre l'acide acétique et l'éthanol. Un acide, tel l'acide sulfurique, catalyse la réaction.
- CH3CH2OH + CH3COOH → CH3COOCH2CH3 + H2O
Étant donné que cette réaction est réversible et engendre un équilibre chimique, le rendement est faible à moins que l'eau soit éliminée. En laboratoire, l'acétate d'éthyle peut être séparé de l'eau en utilisant le procédé de Dean-Stark.
Notes et références
- ACETATE D'ETHYLE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 16 juin 2008, 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, 1999, 239 p. (ISBN 0-471-98369-1)
- Masse molaire calculée d’après Atomic weights of the elements 2007 sur www.chem.qmul.ac.uk.
- (en) ChemIDplus, « Ethyl acetate - RN: 141-78-6 » sur chem.sis.nlm.nih.gov, U.S. National Library of Medicine. Consulté le 23/07/2008.
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, 2005, 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, 1997, 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Hiannie Djojoputro et Suryadi Ismadji, « Density and Viscosity Correlation for Several Common Fragrance and Flavor Esters », dans Journal of Chemical & Engineering Data, vol. 50, no 2, 2005, p. 727-731 [lien DOI (page consultée le 31 juillet 2010)]
- (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », dans Chinese Journal of Chemical Engineering, vol. 17, no 2, avril 2009, p. 259-267 [lien DOI (page consultée le 25 janvier 2010)]
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co. (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, CRC, 2008, 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- « Acétate d’éthyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Ethyl acetate sur hazmap.nlm.nih.gov. Consulté le 14 novembre 2009
- Document de l'INRS
Voir aussi
Articles connexes
Liens externes
- Acétate d'éthyle (CSST)
- (en) Material safety data (MSDS) for ethyl acetate
- (en) National Pollutant Inventory - Ethyl acetate fact sheet
- (en) Ethyl Acetate: Molecule of the Month
- (en) Purpose of Using Concentrated Sulfuric Acid in Esterification for Catalysis
Bibliographie
- Hans Breuer(2000). 'Atlas de la chimie'. Le livre de poche. Encyclopédies d'aujourd'hui -ISBN 978-2-253-13022-2
- Portail de la chimie
- Portail des odeurs, des senteurs et du parfum
Wikimedia Foundation. 2010.