- Acide Butanoïque
-
Acide butanoïque
Acide butanoïque 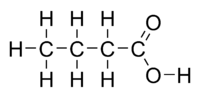
Général Nom IUPAC acide butanoïque Synonymes acide butyrique
Acide éthylacétiqueNo CAS No EINECS DrugBank PubChem FEMA SMILES InChI Apparence liquide incolore, huileux, d'odeur caractéristique.[1] Propriétés chimiques Formule brute C4H8O2 [Isomères] Masse molaire 88,1051 g∙mol-1
C 54,53 %, H 9,15 %, O 36,32 %,Propriétés physiques T° fusion -7,9 °C[1] T° ébullition 164 °C[1] Solubilité dans l'eau : miscible[1],
Miscible avec l'éthanol, l'étherMasse volumique 0,959 g/mL à 20 °C
0.964 g/mL à 25 °CT° d’auto-inflammation 452 °C[1] Point d’éclair 72 °C c.f.[1] Limites d’explosivité dans l’air en volume % dans l'air : 2-10[1] Pression de vapeur saturante à 20 °C : 57 Pa[1] Propriétés optiques Indice de réfraction 1,398 à 20° (éclairage : sodium) Précautions Directive 67/548/EEC 
CPhrases R : 34, Phrases S : (1/2), 26, 36, 45, Transport - 2820 NFPA 704 SIMDUT[2] Produit non classifié SGH[3] 
DangerÉcotoxicologie DL50 8,79g/kg (rats, oral) LogP 0.79[1] Unités du SI & CNTP, sauf indication contraire. L'acide butanoïque, usuellement appelé acide butyrique du grec βουτυρος (beurre), est un acide carboxylique saturé de formule CH3CH2CH2-COOH
On le trouve par exemple dans le beurre rance, le parmesan, et le contenu gastrique, où il dégage une odeur forte et désagréable. L'acide butyrique peut être détecté par des mammifères avec un bon odorat, comme les chiens, dans des concentrations de 10 ppb, alors que les humains ne peuvent le détecter que dans des concentrations supérieures à 10 ppm.
Dans des conditions normales de température et de pression, l'acide butanoïque est un liquide légèrement huileux qui se solidifie à -8 °C et dont le point d'ébullition est de 164 °C. Il est facilement soluble dans l'eau, l'éthanol, et l'éther et se dissocie de son solvant par l'addition de chlorure de calcium. Le dichromate de potassium et l'acide sulfurique l'oxydent en dioxyde de carbone et en acide acétique, alors que le permanganate de potassium alcalin l'oxyde seulement en dioxyde de carbone. De plus, il a pour isomère de constitution l'acide 2-méthylpropanoïque, qui lui doit son deuxième nom d'acide isobutyrique.
C'est aussi un acide gras à courte chaîne présent dans les huiles végétales et les graisses animales. Le glycéride (ester de glycérol) de l'acide butyrique compose 3 % à 4 % du beurre. Quand le beurre rancit, les glycérides sont hydrolysés, libérant ainsi de l'acide butyrique à l'odeur désagréable. L'acide butyrique normal ou l'acide butyrique de fermentation est également trouvé comme ester hexylique dans l'huile de Heracleum giganteum et comme ester octylique dans celle du panais Pastinaca sativa ; il est aussi présent dans la transpiration.
Il est habituellement produit par la fermentation du sucre ou de l'amidon, provoquée par l'addition de fromage en décomposition, auquel on ajoute du carbonate de calcium pour neutraliser les acides formés dans le processus. La fermentation butyrique de l'amidon est facilitée par l'addition directe de Bacillus subtilis.
Divers esters sont obtenus à partir de l'acide butyrique. Ceux à faible masse molaire, comme le méthylbutyrate, ont la plupart du temps des arômes plaisants. Ils sont ainsi utilisés comme additifs alimentaires ou dans les parfums.
Sa formule brute est la même que celle du formiate de propyle.
Sommaire
Fabrication des butyrates
Fermentation classique
Les butyrates, ou esters d'acide butanoïque, sont issues de fermentations faisant intervenir des bactéries anaréobies. Ce processus a été découvert par Louis Pasteur en 1861. Voici quelque unes des principales bactéries productrices de butyrates :
- Clostridium butyricum
- Clostridium kluyveri
- Clostridium pasteurianum
- Fusobacterium nucleatum
- Butyrivibrio fibrisolvens
- Eubacterium limosum
- Clostridium tyrobutyricum
Le bilan de la réaction est le suivant :
- C6H12O6 → C4H8O2 + 2CO2 + 2H2
La première étape de la production des butyrates emprunte la chaîne métabolique de la glycolyse, qui aboutit à la formation de deux molécules de pyruvate par molécule de glucose. Le pyruvate obtenu est ensuite oxydé en éthanoate (sous la forme d'éthanoyl-coenzyme A) par un processus enzymatique unique faisant intervenir une série d'enzymes appelés "complexe pyruvate déshydrogénase", avec formation parallèle de dioxyde de carbone (CO2) qui quitte alors la cellule par diffusion et réduction de NAD+ en NADH.
- l'éthanoyl coenzyme A se transforme en acetoacetyl coenzyme A. l'enzyme responable est l'acetyl-CoA-acetyl transferase.
- l'Acetoacetyl coenzyme A se transforme en ß-hydroxybutyryl CoA. l'enzyme responable est la ß-cétoacyl-CoA réductase (coenzyme : NADH).
- La ß-hydroxybutyryl CoA se transforme en crotonyl CoA. l'enzyme responable est la ß-hydroxyacyl deshydratase.
- Crotonyl CoA se transforme en butyryl CoA (CH3CH2CH2C=O-CoA). l'enzyme responable est la énoyl CoA réductase (coenzyme : NADH).
- Un groupement phosphate remplace le CoA pour former un butyryl phosphate. L'enzyme responable est la phosphobutyrylase.
- Le groupement phosphate rejoint l'ADP pour former de l'ATP et du butyrate; l'enzyme responable est la butyrate kinase.
Acétone et fermentation des butyrates
Certaines bactéries produisent de l'acétone et du butanol par un autre processus commençant comme une fermentation de butyrates, comme :
- Clostridium acetobutylicum: (la plus importante, utilisée dans l'industrie chimique)
- Clostridium beijerinckii
- Clostridium tetanomorphum
- Clostridium aurantibutyricum
Ces bactéries suivent le processus de fermentation décrit précédemment mais, lorsque le pH est inférieur à 5, elles passent vers la production de butanol et d'acétone pour empêcher une plus forte baisse du pH qui leur serait fatale. Deux molécules de butanol sont produites pour une molécule d'acétone. La modification se produit après la formation de l'acetoacetyl CoA. Cet intermédiaire peut, dans ces conditions, agir de deux nouvelles façons :
- Acetoacetyl CoA → acetoacetate → acetone
- Acetoacetyl CoA → butyryl CoA → butanal → butanol.
Activité physiologique de l'acide butanoïque
L'acide butyrique peut inhiber la fonction des histones désacétylase, augmentant ainsi la proportion d'histones acétylés, lesquelles ont une plus faible affinité pour l'ADN que la forme non acétylée (pour des raisons de répulsion électrostatiques). Il est en général admis que la fixation des facteurs de transcription sur l'ADN est défavorisée par la présence d'histones non acétylées (ayant une faible affinité pour l'ADN). Il est donc possible de conclure que l'acide butyrique augmente l'activité transcriptionnelle de la cellule au niveau de promoteurs régulés par les histones déacétylases.
Source
- (en) Cet article est partiellement ou en totalité issu d’une traduction de l’article de Wikipédia en anglais intitulé « Butyric acid ».
- ↑ a , b , c , d , e , f , g , h et i ACIDE BUTYRIQUE, fiche de sécurité du Programme International sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ « Acide butyrique » dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Bibliographie
Voet & Voet ; John Wiley & Sons, 1995
- Portail de la chimie
- Portail de la biochimie
Catégories : Produit chimique corrosif | Acide carboxylique | Arôme
Wikimedia Foundation. 2010.

