- Chimie bioinorganique
-
La chimie bioinorganique (ou biochimie minérale) est une spécialité scientifique à l'interface chimie-biologie, se situant plus précisément entre la biochimie et la chimie inorganique (chimie des éléments métalliques).
Elle s'interesse aux espèces chimiques contenant des atomes métalliques dans les systèmes biologiques. La chimie bioinorganique s'intéresse également à la synthèse de complexes artificiels pour comprendre le fonctionnement des systèmes biologiques, voire pour en reproduire l'activité (on parle dans ce cas de chimie biomimétique).
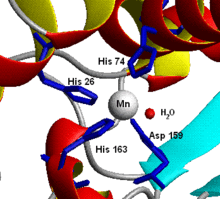 Un site actif d'une métalloprotéine : la Mn-SOD mitochondriale humaine montrant la complexation des acides aminés au manganèse
Un site actif d'une métalloprotéine : la Mn-SOD mitochondriale humaine montrant la complexation des acides aminés au manganèse
Exemples historiques
Paul Ehrlich a utilisé des composés de l'arsenic pour le traitement de la syphilis, démontrant la pertinence d'utiliser des éléments métalliques (en l'occurrence, l'arsenic est un métalloïde) en médecine. Cette stratégie porta ses fruits avec la découverte de l'activité anti-cancereuse du cisplatine (cis-PtCl2(NH3)2).
La première protéine à avoir été cristallisée a été l'uréase. Il a été montré par la suite que cette protéine contenait du nickel au site actif. Dorothy Crowfoot Hodgkin a montré cristallographiquement que la Vitamine B12 contenait un complexe macrocyclique de cobalt.
La découverte de la structure de l'ADN par Watson et Crick a montré le rôle structurant des unités phosphates sous forme polymérique.
Les métaux en biologie et en médecine
La chimie bioinorganique s'intéresse à divers systèmes distincts. Ces domaines incluent le transport et le stockage des ions métalliques, les métalloenzymes hydrolytiques, les métalloprotéines à transfert d'électrons, les métalloprotéines servant au transport et à l'activation du dioxygène ainsi que des systèmes bioorganométalliques (avec une liaison métal-carbone). La chimie bioinorganique s'intéresse aussi à l'étude de la dynamique des cations métalliques dans les systèmes biologiques et à la conception de médicaments à base d'éléments métalliques.
Transport et stockage des ions métalliques
Le transport et stockage des ions métalliques s'interesse aux canaux ioniques, pompes ioniques (par exemple la NaKATPase) et aux autres protéines ou petites molécules (tels que les sidérophores) dont le but est de contrôler la concentration de cations métalliques dans les cellules.
Métalloenzymes hydrolytiques
Les métalloenzymes hydrolytiques incluent des protéines qui catalysent les réactions d'hydrolyse. Dans le cycle catalytique de ces enzymes l'eau joue le rôle de ligand pour le cation métallique dans certains intermédiaires. Des exemples de cette classe de protéines sont l'anhydrase carbonique, les métallophosphatases et les métalloprotéinases (telles que la carboxypeptidase).
Métalloprotéines à transfert d'électrons
Les métalloprotéines à transfert d'électrons peuvent se ranger en trois catégories principales :
- protéines contenant des clusters fer-soufre telles que les rubrédoxines, les ferrédoxines, les protéines de Rieske, et l'aconitase (EC ).
- les protéines à cuivre bleu.
- les cytochromes
Ces protéines se lient à des transporteurs d'électrons non métalliques tels que la nicotinamide adénine dinucléotide (NAD) et la flavine adénine dinucléotide (FAD).
Métalloprotéines de transport et d'activation du dioxygène
Les métalloprotéines de transport et d'activation du dioxygène utilisent des éléments métalliques tels que le fer, le cuivre ou le manganèse. L'hème est utilisé par les globules rouges au sein de l'hémoglobine. D'autres métalloprotéines servant au transport de l'oxygène sont la myoglobine, l'hémocyanine, et l'hémérythrine. Les oxydases et les oxygénases sont trouvés dans la majorité des organismes vivants pour utiliser le dioxygène pour réaliser des fonctions importantes telles que le dégagement d'énergie dans avec la cytochrome c oxidase ou l'oxydation de petites molécules avec le système cytochrome P450 oxidase/cytochrome P450 ou la méthane monooxygénase. D'autres métalloprotéines sont destinées à protéger les organismes vivants contre le stress oxydant. Ces systèmes incluent les peroxydases, catalases et superoxyde dismutases. Dans le cadre de la photosynthèse un site actif composé de 4 ions de manganèse sert à l'oxydation de l'eau.
Systèmes bioorganométalliques
Les systèmes bioorganométalliques tels que les hydrogénases et la méthyl-cobalamine sont des exemples biologiques de chimie organométallique.
Métabolisme de l'azote
Le métabolisme de l'azote utilise des éléments métalliques. La nitrogénase (enzyme à molybdène et fer) est associée au métabolisme de l'azote. Plus récemment l'importance cardiovasculaire et neuronale du monoxyde d'azote (NO) a été découverte. NO est produit par la NO synthase, une protéine contenant un groupement hème.
Dynamique des cations métalliques dans les systèmes biologiques
Diverses maladies, comme la maladie de Wilson sont dus à un dysfonctionnement de l'homéostasie des cations métalliques. Dans le cas de la maladie de Wilson, il s'agit du Cu(II).
Médicaments à base d'éléments métalliques
Les exemples les plus connus de médicaments à base d'éléments métalliques sont le cisplatine, dans le cadre de la thérapie du cancer et les agents de contraste à base de Gd(III) pour l'IRM.
Liens externes
Bibliographie
- (en) Ivano Bertini, Harry B. Gray, Edward I. Stiefel, Joan Selverstone Valentine, Biological Inorganic Chemistry, University Science Books, 2007, ISBN 1-891389-43-2
- (en) Rosette M. Roat-Malone, Bioinorganic Chemistry : A Short Course, Wiley-Interscience, 2002, ISBN 0-471-15976-X
- (fr) Stephen J. Lippard, Jeremy M. Berg, Principes de biochimie minérale, De Boeck-Wesmael, 1997, ISBN 2-8041-2517-3
- (en) Wolfgang Kaim, Brigitte Schwederski "Bioinorganic Chemistry: Inorganic Elements in the Chemistry of Life." John Wiley and Sons, 1994, ISBN 0-471-94369-X
- (en) Lawrence Que, Jr., ed., Physical Methods in Bioinorganic Chemistry, University Science Books, 2000, ISBN 1-891389-02-5
- (en) J.J.R. Fraústo da Silva and R.J.P. Williams, The biological chemistry of the elements: The inorganic chemistry of life, 2nd Edition, Oxford University Press, 2001, ISBN 0-19-850848-4
- (en) Ivano Bertini, Harry B. Gray, Edward I. Stiefel, Joan Selverstone Valentine, Biological Inorganic Chemistry, University Science Books, 2007, ISBN 1-891389-43-2
Wikimedia Foundation. 2010.
