- Aconitase
-
Aconitate hydratase ![Structure de l'aconitase (PDB 1ACO)[1].](/pictures/frwiki/50/220px-PDB_1aco_EBI.jpg)
Structure de l'aconitase (PDB 1ACO)[1].N° EC EC N° CAS Bases de données IntEnz Vue IntEnz BRENDA Entrée BRENDA IUBMB 4.2.1.3 à l'IUBMB KEGG Entrée KEGG MetaCyc Voie métabolique PRIAM Profil PDB Structures GO AmiGO / EGO L’aconitase, ou aconitate hydratase, est une enzyme intervenant notamment dans le cycle de Krebs pour réaliser l'isomérisation stéréospécifique du citrate en isocitrate via le cis-aconitate[2],[3],[4].
-
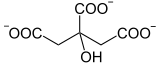
 H2O +
H2O +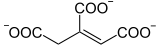

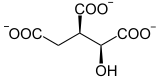
Citrate Cis-aconitate Isocitrate
La réaction d'isomérisation implique une déshydratation suivie d'une réhydratation afin de translater l'atome d'oxygène de l'hydroxyle de part et d'autre d'une double liaison transitoire.
Contrairement à la plupart des protéines fer-soufre, qui fonctionnent comme transporteurs d'électrons, le centre fer-soufre de l'aconitase réagit directement avec le substrat de l'enzyme. L'aconitase a un centre actif [Fe4S4]2+ qui peut se convertir en une forme inactive [Fe3S4]+. Trois résidus cystéine ont été identifiés comme ligands du centre [Fe4S4]. Dans la forme active de ce cluster, le cation de fer labile est coordonné à des molécules d'eau et non à des résidus cystéine de l'enzyme.
L'aconitase est inhibée par l'anion fluoroacétate FCH2COO-, présent notamment dans le fluoroacétate de sodium FCH2COONa, qui agit donc comme un poison. Le centre fer-soufre est très sensible à l'oxydation par les anions superoxyde O2-[5].
Sommaire
Dénominations alternatives
- Cis-aconitase.
- Citrate hydro-lyase.
- Citrate(isocitrate) hydro-lyase.
Isozymes
Il existe plusieurs isozyme de l'aconitase :
- ACO1 : présente dans le cytosol. ACO1 est un IRP1 avec un agrégat [4Fe-4S]
- ACO2 : présente dans la mitochondrie
- ACO3
Notes et références
- (en) H. Lauble, M. C. Kennedy, H. Beinert, C. D. Stout CD, « Crystal structures of aconitase with trans-aconitate and nitrocitrate bound », dans J. Mol. Biol., vol. 237, no 4, avril 1994, p. 437-451 [lien PMID, lien DOI]
- (en) H. Beinert, M. C. Kennedy, « Aconitase, a two-faced protein: enzyme and iron regulatory factor », dans FASEB J., vol. 7, no 15, décembre 1993, p. 1442-1449 [lien PMID]
- (en) D. H. Flint, R. M. Allen, « Iron-Sulfur Proteins with Nonredox Functions », dans Chem. Rev., vol. 96, no 7, novembre 1996, p. 2315-2334 [lien PMID, lien DOI]
- (en) H. Beinert, M. C. Kennedy, C. D. Stout, « Aconitase as Iron-Sulfur Protein, Enzyme, and Iron-Regulatory Protein », dans Chem. Rev., vol. 96, no 7, novembre 1996, p. 2335-2374 [lien PMID, lien DOI]
- (en) P. R. Gardner, « Aconitase: sensitive target and measure of superoxide », dans Meth. Enzymol., vol. 349, 2002, p. 9-23 [lien PMID, lien DOI]
Articles connexes
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie
-
Wikimedia Foundation. 2010.


