- Ferrédoxine
-
Une ferrédoxine est une protéine fer-soufre réalisant des transferts d'électrons dans un grand nombre de réactions d'oxydoréduction du métabolisme cellulaire grâce à leurs clusters Fe-S dont les cations de fer oscillent entre les états d'oxydation +2 (ferreux) et +3 (ferrique). La première protéine de ce type a été isolée en 1962 à partir de la bactérie anaérobie Clostridium pasteurianum[1],[2]. Une ferrédoxine particulière aux chloroplastes[3] intervient dans les réactions de photophosphorylation cyclique et non cyclique de la photosynthèse. Dans la photophosphorylation non cyclique, la ferrédoxine est l'ultime accepteur d'électrons et réduit la NADP+ sous l'action de la EC ) avec la FAD et un groupe flavine comme cofacteurs :
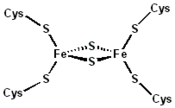
La ferrédoxine des chloroplastes contient des clusters Fe2S2, composés de deux cations de fer et deux anions chlorure. Il existe d'autres types de clusters Fe-S, dont les plus courants sont ceux de type Fe3S4 et Fe4S4.
Sommaire
Ferrédoxines Fe2S2
Parmi elles[4] se trouvent la putidarédoxine[5], la terprédoxine[6] et l'adrénodoxine[7].
Ferrédoxines végétales
Les ferrédoxines végétales, identifiées initialement dans les chloroplastes, contiennent des clusters Fe2S2 dans lesquels les cations de fer sont tétracoordonnés avec deux anions sulfure et quatre groupes fonctionnels thiol de résidus cystéine. Dans les chloroplastes, ces ferrédoxines servent de transporteurs d'électrons dans la photophosphorylation et comme donneurs d'électrons pour plusieurs enzymes, telles que la nitrate réductase et la sulfite réductase.
Ferrédoxines de type thiorédoxine
Certaines ferrédoxines Fe2S2 bactériennes se sont révélées avoir des séquences d'acides aminés différentes des ferrédoxines végétales les rapprochant des thiorédoxines. Celle de Clostridium pasteurianum en particulier, dont le rôle physiologique n'est pas connu avec précision, peut se lier étroitement et spécifiquement à la protéine fer-molybdène de nitrogénase.
Ferrédoxines de type adrénodoxine
L'adrénodoxine est présente chez les mammifères en général, et chez l'homme en particulier : la variante humaine de l'adrénodoxine est appelée ferrédoxine 1. Dans les systèmes monooxygénase mitochondiaux, l'adrénodoxine transfère un électron de la NADPH:adrénodoxine réductase au cytochrome P450 membranaire. Chez les bactéries, la putidarédoxine et la terprédoxine transportent des électrons entre les ferrédoxine réductases et les P450 solubles correspondants. La fonction exacte des autres membres de cette famille de protéines n'est pas toujours bien comprise.
La ferrédoxine 1 participe chez l'homme à la synthèse des hormones thyroïdiennes. Elle transfère également des électrons de l’adrénodoxine réductase au P450, et peut se fixer aux métaux et aux protéines. Elle se trouve dans la matrice mitochondriale cellulaire.
Ferrédoxines Fe3S4 et Fe4S4
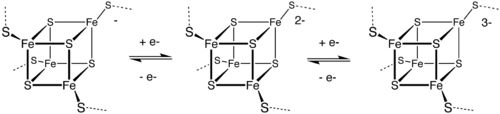
Les ferrédoxines [Fe4S4] se rangent en deux catégories dites à bas potentiel (de type bactérien) et à haut potentiel (HiPIP) selon l'état d'oxydation du cluster fer-soufre ; le passage d'une ferrédoxine bas potentiel à une ferrédoxine haut potentiel est illustré par le diagramme suivant :
Le cluster des ferrédoxines bactériennes oscille entre les états :
- [ Fe2+3 Fe3+ S2-4 ]
 e- + [ Fe2+2 Fe3+2 S2-4 ], avec un potentiel d'oxydo-réduction de -0,7 à -0,3 V.
e- + [ Fe2+2 Fe3+2 S2-4 ], avec un potentiel d'oxydo-réduction de -0,7 à -0,3 V.
Celui des ferrédoxines HiPIP oscille entre les états :
Ces deux types de ferrédoxines partagent l'état d'oxydation [ Fe2+2 Fe3+2 S2-4 ]. La différence dans les potentiels redox est attribuée à la différence dans les liaisons hydrogène, qui modifient fortement le caractère basique du groupe thiol des résidus cystéine.
Ferrédoxines bactériennes
Il existe plusieurs types de ferrédoxines bactériennes selon leur séquence d'acides aminés, mais toutes ces ferrédoxines possèdent une zone constante comprenant quatre résidus cystéine liés à un cluster Fe4S4. La ferrédoxines Fe4S4 de Pyrococcus furiosus est caractérisée par le remplacement d'un des quatre résidus cystéine par un résidu d'aspartate.
Les gènes codant les ferrédoxines bactériennes ont évolué en subissant des duplications, transpositions et fusions, d'où l'apparition de ferrédoxines avec plusieurs clusters fer-soufre. Dans certains cas, un ou plusieurs résidus cystéine manquent à l'appel, et dans ce cas la ferrédoxine résultante perd localement la faculté de se lier à un cluster Fe4S4, ou bien ne peut plus se lier qu'à un cluster Fe3S4.
Ferrédoxines HiPIP
Les protéines fer-soufre à haut potentiel (HiPIP) constituent une famille particulière de ferrédoxines Fe4S4 fonctionnant dans les chaînes de transport d'électrons anaérobies. Certaines HiPIP ont un potentiel d'oxydo-réduction supérieur à celui de toutes les autres protéines fer-soufre connues, par exemple 450 mV pour Rhodopila globiformis.
Notes et références
- (en) Mortenson LE, Valentine RC, Carnahan JE, « An electron transport factor from Clostridium pasteurianum », Biochem. Biophys. Res. Commun. 7 448–52, juin 1962.
- (en) Valentine RC, « Bacterial ferredoxin », dans Bacteriol. Rev. 28 497–517, décembre 1964.
- (en) Tagawa K, Arnon DI, « Ferredoxins as electron carriers in photosynthesis and in the biological production and consumption of hydrogen gas », Nature 195 537–43, auût 1962.
- (en) Jouanneau Y, Armengaud J, Sainz G, Sieker LC, « Crystallization and preliminary X-ray diffraction analysis of a [2Fe-2S] ferredoxin (FdVI) from Rhodobacter capsulatus », Acta Crystallogr. D 57 301–303, 2001.
- (en) Sevrioukova IF, « Redox-dependent Structural Reorganization in Putidaredoxin, a Vertebrate-type [2Fe-2S] Ferredoxin from Pseudomonas putida », J. Mol. Biol. 347 (3) 607–621, 2005.
- (en) Pochapsky TC, Mo H, Pochapsky SS, « A model for the solution structure of oxidized terpredoxin, a Fe2S2 ferredoxin from Pseudomonas », Biochemistry 38 (17) 5666–5675, 1999.
- (en) Ruterjans H, Beilke D, Weiss R, Lohr F, Pristovsek P, Hannemann F, Bernhardt R, « A new electron transport mechanism in mitochondrial steroid hydroxylase systems based on structural changes upon the reduction of adrenodoxin », Biochemistry 41 (25) 7969–7978, 2002.
- Portail de la biologie cellulaire et moléculaire
- Portail de la biologie
- Portail de la biochimie
- [ Fe2+3 Fe3+ S2-4 ]
Wikimedia Foundation. 2010.