- VIH-1
-
Virus de l'immunodéficience humaine
Virus de l'immunodéficience
humaine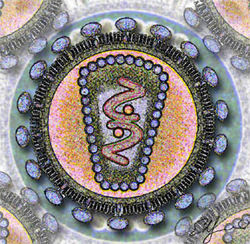
Schéma de la section d'un VIH. Classification classique Règne Virus Groupe Groupe VI Famille Retroviridae Sous-famille Orthoretrovirinae Genre Lentivirus Espèce Virus de l'immunodéficience humaine :
- type 1 (VIH-1)
- type 2 (VIH-2)
Parcourez la biologie sur Wikipédia : Le virus de l'immunodéficience humaine (VIH) est un rétrovirus infectant l'homme et responsable du syndrome d'immunodéficience acquise (Sida), qui est un état affaibli du système immunitaire le rendant vulnérable à de multiples infections opportunistes.
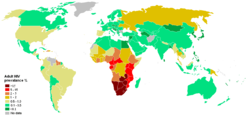
Transmis par plusieurs fluides corporels : sang, sécrétions vaginales, sperme ou lait maternel, le sida est aujourd'hui considéré comme une pandémie ayant causé la mort d'environ 25 millions de personnes entre 1981 (date de la première identification de cas de sida) et janvier 2006[1]. Il est estimé qu'environ 1 % des personnes âgées de 15 à 49 ans vivent avec le VIH, principalement en Afrique sub-saharienne[2].
Bien qu'il existe des traitements antirétroviraux luttant contre le VIH et retardant par conséquence l'apparition du sida, réduisant ainsi la mortalité et la morbidité, il n'existe à l'heure actuelle aucun vaccin ou traitement définitif. La prévention, qui passe notamment par les rapports sexuels protégés et la connaissance de son statut sérologique de manière à éviter les infections d'autrui, est le moyen de lutte le plus efficace.
Histoire
Les débuts de l'épidémie de sida datent du 5 juin 1981, quand le CDC américain annonce une recrudescence, dans les villes de Los Angeles, San Francisco et New York, de cas de pneumonies à Pneumocystis carinii et de sarcomes de Kaposi. Ces deux maladies ont pour particularité d'infecter les personnes immunodéprimées. Il est justement remarqué que, chez ces patients, le taux de lymphocytes T4 est en chute libre. Ces cellules jouent un rôle essentiel dans le système immunitaire. Les premiers malades sont tous homosexuels, ce qui fait que ce syndrome, qui ne portait pas encore le nom de sida, est provisoirement appelé le syndrome gay ou cancer gay. Une des premières causes suggérées de cette immunodépression est le poppers, un vasodilatateur très utilisé chez les homosexuels[3]. Mais, dans les mois qui suivent, d'autres personnes sont infectées, des toxicomanes par injections, des hémophiles et des Haïtiens. Cette découverte révèle que le poppers n'est pas la cause, et une origine infectieuse est de plus en plus admise. Il reste alors à trouver l'agent infectieux.
Origine virale
L'origine virale est privilégiée, eu égard aux modes de transmission alors identifiés (sanguin et sexuel). Plusieurs virus sont mis en cause, mais on s'aperçoit qu'ils ne sont qu'une conséquence. Robert Gallo et son équipe, qui ont découvert le premier rétrovirus humain, le HTLV-1, pensent qu'un mutant de ce dernier est la cause du Sida. Il explique cela par le fait que le HTLV-1 fait proliférer les lymphocytes T4, cet agent infectieux faisant l'inverse, une mutation peut donc en être la cause. Cette hypothèse est renforcée par le fait que certains des cas haïtiens sont positifs à un test de dépistage du HTLV-1. Cette positivité se révèlera être causée par un biais, le HTLV-1 étant très présent à Haïti[3].
À partir de 1982, avec les premiers cas identifiés en France, la recherche française débute. Willy Rozenbaum, médecin à l'hôpital Bichat de Paris, veut inciter les chercheurs à étudier plus en avant le Sida et à en trouver la cause. Par l'entremise de Françoise Brun-Vézinet, une collègue médecin, Willy Rozenbaum rencontre Jean-Claude Chermann, Françoise Barré-Sinoussi et Luc Montagnier, de l'unité d'oncologie virale de l'Institut Pasteur. Ces derniers acceptent de commencer les recherches et, en janvier 1983, Willy Rozenbaum envoie, aux États-Unis, un échantillon d'un patient atteint de lymphadénopathie, pathologie identifiée comme une maladie opportuniste du stade pré-Sida. L'échantillon est mis en culture et une activité de transcriptase inverse est identifiée, tendant à confirmer la présence d'un rétrovirus. Rapidement, une apoptose apparaît et l'adjonction de globules blancs à la mise en culture relance alors l'activité de transcriptase inverse. Un examen au microscope électronique a permis de visualiser, pour la première fois, le virus[4].
Après une prise de contact avec Robert Gallo, pour un échange d'informations, l'équipe de l'Institut Pasteur confirme que le virus identifié chez le patient lymphadénopathique n'est pas le HTLV-1[4]. Ce nouveau rétrovirus est alors appelé Lymphadenopathy Associated Virus (LAV) et les résultats sont publiés dans Science le 20 mai 1983[5]. À ce stade, le lien entre le LAV et le Sida n'est pas clairement établi par l'équipe de Luc Montagnier. L'équipe de Robert Gallo publie le 4 mai 1984, dans Science, les résultats de l'isolement d'un virus qu'elle considère comme responsable du Sida et le nomme HTLV-3[6]. L'équipe de Jay A. Levy à San Fransisco fait de même le 24 août 1984 et trouve plusieurs rétrovirus, qu'elle nomme AIDS-related virus (ARV)[7].
Controverse sur la parenté de la découverte
Pendant un temps, les trois dénominations cohabitent, ainsi qu'une polémique sur la parenté de la découverte entre les équipes américaine et française et des possibles fraudes scientifiques de Robert Gallo et d'un de ses collègues[8],[9].
Le point d'orgue de cette controverse concerne l'attribution des redevances pour les tests VIH (qui commencent à être commercialisés durant l'année 1985[4]), entre le National Institutes of Health où travaille Robert Gallo et l'Institut Pasteur. Ce dernier porte plainte car il pense que la souche utilisée pour mettre le test VIH américain au point a été conçue à partir de la souche envoyée par Montagnier à Gallo. Le différend se règle au niveau politique, le 4 décembre 1987, lors d'une rencontre entre le président américain Ronald Reagan et le premier ministre français de l'époque Jacques Chirac. Un accord est signé où la paternité de la découverte est attribuée à parts égales entre les États-Unis et la France. Les redevances associées sont partagées entre les instituts américains alors que, en Europe, elles reviennent intégralement à l'Institut Pasteur[10].
Un article dans la presse américaine de John M. Crewdson, en 1989, relance la controverse : Robert Gallo est, au mieux, accusé d'avoir fait une erreur en contaminant sa souche avec celle de l'Institut Pasteur et, au pire, d'être coupable de fraude scientifique. Le scientifique américain finit par reconnaître, en 1991, que la souche qu'il a utilisée a été contaminée par celle de l'Institut Pasteur, mais dément la fraude scientifique[10].
Finalement, en 1994, des institutions fédérales américaines reconnaissent que la découverte du VIH est purement française et que Robert Gallo est coupable de fraude scientifique[10]. La reconnaissance de cette parenté est confirmée en 2008 par le Comité Nobel, lorsqu'il attribue le Prix Nobel de Médecine à Luc Montagnier et Françoise Barré-Sinoussi, sans mentionner les travaux de Robert Gallo sur le sujet[11]. Lors d'un entretien, peu de temps après l'attribution des Nobel, Robert Gallo se déclare « déçu » de ne pas être également honoré, mais considère que tous les récipiendaires méritent ce prix[12].
Séquençage et découverte du VIH-2
A côté de la controverse, la recherche continue et le LAV est étudié sous tous les aspects : plusieurs points sont alors démontrés, comme le fait qu'il est totalement différent du HTLV-1 - oncovirus poussant les lymphocytes T à se multiplier - alors que le LAV les tue. Avec la coopération du CDC, l'équipe de l'Institut Pasteur renforce de plus en plus l'hypothèse que le VIH est la cause du Sida, ce qui est depuis considéré comme un fait avéré par la communauté scientifique. En janvier 1985, le séquençage du LAV est réalisé par une équipe de l'Institut Pasteur, qui publie ses résultats dans Cell[13]. C'est cette même année qu'a été confirmée l'identité commune entre les trois virus LAV, HTLV-3 et ARV.
Le 18 juillet 1986, les résultats de l'étude d'un patient venant d'Afrique de l'Ouest sont publiés, dans Science, par l'équipe de Luc Montagnier, en collaboration avec des médecins portugais. Les examens ont permis d'identifier un nouveau type de LAV, le LAV-2[14]. Le séquençage du nouveau virus est réalisé l'année suivante, ainsi que la mise au point d'un test de dépistage.
En 1986, le LAV (ainsi que les autres dénominations) est officiellement renommé en virus de l'immunodéfience humaine (VIH), le LAV-1 devient VIH-1 et le LAV-2, le VIH-2.
Vers une prise de conscience
La communauté internationale prend conscience de la gravité de l'épidémie qui se transforme rapidement en pandémie et c'est ainsi que, le 26 octobre 1987, l'Assemblée générale des Nations unies vote une résolution invitant tous les États et toutes les agences onusiennes à coopérer pour lutter contre cette pandémie[15]. Depuis, la lutte contre le VIH/Sida est devenue une priorité pour l'ONU à travers son programme Onusida, ainsi que pour nombre de gouvernements. La communauté scientifique est également très active en vue de mettre au point un vaccin, faisant du VIH le virus le plus étudié à ce jour.
Bien que l'AZT ait été utilisée dès 1986 pour lutter contre le VIH, il faudra attendre le milieu des années 1990 pour qu'arrivent sur le marché des traitements vraiment efficaces contre la réplication du VIH. Ces traitements, appelés trithérapies, combinent plusieurs médicaments pour combattre le VIH sur plusieurs fronts à la fois. Le développement de tests biologiques permettant d'estimer la charge virale a grandement participé à l'efficacité de ces traitements, aboutissant à modifier en conséquence la trithérapie, pour la rendre la plus efficace possible.
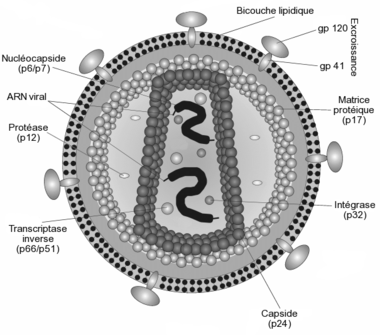
Structure
Le VIH est un rétrovirus du genre des lentivirus, qui se caractérisent par une longue période d'incubation avec, par voie de conséquence, une évolution lente de la maladie (d'où la racine du nom venant du latin lenti, signifiant lent).
Il est d'un aspect globalement sphérique, pour un diamètre variant de 90 à 120 nanomètres. Comme de nombreux virus infectant les animaux, il dispose d'une enveloppe composée des restes de la membrane de la cellule infectée. Cette enveloppe est recouverte de deux types de glycoprotéines : la première est la gp41 qui traverse la membrane, la seconde est la gp120 qui recouvre la partie de la gp41 qui sort de la membrane. Une très forte liaison existe entre la gp120 et le récepteur des marqueurs CD4 présent à la surface des cellules CD4+ du système immunitaire. C'est pour cette raison que le VIH n'infecte que des cellules ayant ce récepteur à leur surface, qui sont en très grande majorité les lymphocytes CD4+.
À l'intérieur de l'enveloppe, se trouve une matrice protéique composée de protéines p17 et, encore à l'intérieur, la capside composée de protéines p24. C'est ce dernier type de protéines qui, avec gp41 et gp120, sont utilisés dans les tests VIH western blot. La nucléocapside est composée, quant à elle, de protéines p6 et p7.
Le génome du VIH, contenu dans la capside, est constitué d'un simple brin d'ARN en double exemplaire, accompagné d'enzymes qui :
- transcrivent l'ARN viral en ADN viral (transcriptase inverse p64)
- intègrent l'ADN viral à l'ADN cellulaire (l'intégrase p32)
- participent à l'assemblage du virus (protéase p10). Cette dernière n'est pas présente dans la capside, mais flotte dans la matrice p17.
Ces trois enzymes sont les principales cibles des traitements antirétroviraux, car elles sont spécifiques aux rétrovirus.
Le génome du VIH est composé de neuf gènes. Les trois principaux sont gag, pol et env, qui définissent la structure du virus et sont communs à tous les rétrovirus. Les six autres gènes sont tat, rev, nef, vif, vpr et vpu (ou vpx pour le VIH-2), qui codent des protéines régulatrices et dont les fonctions ne sont pas connues avec précision.
Transmission
Risque de transmission du VIH-1 selon la voie d'exposition[16]. Voie d'exposition Nombre de contaminations
estimées pour 10 000
expositions à une
source infectéeTransfusion sanguine 9 000[17] Accouchement 2 500[18] Partage de seringue
chez des toxicomanes67[19] Rapport anal, réceptif* 50[20],[21] Blessure percutanée par aiguille 30[22] Rapport pénis-vagin, réceptif* 10[20],[21],[23] Rapport anal, insertif* 6,5[20],[21] Rapport pénis-vagin, insertif* 5[20],[21] Fellation, réceptif* 1[21] Fellation, insertif* 0,5[21] * sans préservatif Le VIH est présent dans de nombreux fluides organiques. On en a retrouvé dans la salive, les larmes et l'urine, mais en des concentrations insuffisantes pour que des cas de transmission soient enregistrés. La transmissions par ces fluides est ainsi considérée comme négligeable. Par contre, des quantités de VIH assez importantes pour une infection ont été détectées dans le sang, le lait maternel, la cyprine, le sperme, ainsi que le liquide précédant l'éjaculation[24].
Par voie de conséquence, les trois modes de contaminations sont :
- les rapports sexuels non protégés, qu'ils soient hétérosexuels ou homosexuels, représentent la part la plus importante des contaminations
- le contact avec du matériel contaminé chez :
- les toxicomanes, par injection
- les transfusés
- le personnel de santé
- la transmission mère-enfant, durant la grossesse, pendant l'accouchement et lors de l'allaitement. Sans traitement et avec un accouchement naturel, le taux de transmission varie, selon les études, entre 10 et 40 %[25]. C'est durant l'accouchement que les risques d'infection sont les plus élevés (65 % de tous les cas d'infection)[26]. Un traitement et la pratique éventuelle d'une césarienne peuvent faire baisser ce chiffre à 1 %[27].
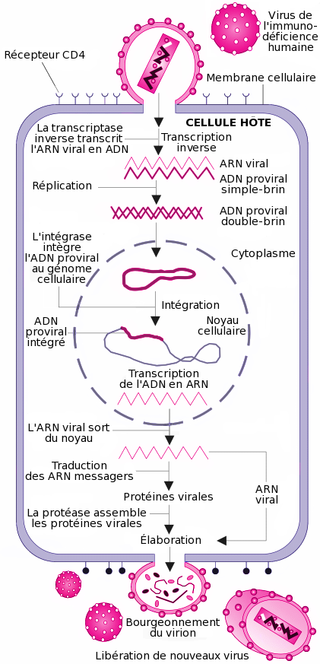
Cycle de réplication
Les cellules cibles du VIH sont celles présentant des récepteurs CD4 à leur surface. Ainsi, les lymphocytes T CD4+, les macrophages, les cellules dendritiques et les cellules microgliales cérébrales peuvent être infectées par le VIH[28]. Ainsi, la réplication virale a lieu dans plusieurs tissus.
La réplication du virus se déroule en plusieurs étapes :
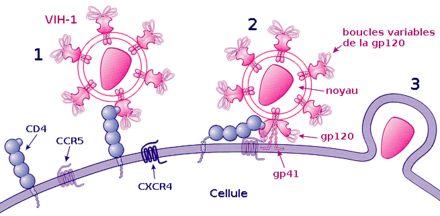
La fixation ou attachement à une cellule
Cette étape repose sur une reconnaissance entre les protéines de la surface virale gp120 et les récepteurs CD4 de la cellule cible. Après l'union avec un récepteur CD4, gp120 change de conformation et est attiré vers un co-récepteur devant également être présent à côté de la molécule CD4. Plus d'une dizaine de co-récepteurs ont été identifiés, mais les principaux sont CXCR4 pour les lymphocytes T CD4+ et CCR5 pour les macrophages[29].
La fusion, la pénétration et la décapsidation
C'est la seconde étape de l'infection, intervenant juste après l'union de gp120 avec le co-récepteur. Cette union libère la protéine gp41, qui se fixe sur la membrane cytoplasmique. Par repli sur elle-même, gp41 attire l'enveloppe virale vers la membrane cytoplasmique, puis la fusion des membranes cellulaire et virale a lieu grâce à un peptide de fusion présent dans gp41. La capside du VIH pénètre alors dans le cytoplasme de la cellule ; une fois à l'intérieur de la cellule, elle se désagrège, libérant les deux brins d'ARN et les enzymes qu'elle contenait.
Ainsi, la protéine gp120 est responsable de l'attachement et gp41 de la fusion, puis de la pénétration au sein de la cellule.
La transcription inverse
Cette étape est spécifique aux rétrovirus. Ces derniers ayant pour génome de l'ARN et non de l'ADN, une opération de transcription, "convertissant" l'ARN viral en ADN viral est nécessaire, car seul de l'ADN peut être intégré dans le génome de la cellule cible. Cette transcription est réalisée par l'enzyme de transcriptase inverse (TI). La TI parcourt l'ARN viral et le transcrit en une première molécule d'ADN simple-chaîne, ou ADN brin(-). Pendant cette synthèse, l'ARN matrice est dégradé par une activité dite "RNAse H" portée par la TI. La dégradation de l'ARN est totale, sauf pour deux courtes séquences riches en purines appelées séquences PPT (polypurine tracts). Ces deux courtes séquences vont servir d'amorces à la TI pour la synthèse du second brin d'ADN, le brin(+), en utilisant l'ADN brin(-) comme matrice. L'ADN final est une molécule bicaténaire aussi appelée ADN à double-brin. Une particularité de la transcriptase inverse est de ne pas être fidèle dans sa transcription et de souvent faire des erreurs. C'est la raison pour laquelle le VIH a une très grande variabilité génétique.
L'intégration
L'ADN bicaténaire pénètre dans le noyau cellulaire, selon un processus actif encore mal compris. Cet import nucléaire constitue une particularité propre aux lentivirus qui sont, de fait, capables d'infecter des cellules en phase stationnaire, c'est-à-dire dont le noyau est intact. Pour ce faire, l'ADN bicaténaire est, à ce moment du cycle, étroitement associé à l'intégrase et d'autres composants protéiques viraux et cellulaires, dans un complexe appelé complexe de pré-intégration. Ce complexe possède la capacité d'interagir avec des éléments de la membrane nucléaire, pour traverser cette membrane et accéder à la chromatine cellulaire. L'ADN s'intègre ensuite au hasard dans le génome de la cellule cible, sous l'effet de l'enzyme intégrase.
La formation d'un ARN messager
Les deux brins d'ADN de la cellule « s'écartent » localement sous l'effet de l'ARN polymérase. Des bases azotées libres du noyau viennent prendre la complémentarité de la séquence et se polymérisent en une chaîne monobrin, l'ARNm (messager).
L'épissage
L'ARNm ainsi obtenu est hétérogène. En effet, il est constitué d'une succession d'introns (parties non codantes) et d'exons (parties codantes). Cet ARNm doit subir une maturation pour pouvoir être lu par les ribosomes. Se passe alors une excision des introns, pour ne laisser que les exons.
La traduction de l'ARN
Une fois sorti du noyau par l'un des pores nucléaires, l'ARNm est lu par les ribosomes du RER (réticulum endoplasmique rugueux). L'ARNm vient en fait se glisser entre les deux sous-unités du ribosome. À chaque codon (groupe de trois nucléotides) de l'ARNm, le ribosome attribue un acide aminé. Les différents acides aminés se polymérisent au fur et à mesure de la lecture. Un codon initiateur AUG (Adénine-Uracile-Guanine) fera débuter la synthèse, tandis qu'un codon stop (UAA ; UGA ; UAG) en marquera la fin.
Maturation
Elle a lieu dans l'appareil de Golgi : les polypeptides ainsi formés ne sont pas encore opérationnels. Ils doivent subir une maturation dans l'appareil de Golgi.
L'assemblage
Les protéines de structure du virus (matrice, capside et nucléocapside) sont produites sous forme de polyprotéines. Lorsqu'elles sortent du Golgi, les différentes protéines sont liées entre elles. Les protéines sont transportées vers la membrane où elles rejoignent les glycoprotéines virales membranaires. Des ARN viraux rejoignent les protéines virales. Les protéines de structure s'assemblent pour former la capside et la matrice, englobant cet ensemble.
Le bourgeonnement
La capside sort de la cellule infectée en arrachant une partie de la membrane cellulaire (à laquelle ont été préalablement fixées les protéines virales de surface (gp120 et gp41)).
La maturation des virus
Une protéase virale doit couper les liens qui unissent les différentes protéines de structure (matrice, capside et nucléocapside), pour que les virions soient infectieux. Suite aux coupures, les virions sont prêts à infecter de nouvelles cellules.
Variantes génétiques
Le VIH est un virus qui a une très importante variabilité génétique et présente ainsi une très grande diversité. Deux types ont été découverts :
- VIH-1, le plus présent dans le monde
- VIH-2, moins contagieux que VIH-1. Il sévit principalement en Afrique de l'Ouest. Il comprend le VIH-2A et le VIH-2B.
Au sein de chaque type existent plusieurs groupes qui, à leur tour, comportent des sous-types.
Depuis 1998, le VIH-1 est classé en trois groupes[30] auquel s'ajoute un quatrième découvert en 2009 [31] :
- groupe M (pour major group)
- groupe O (pour outlier group)
- groupe N (pour non-M, non-O group)
- groupe P
Les trois premiers groupes (les M, O et N) sont proches du VIScpz infectant le chimpanzé et correspondraient chacun à une transmission indépendante du chimpanzé à l'Homme [32]. Le dernier groupe (le P) cependant est proche du VIS infectant le gorille (VISgor) [31].
Le groupe M prédomine largement avec plus de 40 millions de personnes contaminées, contre un peu plus de 500 pour le groupe O et seulement 7 pour le groupe N[32]. Non seulement le groupe M est de loin le groupe le plus important en nombre de personnes contaminées, mais il est également celui qui est le plus répandu de par le monde, en étant présent sur tous les continents, alors que les autres groupes sont uniquement présents en Afrique centrale[33].
Le groupe M comprend neuf sous-types ou clades (de A à D, de F à H, J et enfin K). S'ajoutent plusieurs formes recombinantes (en anglais circulating recombinant form ou CRF), qui ont pour origine la multiple infection d'une cellule par des sous-types différents, ce qui entraîne des mélanges dans le génome viral.
Les sous-types et formes recombinantes du groupe M ne sont pas réparties uniformément sur toute la planète. Ainsi, en Europe, dans les Amériques et en Australie, c'est le sous-type B qui est le plus présent, alors qu'en Afrique c'est, selon les régions, le A et le C et, en Asie, toujours selon les régions, les groupes C et E[34].
Bien que la variabilité génétique au sein d'un même groupe ne semble pas modifier, de manière significative, la pathogénicité ni la progression de l'infection, elle pose tout de même de sérieux problèmes pour la mise au point d'un vaccin efficace sur tous les groupes et souches du VIH, pour les mesures de la charge virale et dans certains cas particuliers de test VIH[35]. Dans ce dernier cas, c'est ainsi que les tests de dépistage basés sur des antigènes du VIH-1 de sous-type B et du VIH-2 de sous-type A, peuvent présenter une sensibilité moindre pour la reconnaissance des autres sous-types, particulièrement lors de la primo-infection ou d'une infection par des variants comme les VIH-1 du groupe O[36].
Origine de la variabilité
L'apparition de nouvelles variantes génétiques est due à un processus d'évolution, dont les mécanismes sont semblables à ceux qui expliquent l'évolution de toute espèce vivante. La seule différence est que l'évolution du VIH est extrêmement rapide, ce qui a conduit au grand nombre de variantes actuelles. On explique cette grande variabilité génétique du VIH par plusieurs causes :
- Des mutations aléatoires fréquentes
Chez les VIH, le taux de mutations est trés important : plus de mille fois plus important que dans le génome d'un humain. En voici les raisons :
- la transcriptase inverse - qui permet au VIH de se répliquer - est une enzyme ne possédant pas de mécanisme de détection des erreurs de transcription. Les erreurs sont donc fréquentes et ont été estimées à une tous les 1 700 à 10 000 nucléotides produits. Comme le génome du VIH est composé d'un peu moins de 10 000 nucléotides, il y a approximativement entre une et 10 mutations à chaque cycle viral[37],[38],[39],[40],[41].
- le nombre important de virions produits, qui est de l'ordre de 10 000 par jour pour chaque virion infectant une cellule[37]. Au sein de l'organisme entier, tous les deux jours, de 109 à 1010 virions sont renouvelés[38]. En théorie, on peut donc prévoir que chacun de ces nouveaux virions porte des mutations différentes.
Ainsi, dans un seul organisme infecté, il y a déjà plusieurs variantes génétiques, représentant ainsi une quasi-espèce virale.
La variabilité du génome viral n'est pas la même pour tous les gènes, certains sont plus enclins à varier que d'autres. C'est ainsi que le gène env est le plus variable (c'est justement lui qui code les protéines de surface gp41 et gp120), alors que le gène pol est le plus conservé[42].
- Les recombinaisons génétiques
Lorsqu'une cellule est infectée par deux virions génétiquement différents, les séquences peuvent se recombiner, ce qui donne naissance à des formes recombinantes. Ce processus, aléatoire, est favorisé par les comportements à risque, parce qu'ils augmentent la probabilité de contaminations multiples chez une même personne.
- Sélection
Il y a ensuite un processus de sélection naturelle. Les erreurs de transcription et les recombinaisons produisent de nombreux virions différents les uns des autres. La plupart de ces mutations entraînent la production de virions incapables de se répliquer correctement, ce qui les destine à disparaître. Cette importante disparition de virions est compensée par le grand nombre de virions produits. Parmi les virions survivants, certains ont pour particularité d'être plus résistants aux attaques des défenses immunitaires. Cela a pour conséquence de les rendre mieux adaptés à leur milieu et, finalement, seuls les virions résistants sont présents dans l'organisme. Cela mène, à plus ou moins court terme, à une inefficacité des défenses immunitaires, provoquant l'état immunodéprimé de l'organisme si le taux de lymphocytes CD4+ est trop bas.
La prise d'un traitement médicamenteux par les patients infectés par le VIH entraîne également une sélection au sein de la population virale. Ceci favorise la transmission des virions mutants les plus résistants aux médicaments. Pour contrer cet adaptation des VIH, les multithérapies visent à « attaquer » le VIH sur plusieurs facettes à la fois, et ainsi à limiter les possibilités du virus de s'adapter à son milieu.
- Origines multiples
La multiplicité temporelle des passages du VIScpz à l'Homme est la raison de l'existence des différents groupes du VIH-1. Il en est de même pour le VIH-2, dont l'ancêtre est le VISsmm.
Diagnostic et suivi infectieux
Le diagnostic précoce de l'infection par le VIH est important pour une bonne prise en charge du VIH/Sida. En France, par exemple, un cas sur deux est détecté au moment du stade Sida, ce qui, pour les cas non détectés, multiplie par seize le risque de décès du patient dans les six premiers mois de son traitement[43].
Dans les pays développés, des tests sont pratiqués systématiquement pour les dons de sang, d'organes et de sperme. Le manque de tests a entraîné plusieurs contaminations de masse[44].
Le diagnostic sérologique est un acte médical réalisé, en France, par un médecin.
Diagnostic
Le diagnostic visant à déterminer le statut sérologique au VIH est réalisé en deux étapes :
- le dépistage qui, dans la méthode de référence, passe par une détection des anticorps anti-VIH
- la confirmation que les anticorps détectés sont bien liés à une infection par le VIH
La première étape se base sur la détection d'anticorps produits en réponse à une infection par le VIH, les anticorps anti-VIH. Cette production d'anticorps peut être détectée, avec les moyens actuels, en moyenne 22 jours après la contamination[45]. Durant cette période, appelée fenêtre sérologique, le patient est parfaitement infectieux, ce qui pose des problèmes évidents de santé publique. Une fois la fenêtre sérologique passée, son statut sérologique peut être établi.
La première étape de détection emploie la méthode ELISA, qui utilise la réaction anticorps-antigène pour détecter la présence des anticorps anti-VIH. Pour éviter les faux négatifs - qui feraient passer à côté d'un cas de séropositivité - le test doit avoir une sensibilité optimale. Un mélange d'antigènes viraux est alors utilisé, permettant la détection des anticorps anti-VIH-1 et anti-VIH-2 (on parle alors d'ELISA mixte). L'utilisation de deux tests commerciaux d'origine différentes est généralement effectuée pour éliminer le maximum de faux positifs dès la première étape.
Si la détection se révèle positive, douteuse, ou discordante[46], une confirmation est réalisée. Cette dernière vise à savoir si les anticorps détectés sont bien liés à une infection par le VIH-1. Pour cela, on utilise une méthode spécifique, dont le but est d'éliminer les résultats faussement positifs. C'est la méthode western blot (WB) qui est généralement utilisée. Là encore, si le test est douteux ou dénote un début de séroconversion, un second test de confirmation est réalisé trois semaines plus tard, le temps que la séroconversion soit complète.
Ce n'est qu'à la suite de l'ensemble des ces tests qu'un médecin pourra déclarer un patient séropositif.
Autres méthodes
Il existe d'autres techniques de détection d'une infection par le VIH[47], comme :
- l'antigénie p24 : utile lorsque la séroconversion n'a pas encore eu lieu complètement. Le test devient négatif une fois la séroconversion effectuée, cela explique donc l'utilisation de la procédure précédemment décrite comme un standard
- la méthode combinée : qui utilise l'antigénie p24 et la détection d'anticorps. Cette méthode est intéressante au tout début de la contamination, car elle réduit la fenêtre sérologique jusqu’à deux à cinq jours, tout en assurant la prise en compte des personnes totalement séroconvertis
- l'isolement en culture : utilisé pour les nouveau-nés de mère séropositive, car ces derniers sont obligatoirement séropositifs, les anticorps de la mère ayant été transmis. L'infection est confirmée lorsqu'une activité de transcriptase inverse est détectée, ou bien des antigènes p24.
- la détection de l'ARN viral : on cherche les gènes gag ou pol du VIH. Cette méthode tend à remplacer la méthode d'isolement par culture pour les nouveau-nés
Suivi infectieux
Une fois la séropositivité établie, un suivi régulier de l'infection doit être effectué, pour assurer une bonne prise en charge de la maladie et ainsi évaluer au mieux l'état du malade. Deux facteurs sont pris en compte :
- le taux de lymphocytes T4, pour définir le niveau de l'infection
- la charge virale, indiquant le nombre de virions dans l'organisme et, par voie de conséquence, la vitesse de réplication du VIH dans l'organisme, permettant ainsi de prédire l'évolution de l'infection
Le taux de lymphocytes T4 mesure le déficit immunitaire occasionné par la présence du VIH. Cette numération correspond au nombre de cellules T4 présentes dans le sang. Un taux normal chez l'Homme se situe entre 600 et 1 200 T4/mm3. On considère que[48] :
- jusqu’à 500/mm3, le patient peut vivre dans des conditions normales et ne nécessite pas de traitement
- à partir de 350/mm3, un traitement antiviral est recommandé, le résultat attendu étant la baisse de la charge virale permettant la remontée du taux de T4
- en dessous de 200/mm3 le patient est fortement immunodéprimé et a un risque important de souffrir de multiples maladies opportunistes liées au Sida. Le traitement antiviral ainsi qu'une antibioprophylaxie est alors indispensable pour éviter ces complications.
La différence entre deux mesures de charge virale espacées dans le temps permet d'évaluer la vitesse de réplication du VIH et, par voie de conséquence, la progression de l'infection. Il y a un lien direct entre la charge virale et le niveau du déficit immunitaire, occasionné principalment par la disparition des lymphocytes T4. La charge virale est définie en mesurant la concentration de l'ARN virale dans le sang. Cette mesure peut varier grandement selon les méthodes employées et, pour cette raison, il est important que toutes les évaluations de charge virale soient effectuées dans le même laboratoire avec la même technique[49]. C'est le log10 du nombre de copies/mL qui est utilisé pour évaluer la variation dans le temps de la charge virale. Une variation supérieure ou égale à 0,5 est significative[49].
C'est le cumul de ces deux informations qui permet au médecin de définir le traitement du patient.
Physiopathologie
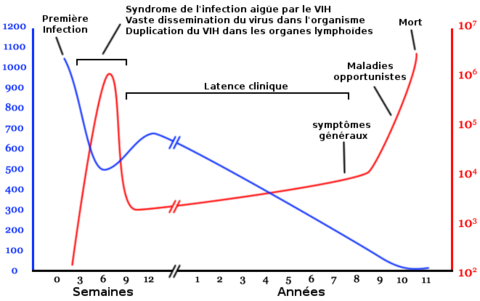 L'évolution de l'infection par le VIH est dite persistante productive et est représentée par ce diagramme qui montre la relation entre la charge virale et le nombre de lymphocytes T4.
L'évolution de l'infection par le VIH est dite persistante productive et est représentée par ce diagramme qui montre la relation entre la charge virale et le nombre de lymphocytes T4.
Nombre de lymphocytes T4 par mm3 de plasma
Nombre de copies de l'ARN viral par mL de plasma
L'infection par le VIH évolue en plusieurs phases pouvant se succéder dans le temps :
- la primo-infection avec (50 à 75 % des cas) ou sans symptômes, phase de séroconversion qui suit la contamination ;
- une phase de latence, parfois accompagnée d'un état de lymphadénopathie généralisée ;
- une phase à symptômes mineurs de l'infection à virus de l'immunodéficience humaine ;
- la phase d'immunodépression profonde, ou stade de Sida généralement symptomatique.
Dès la primo-infection, le virus se réplique activement dans l'organisme, avec une production de dix milliards de virions quotidiennement, entraînant la destruction d'environ cinq milliards de lymphocytes T CD4+[50]. Cette réplication se stabilise, après quelques semaines, à un niveau plus ou moins important selon les sujets. Le système immunitaire, hyperactivé, compense partiellement la destruction massive des lymphocytes T CD4+ en augmentant leur production, mais l'infection à VIH persiste malgré tout, avec pour conséquence l'émergence et la sélection de virus mutants qui échappent à la réponse immune de l'hôte.
Des chercheurs du CNRS, de l'Institut Curie et de l'Institut Pasteur ont découvert que le virus modifiait le pH des compartiments cellulaires où il s'accumule dans les macrophages, empêchant ainsi l'activation des enzymes chargées de le dégrader[51].
Pendant plusieurs années, les lymphocytes T CD4+ semblent se renouveler rapidement malgré leur destruction par le virus, jusqu’à ce que l'épuisement des organes lymphoïdes centraux (thymus) ne permette plus leur régénération. La destruction des lymphocytes T CD4+ est bien souvent due à l'hyperactivation de ces cellules, par interaction avec certaines structures du virus, et non à une destruction directe par le VIH[50]. Après dix à quinze ans d'évolution spontanée sans traitement, le sujet est immunodéprimé (stade Sida), des pathologies infectieuses ou tumorales rares (dites opportunistes) surviennent et conduisent au décès. Actuellement les traitements antirétroviraux évitent ou retardent l'évolution vers le stade Sida, en maintenant les niveaux de réplication du virus au plus bas possible[50].
La destruction du système immunitaire et la progression clinique avec apparition de maladies opportunistes sont directement liées au taux sanguin des lymphocytes T CD4+ du patient[52]. L'efficacité des traitements antirétroviraux est évaluée par le niveau de réplication virale mesurée par la charge virale VIH (taux d'ARN plasmatique), la mesure de taux de lymphocytes T CD4+ (immunodepression) et par l'état clinique du patient.
Non-progresseurs à long terme
Plusieurs cas de personnes séropositives ont réussi à garder pendant une longue durée (au minimum 8 ans), naturellement (c'est-à-dire sans traitement), un taux de CD4 normal (supérieur à 500/mm³) et une charge virale basse, voire indétectable pour certains[53],[54]. Elles sont dites non-progresseurs à long terme ou encore asymptomatiques à long terme (ALT). Quelques patients français sans traitement sont restés asymptomatiques, et même à charge virale indétectable ou presque, pendant au moins vingt ans.[55]
Il n'existe pas de modèle unique, certains patients restent dans un état asymptomatique sans évolution significative de leur état, d'autres (la majorité) connaissent une lente détérioration de leur système immunitaire.
Il faut noter le rôle important de la mitochondrie dans l’évolution plus ou moins rapide d'aggravation de la réplication virale et dans la baisse de la réponse immunitaire. La protection des mitochondries freine la baisse des lymphocytes T et CD4 et la réplication du virus, favorisant l'état « ALT ». La prise régulière de co-enzymes Q1O (> 100 mg/j), associée à divers anti-oxydants vitaminés A, B, C, D, E, K, ainsi que la prise de différents minéraux anti-oxydants, ont un effet protecteur sur ces mitochondries au cours des maladies à déficiences mitochondriales, ce qui favorise une bonne réponse immunitaire. Ce rôle protecteur est d’ailleurs important en cas de prise d’un traitement antirétroviral, en bloquant une partie de la toxicité inhérente à la prise du remède et en activant l’anti-oxydation[56].
Il est important de souligner qu'une ou plusieurs ré-infections à d'autres types ou sous-types de souches virales HIV ne favorise pas le maintien dans l'état "ALT" car, du fait de la mutation très rapide du virus HIV, le risque de recombinaison génétique (en termes de probabilité mathématique) avec des souches plus virulentes diminue forcement la résistance immunitaire d'un patient lambda et sa réponse immune face à un traitement antirétroviral futur.
Contrôleurs du VIH
Certains patients, très rares (moins de 1 %), qui ne développent pas de maladie malgré parfois plus de vingt années de séropositivité et en l’absence de traitement, sont appelés « contrôleurs du VIH » (HIC). Il s'agit des patients infectés par le VIH, ne développant pas le SIDA, dont l'organisme parvient spontanément et durablement à contrôler la réplication virale, maintenant le virus indétectable ou presque dans le plasma (jusqu’à moins de 50 copies d’ARN viral /ml)[57],[58].
Ils font l'objet de recherches qui pourraient conduire à des médicaments ou à un vaccin contre le VIH.[59]
Épidémiologie
Dans le monde, chaque année, il y a environ 2,5 millions de nouvelles infections. En 2007, il y avait 33,2 millions de personnes vivant avec le virus de l'immunodéficience humaine, la majorité étant en Afrique sub-Saharienne. La même année, 2,1 millions de morts du sida ont été recensées[60].
En France, pour l'année 2005, l’Institut de Veille Sanitaire estime à environ 6 700 les nouveaux cas de séropositivité (chiffre stable depuis 2003). Les rapports hétérosexuels représentent la moitié de ces nouveaux cas et concernent pour moitié des personnes d’Afrique subsaharienne. Entre 2003 et 2005, le nombre de découvertes de séropositivité a diminué chez les femmes, mais augmenté chez les homosexuels qui représentent 27 % des nouveaux cas de séropositivité. La proportion d’infections à VIH-2 est de 1,4 % en 2005. Parmi les infections à VIH-1, la proportion de sous-types non-B a diminué entre 2003 et 2005 (de 50 % à 41 %). En 2005, 5,3 millions de sérologies VIH ont été réalisées, soit une augmentation de 8 % par rapport à 2004, tandis que le nombre de sérologies confirmées positives s’est stabilisé[61].
Traitements
Les antirétroviraux constituent l'arsenal thérapeutique contre le VIH, qui s'étoffe progressivement. Une vingtaine de médicaments antirétroviraux sont disponibles en 2006 et ont pour but d'interférer différents mécanismes : d'une part, les enzymes du VIH nécessaires à sa réplication et, d'autre part, ses mécanismes d'entrée dans la cellule.
Grâce à la trithérapie utilisée depuis 1996, la mortalité due au SIDA a chuté, de façon significative, partout où ces nouveaux traitements étaient disponibles[62],[63],[64],[65]. C'est ainsi qu'aux États-Unis, l'utilisation à grande échelle de trithérapies a fait passer le nombre de décès chaque année de 49 000 en 1995 à environ 9 000 en 2001[66].
Ces médicaments peuvent avoir des effets secondaires passagers ou permanents, qui peuvent conduire à l'arrêt ou surtout la modification du traitement, sachant que, correctement suivis, ils ont une efficacité relativement importante.
Antirétroviraux
La recherche sur le VIH/Sida étant très importante, de nombreuses recherches, études et publications voient régulièrement le jour. Mais la durée entre la conception d'une molécule et son autorisation de mise sur le marché oscillant entre sept et douze ans en France[67], il faut relativiser les effets d'annonces qui, pour certaines, ne déboucheront pas sur une application directement pratique dans la lutte contre le VIH/Sida.
Ainsi les seuls médicaments reconnus comme réellement efficaces sont les antirétroviraux ayant reçu leur autorisation de mise sur le marché.
Les antirétroviraux sont classés suivant leur domaine d'action :
Inhibiteurs de la transcriptase inverse
Les inhibiteurs de la transcriptase inverse empêchent la synthèse d'ADN proviral (c'est-à-dire qui va permettre la duplication du virus) à partir de l'ARN viral. On trouve dans cette classe :
- Inhibiteurs nucléosidiques (INTI)
Les INTI ont constitué la première classe d'antirétroviraux mise sur le marché en 1985. Ils comprennent la zidovudine (AZT) (synthétisée en 1964), la didanosine (ddI), la zalcitabine (ddC), la stavudine (d4T), la lamivudine (3TC) (1989 et utilisée à partir de 1995), l'abacavir (ABC) et l'emtricitabine (FTC).
Les mutations du génome à cause de la transcriptase inverse confèrent au VIH une résistance aux INTI, qui peut être croisée entre plusieurs INTI. Ces composés sont tous neutres ou réducteurs, à l'exception de l'AZT qui est un oxydant.
- Inhibiteurs non nucléosidiques (INNTI)
Les INNTI sont des inhibiteurs puissants et très sélectifs de la transcriptase inverse du VIH. On trouve dans cette classe la nevirapine et l'efavirenz. Ils ne sont actifs que sur les VIH-1. Ils sont métabolisés en phénols par oxydation.
- Analogues nucléotidiques
Les analogues nucléotidiques comme le ténofovir qui a été mis sur le marché en 2002, sont des composés organophosphorés.
Inhibiteurs de la protéase
La classe des inhibiteurs de la protéases (IP) est une classe d'antirétroviraux mise sur le marché en 1996. Elle a constitué un tournant majeur dans les stratégies thérapeutiques contre le virus de l'immunodéficience humaine. Ils agissent en inhibant l'action de la protéase virale qui permet le découpage et l'assemblage des protéines virales, processus indispensable à l'obtention de virus infectieux. On obtient alors des virions incapables d'infecter de nouvelles cellules. Les IP sont actifs sur le VIH-1 et le VIH-2, et ne créent pas de résistance croisée avec les INTI ou les INNTI.
Inhibiteurs d'intégrase
Ces inhibiteurs bloquent l'action de l'intégrase et empêchent ainsi le génome viral de se lier à celui de la cellule cible.
Deux inhibiteurs existent : le raltégravir et l'elvitégravir (GS 9137).
Inhibiteurs de fusion
Les inhibiteurs de fusion-lyse interviennent au début du cycle de réplication du VIH, en bloquant les protéines de surface du VIH ou en perturbant les co-récepteurs des cellules ciblées par le VIH.
Plusieurs produits sont à l'étude et, en 2009, seuls l'enfuvirtide et le maraviroc ont reçu une autorisation de mise sur le marché.
Choix thérapeutique
Depuis le début des années 1990 différentes trithérapies ont vu le jour, pouvant être prescrites en fonction du stade clinique, du taux de lymphocytes T CD4+ et de la charge virale. Ce traitement antirétroviral comprend actuellement trois médicaments, en général deux inhibiteurs nucléosidiques de la transcriptase inverse, associés à un inhibiteur des protéases ou à un inhibiteur non nucléosidique de la transcriptase inverse, ou parfois à un troisième inhibiteur nucléosidique de la transcriptase inverse (trithérapies). Un inhibiteur de fusion y est éventuellement associé.
Il n'y a pas de critère précis pour tous les patients fixant le début d'un traitement antirétroviral : cette décision doit être adaptée à chaque patient. Il existe tout de même quelques critères basés sur le nombre de lymphocytes T CD4+. Ainsi, lorsqu'un séropositif a un taux de CD4+ supérieur à 350/mm3, il n'est pas nécessaire de commencer un traitement. Mais, sous la barre des 200/mm3, il est impératif de commencer un traitement. Le nombre de CD4 par rapport au nombre total de lymphocytes est également un critère. Ainsi lorsque les CD4+ représentent moins de 15 % de tous les lymphocytes, un risque d'infection par des maladies opportunistes apparaît[68].
Lors d'un premier traitement, la quasi-totalité des patients voient leur charge virale plasmatique rendue indétectable dans les six premiers mois. Ce premier traitement doit être le plus simple et le mieux toléré possible. C'est la non observance du traitement qui est la principale cause de l'échec thérapeutique[69].
Bien que les traitements antirétroviraux soient très efficaces lorsqu'ils sont bien suivis, le VIH est toujours présent dans l'organisme. Seule sa multiplication est ralentie et, bien qu'indétectable dans le sang, ce dernier, ainsi que le sperme, restent contagieux[70].
Prévention
Même si la recherche est très active et que certains candidats vaccins existent avec pour l'un des résultats encourageants concernant la faisabilité de la mise au point d'un vaccin [71], il n'en existe pas de vraiment efficace contre ce virus. Seul le préservatif offre une protection efficace lors des rapports sexuels. Les dons de sang font l'objet d'une sélection des donneurs, de dépistages systématiques et de traitements spécifiques. Aussi, la prévention se fait par l'utilisation de seringues à usage unique en toute occasion, en particulier en cas de toxicomanie par intraveineuse ou de traitement substitutif.
Traitement post-exposition
Le traitement post-exposition est actuellement le seul moyen de stopper le VIH ou, plutôt, de ne pas être contaminé par le virus, suite à une exposition. En effet, à la suite d'une exposition à un risque de contamination (rapport sexuel non protégé par exemple), au plus tard dans les 48 heures suivant cette exposition, si le traitement est pris, le risque d'être contaminé est réduit de 80 %, ce qui en fait un traitement relativement efficace. La communauté scientifique s'accorde à dire que ce n'est pas suffisant pour être sûr de ne pas contracter le virus. De plus, des problèmes d'intolérance à ces médicaments font que ces traitements ne sont pas toujours pris pendant la durée nécessaire (1 mois). Aussi, l'usage du préservatif est toujours conseillé, car c'est le seul moyen de protection efficace à 100 % s'il est correctement utilisé.
Hypothèses alternatives
Une petite minorité de scientifiques et d'activistes remettent en question le lien entre le VIH et le Sida[72],[73], voire l'existence même du VIH[74],[73], ou encore la validité des tests VIH actuels[75],[73]. Récemment, une personne accusée d'avoir eu des relations sexuelles non protégées a utilisé ces concepts comme système de défense[76],[77]. Ces contestations ne sont pas reprises par la plupart des membres de la communauté scientifique, qui accusent ces personnes d'ignorer l'évidence du rôle du VIH dans le SIDA et d'être une menace pour la santé publique en dissuadant la population de se faire tester ou les malades d'être sous des traitements antirétroviraux qui ont fait leurs preuves[78],[79].
Ces dissidents affirment que l'approche officielle du SIDA, qui considère comme acquise sa causalité rétrovirale, a eu pour conséquence des diagnostics erronés, l'apparition d'une terreur psychologique et d'une certaine forme de racisme, l'utilisation de traitements toxiques et le gaspillage de fonds publics[80],[73]. Ces opinions sont largement rejetées[81],[82] et sont considérées comme de la pseudo-science par la plupart des membres de la communauté scientifique.
Notes et références
- ↑ (fr) 2006 Rapport sur l'épidémie mondiale de SIDA
- ↑ (fr) Le point sur l'épidémie de sida en décembre 2006
- ↑ a et b Hervé J. A Fleury (trad. fr), Virologie humaine, Masson, 2002, 288 p. (ISBN 2294008154), « VIH-1 et VIH-2 - Historique », p. 164
- ↑ a , b et c (fr) La découverte du virus du sida en 1983, Institut Pasteur. Consulté le 9 juillet 2008
- ↑ (en) Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS), de Barre-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, Dauguet C, Axler-Blin C, Vezinet-Brun F, Rouzioux C, Rozenbaum W, Montagnier L
- ↑ (en) Detection, isolation, and continuous production of cytopathic retroviruses (HTLV-III) from patients with AIDS and pre-AIDS, dans Science
- ↑ (en) Isolation of lymphocytopathic retroviruses from San Francisco patients with AIDS, dans Science
- ↑ (en) Blinded By Science
- ↑ (en) Federal Inquiry Finds Misconduct By a Discoverer of the AIDS Virus
- ↑ a , b et c (fr) Paul Benkimoun et Franck Nouchi, « La France, pionnière contre le sida », 7 octobre 2008, Le Monde. Mis en ligne le 7 octobre 2008, consulté le 7 octobre 2008
- ↑ (en) Thomas H. Maugh II, « Nobel Prize awarded for AIDS, cervical cancer research », 7 octobre 2008, Los Angeles Times. Mis en ligne le 7 octobre 2008, consulté le 7 octobre 2008
- ↑ (en) Karl Ritter et Matt Moore, « 3 European scientists share Nobel medicine prize », 6 octobre 2008, Associated Press. Mis en ligne le 6 octobre 2008, consulté le 7 octobre 2008
- ↑ (en) Nucleotide sequence of the AIDS virus, LAV, de Simon Wain-Hobson, Pierre Sonigo, Olivier Danos, Stewart Cole et Marc Alizon
- ↑ (en) Isolation of a new human retrovirus from West African patients with AIDS., de Clavel F, Guetard D, Brun-Vezinet F, Chamaret S, Rey MA, Santos-Ferreira MO, Laurent AG, Dauguet C, Katlama C, Rouzioux C, et al.
- ↑ (fr) Action préventive et lutte contre le syndrome d'immunodéficience acquise, 26 octobre 1987, Organisation des Nations unies. Consulté le 30 novembre 2007
- ↑ (en)Smith, D. K., Grohskopf, L. A., Black, R. J., Auerbach, J. D., Veronese, F., Struble, K. A., Cheever, L., Johnson, M., Paxton, L. A., Onorato, I. A. and Greenberg, A. E. Antiretroviral Postexposure Prophylaxis After Sexual, Injection-Drug Use, or Other Nonoccupational Exposure to HIV in the United States, journal=MMWR, 2005, pages 1-20, volume=54, RR02
- ↑ (en)Donegan, E., Stuart, M., Niland, J. C., Sacks, H. S., Azen, S. P., Dietrich, S. L., Faucett, C., Fletcher, M. A., Kleinman, S. H., Operskalski, E. A., et al. Infection with human immunodeficiency virus type 1 (HIV-1) among recipients of antibody-positive blood donations. Ann. Intern. Med. 1990, pages 733-739, volume 113, issue 10, PMID 2240875
- ↑ (en)Coovadia, H. Antiretroviral agents—how best to protect infants from HIV and save their mothers from AIDS, N. Engl. J. Med., 2004, pages 289-292, volume 351, issue 3, PMID 15247337
- ↑ (en)Kaplan, E. H. and Heimer, R. HIV incidence among New Haven needle exchange participants: updated estimates from syringe tracking and testing data, J. Acquir. Immune Defic. Syndr. Hum. Retrovirol., 1995, pages 175-176, volume 10, issue 2, PMID 7552482
- ↑ a , b , c et d (en)European Study Group on Heterosexual Transmission of HIV, Comparison of female to male and male to female transmission of HIV in 563 stable couples, BMJ., 1992, pages 809-813, volume 304, issue 6830, PMID 1392708
- ↑ a , b , c , d , e et f (en)Varghese, B., Maher, J. E., Peterman, T. A., Branson, B. M. and Steketee, R. W., Reducing the risk of sexual HIV transmission: quantifying the per-act risk for HIV on the basis of choice of partner, sex act, and condom use, Sex. Transm. Dis., 2002, pages 38-43, volume 29, issue=1, PMID 11773877
- ↑ (en)Bell, D. M., Occupational risk of human immunodeficiency virus infection in healthcare workers: an overview., Am. J. Med., 1997, pages 9-15, volume 102, issue 5B, PMID 9845490
- ↑ (en)Leynaert, B., Downs, A. M. and de Vincenzi, I., Heterosexual transmission of human immunodeficiency virus: variability of infectivity throughout the course of infection. European Study Group on Heterosexual Transmission of HIV, Am. J. Epidemiol., year 1998, pages 88-96, volume 148, issue 1, PMID 9663408
- ↑ (fr) Les rétrovirus, page 13 et suivante, dans la section La transmission du VIH
- ↑ (fr) Virologie, page 121
- ↑ (fr) Les rétrovirus, page 14, dans la section materno-fœtale
- ↑ (en) Antiretroviral Agents — How Best to Protect Infants from HIV and Save Their Mothers from AIDS, de Hoosen Coovadia, dans le The New England Journal of Medicine du 15 juillet 2004
- ↑ Ce cycle de réplication est celui communément admis par la communauté scientifique, mais un groupe de chercheurs britanniques et américains contestent cette théorie et pensent que le VIH se reproduit en détruisant certains des globules blancs qui jouent le rôle de chef d'orchestre du système immunitaire. Voir l'article du quotidien Le Monde : Le fonctionnement du sida remis en cause par des chercheurs, du 26 juin 2007 et l'article original Understanding the Slow Depletion of Memory CD4+ T Cells in HIV Infection, dans la revue PLoS Medicine
- ↑ (en) Cellular Targets, sur le site du National Institute of Allergy and Infectious Diseases
- ↑ (fr) F. Brun-Vézinet, F. Damond et F. Simon, « Variabilité des virus de l'immunodéficience humaine de type 1 », 13 octobre 1999, p. 2. Consulté le 20 novembre 2007
- ↑ a et b (en) Jean-Christophe Plantier, Marie Leoz, Jonathan E Dickerson, Fabienne De Oliveira, François Cordonnier, Véronique Lemée, Florence Damond, David L Robertson et François Simon, « A new human immunodeficiency virus derived from gorillas », 2 août 2009, Nature. Mis en ligne le 2 août 2009, consulté le 3 août 2009
- ↑ a et b (fr) Jean-Christophe Plantier, « Informations virologiques », 2005, CHU Rouen - Unité de Virologie, p. 5. Consulté le 20 novembre 2007
- ↑ (fr) Jean-Christophe Plantier, « Informations virologiques », 2005, CHU Rouen - Unité de Virologie, p. 7 et 8. Consulté le 20 novembre 2007
- ↑ (en) Saladin Osmanov, Claire Pattou, Neff Walker, Bernhard Schwardlander, Jose Esparza, and the WHO-UNAIDS Network for HIV Isolation and Characterization, « Estimated Global Distribution and Regional Spread of HIV-1 Genetic Subtypes in the Year 2000 », 1er février 2002, Journal of Acquired Immune Deficiency Syndromes. Consulté le 20 novembre 2007
- ↑ (fr) F. Brun-Vézinet, F. Damond et F. Simon, « Variabilité des virus de l'immunodéficience humaine de type 1 », 13 octobre 1999, p. 3. Consulté le 20 novembre 2007
- ↑ (fr) Claire Criton et Patricia Fener, « Dépistage du VIH/sida chez la femme à risque », mai 2007, Centre national de la recherche scientifique, p. 10. Consulté le 17 octobre 2007
- ↑ a et b (fr) Les rétrovirus, dans la section La variation prend naissance au niveau des gènes, page 11
- ↑ a et b (fr) Virologie, dans la section La transcriptase inverse ou rétrotranscriptase (RT), page 119
- ↑ Preston BD, Poiesz BJ, Loeb LA. Fidelity of HIV-1 reverse transcriptase. Science. 1988 Nov 25;242(4882):1168–1171. PubMed. Error rates : 1/2000 to 1/4000, 5 to 10 errors per HIV-1 genome per round of replication in vivo.
- ↑ Roberts JD, Bebenek K, Kunkel TA. The accuracy of reverse transcriptase from HIV-1. Science. 1988 Nov 25;242(4882):1171–1173. PubMed. Average error rate of 1/1700.
- ↑ Diaz L, Destefano JJ. Abstr Gen Meet Am Soc Microbiol. 1998 May 17-21; 98: 493 (abstract no. T-16). Univ. of Maryland, College Park, USA. Fidelity of processive DNA synthesis by HIV-1 reverse transcriptase. Abstract. 1 error every 7500 bases copied
- ↑ (fr) F. Brun-Vézinet, F. Damond et F. Simon, « Variabilité des virus de l'immunodéficience humaine de type 1 », 13 octobre 1999, p. 1. Consulté le 20 novembre 2007
- ↑ (fr) Virologie, dans la section Indications des examens, page 126
- ↑ comme en France dans les années 1980 avec l'Affaire du sang contaminé et en République populaire de Chine dans les années 1990.
- ↑ (fr) Les rétrovirus, dans la section Le diagnostique biologique - L'apparition des anticorps demande un certain temps…, page 16
- ↑ La détection discordante ne s'entend que dans le cas de double test
- ↑ (fr) Les rétrovirus, dans la section Autres tests pour le diagnostic biologique, page 18 et 1
- ↑ (fr) Recommandations 2006 du groupe d'experts du Ministère français de la Santé, dans la section Traitement antirétroviral, page 22 et suivantes
- ↑ a et b (fr) Les rétrovirus, dans la section Évaluer la réplication virale, page 21
- ↑ a , b et c Delfraissy JF Mécanismes immunologiques et virologiques impliqués dans l'infection à virus de l'immunodéficience humaine : impact des traitements La Revue du Praticien 1999,49 ;1740-1745
- ↑ (fr) Institut Pasteur, « Découverte de la stratégie du VIH pour se multiplier dans certains globules blancs », Institut Pasteur. Mis en ligne le 21 août 2007, consulté le 27 août 2007 Découverte de la stratégie du VIH pour se multiplier dans certains globules blancs
- ↑ Ho DD, Neumann AU, Perelson AS, Chen W, Leonard JM, Markowitz M. Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection. Nature 1995 Jan 12;373(6510):123-6.
- ↑ (fr) Les rétrovirus, page 15 et suivantes, dans la section Les non-progresseurs à long terme
- ↑ (fr) Les asymptomatiques à long terme : virus peu agressif ou immunité démultipliée ?
- ↑ HIV Controllers: A Homogeneous Group of HIV-1–Infected Patients with Spontaneous Control of Viral Replication, table 1 (2005)
- ↑ Revue neurologique ISSN 0035-3787 CODEN RENEAM INIST-CNRS, Cote INIST : 3097, 35400013472437.0040
- ↑ Observatoire National des "HIV Controllers", La gazette N°1
- ↑ Valérie Martinez, Les HIV controllers : une nouvelle entité évolutive de l’infection par le VIH ?, Médecine Sciences, janvier 2008.
- ↑ Site de l'Observatoire National des "HIV Controllers"
- ↑ (en) Chiffres de novembre 2007, Onusida
- ↑ (fr) Surveillance de l’infection à VIH-sida en France, 2005, www.invs.sante.fr.
- ↑ (en)Effective therapy has altered the spectrum of cause-specific mortality following HIV seroconversion. AIDS. 2006 Mar 21;20(5):741-9. Full text.
- ↑ « Dix ans de trithérapie ont changé la face de la maladie », Pr Jean-François Delfraissy, directeur de l’Agence nationale de recherches sur le sida, Libération, 2 mars 2006.
- ↑ Voir (en)Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. HIV Outpatient Study Investigators., N Engl J Med. 1998 Mar 26;338(13):853-60. et (fr) Baisse de la morbidité et de la mortalité chez les patients à un stade avancé de l'infection VIH, transcriptases, n°65 - mai 98.
- ↑ (fr) Séropositivité, HAART et mortalité, transcriptases, n°119 - décembre/janvier 2005.
- ↑ Biologie, chapitre 26.3, page 538
- ↑ (fr) Innovation : comment les médicaments sont-ils découverts ?, Les entreprises du médicament. Mis en ligne le 31 mai 2006, consulté le 14 octobre 2007
- ↑ (fr) Jean-François Delfraissy et autres, « Prise en charge thérapeutique des personnes infectées par le VIH - Rapport 2004 - Sous la direction du Professeur Jean-François Delfraissy », 2004, Éditions Flammarion, p. 43. Consulté le 3 décembre 2007
- ↑ (fr) Jean-François Delfraissy et autres, « Prise en charge thérapeutique des personnes infectées par le VIH - Rapport 2004 - Sous la direction du Professeur Jean-François Delfraissy », 2004, Éditions Flammarion, p. 48-49. Consulté le 3 décembre 2007
- ↑ (fr) Gérard Ammerich, « Sida et trithérapie », 2004, SantéGuérir. Consulté le 3 décembre 2007
- ↑ (fr) Jean-Luc Goudet, « Premiers résultats encourageants pour un vaccin contre le Sida ! », 24 septembre 2009, Futura-Sciences.com. Mis en ligne le 24 septembre 2009, consulté le 25 septembre 2009
- ↑ (en) P. H. Duesberg, « HIV is not the cause of AIDS », dans Science, vol. 241, no 4865, 1988, p. 514, 517 [texte intégral lien PMID]
- ↑ a , b , c et d Jean-Claude Roussez, Sida : Supercherie scientifique et arnaque humanitaire, Marco Pietteur, mai 2004, Broché, 160 p. (ISBN 2874340162)
- ↑ (en) E. Fiala, V. F. Turner, J. Papadimitriou, B. Page, D. Causer, H. Alfonso, S. Mhlongo, T. Miller, A. Maniotis et C. , « A critique of the Montagnier evidence for the HIV/AIDS hypothesis », dans Med Hypotheses, vol. 63, no 4, 2004, p. 597-601 [texte intégral lien PMID]
- ↑ (en) E. Papadopulos-Eleopulos, V. F. Turner, J. Papadimitriou, B. Page et D. Causer, « No proof HIV antibodies are caused by retroviral infection », dans Emerg Med Australas, vol. 18, no 3, 2006, p. 308-9 [[pdf] texte intégral lien PMID]
- ↑ Colin James, « Hogwash claim in HIV appeal », 12 février 2007, the Advertiser
- ↑ Jeremy Roberts, « AIDS specialist called to explain evidence », 12 février 2007, The Australian
- ↑ (en) J. Cohen, « The Duesberg phenomenon », dans Science, vol. 266, no 5191, 1994, p. 1642-1644 [[pdf] texte intégral lien PMID]
- ↑ [pdf] Various, « HIV Science and Responsible Journalism. Seminar at the XVI International AIDS Conference », 13 août 2006, Kaiser Family Foundation. Consulté le 7 décembre 2006
- ↑ Various, « Controversy », rethinkingaids.com
- ↑ (en) J. Cohen, « The Controversy over HIV and AIDS », dans Science, vol. 266, no 5191, 1994, p. 1642-1649 [[pdf] texte intégral]
- ↑ Various, « Focus on the HIV-AIDS Connection: Resource links », National Institute of Allergy and Infectious Diseases. Consulté le 7 septembre 2006
Voir aussi
Articles connexes
- Gp120 ;
- Discrimination des porteurs du VIH ;
- Virus de l'immunodéficience féline, ou VIF, qui provoque le sida du chat ;
- Le programme FightAIDS@Home.
Sources
- (fr) La découverte du virus du Sida en 1983, sur le site de l'Institut Pasteur (pour la section Histoire)
- (fr) Les rétrovirus, cours de Anne Decoster (pour la section Histoire, Structure, Transmission, Cycle de réplication, Variabilité génétique et Diagnostic et suivi infectieux)
- (fr) Virologie, cours de Jean-Marie Huraux, Henri Agut, Anne-Marie Fillet, Vincent Calvez, Vincent Thibault, Agnès Gautheret-Dejean, Anne-Geneviève Marcelin, Claire Deback (pour la section Structure, Transmission, Cycle de réplication, Variabilité génétique et Diagnostic et suivi infectieux)
- Chapitre 26 de Biologie (pour la section Cycle de réplication)
Liens externes
- (en) HIV Medecine, livre médical synthétisant les connaissances sur les traitements du VIH/Sida en 2006
- (en) Les publications de Gallo et Popovic dans "Science" en 1984
- (en) Le premier "jet" de la publication précédente
- (en) World AIDS Day 2005 - Décembre 1
- (en) National Institute of Health: The Evidence that HIV causes AIDS
- (en) NIH Evidence Rebuttal
- (en) Interview with Kary Mullis about HIV and AIDS (1994)
- (fr)(en) Formation Médicale Continue sur le VIH
- (en) HIV InSite L'Université de Californie à San Francisco
- (fr) Mode de fonctionnement du virus
- (fr) Intégration et mode expression du virus par Georges Dolisi
- (fr) Sida et VIH, porteurs du virus dans le monde & défis à relever - résumé par GreenFacts d'un rapport de ONUSIDA (2006)
- Portail de la médecine
- Portail de la microbiologie
Catégories : VIH/Sida | Cancérogène biologique
Wikimedia Foundation. 2010.